Lipidtherapie in der Primär- und Sekundärprävention
Neben arterieller Hypertonie, Rauchen, Adipositas und Glukosestoffwechselstörungen gehören Lipidstoffwechselstörungen zu den wichtigsten Risikofaktoren für die Entstehung der Atherosklerose. Falls kein Verdacht auf Diabetes mellitus oder familiäre Hypercholesterinämie besteht, soll ab dem 40. Lebensjahr ein Lipidstatus und ein kardio-vaskuläres Risikoscreening durchgeführt werden. Ein Lipidstatus besteht aus Gesamtcholesteri, Low-Densitiy-Lipoprotein-Cholesterin (LDL-C), High-Density-Lipoprotein-Cholesterin (HDL-C) und Triglyzeriden (TG). Die Patienten müssen bei der Blutabnahme nicht mehr, so wie früher, nüchtern sein. Nur bei sehr hohen TG soll eine Nüchternblutabnahme durchgeführt werden. Die Zielwerte ergeben sich aus dem kardiovaskulären Gesamtrisiko.
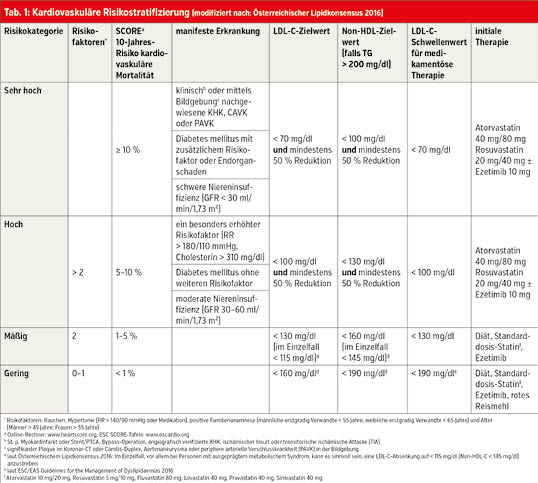
Risikostratifizierung
Patienten mit kardiovaskulärer Erkrankung in der Anamnese oder einem signifikanten Plaque im Carotis-Duplex oder im Koronar-CT sowie Patienten mit Diabetes mellitus oder chronischer Niereninsuffizienz haben ein hohes oder sehr hohes kardiovaskuläres Risiko (Tab. 1). Falls ein Risikofaktor besonders stark ausgeprägt ist, besteht auch automatisch ein hohes kardiovaskuläres Risiko. Bei allen anderen Personen sollen die Risikofaktoren Rauchen, Hypertonie (RR > 140/90 mmHg oder Medikation), positive Familienanamnese (männliche erstgradig Verwandte < 55 Jahre; weibliche erstgradig Verwandte 45 Jahre; Frauen > 55 Jahre) erhoben werden. Falls zwei oder mehr Faktoren positiv sind, soll das individuelle Risiko mittels SCORE-Tabellen bestimmt oder errechnet werden (www.heartscore.org). Bei Patienten mit einem LDL-C > 190 mg/dl und positiver Familienanamnese muss unbedingt an eine heterozygote, familiäre Hypercholesterinämie (FH) gedacht werden, da bei dieser Erkrankung ein massiv erhöhtes kardiovaskuläres Risiko besteht und Studien gezeigt haben, dass im Mittel nur ein Lebensalter von circa 60 Jahren erreicht wird. Diese Patienten sollen an speziellen Zentren betreut werden.
Zielwerte
Bei den Zielwerten ist primär das LDL-C wichtig (Tab. 1) und bei TG > 200 mg/dl das Non-HDL-C (Gesamtcholesterin minus HDL-C), da bei hohen TG auch das Cholesterin der TG-reichen Lipoproteine atherogen wirkt. Der Zielwert des Non-HDL-C liegt immer 30 mg/dl über dem Zielwert für das LDL-C. HDL-Ratios dürfen nicht mehr zur Risikostratifizierung oder als Therapieziel herangezogen werden. Bei allen Hochrisiko-Patienten muss das LDL-C um zumindest 50 % gesenkt werden. Dies bedeutet zum Beispiel, dass ein Patient mit KHK und einem LDL-C von 110 mg/dl einen Zielwert von < 55 mg/dl hat und zumindest ein Hochdosis-Statin erhalten muss.
Diät und Bewegung
Bei Hochrisikopatienten muss unverzüglich mit einer medikamentösen Therapie begonnen werden. Bei Patienten mit mäßigem oder geringem Risiko sollen primär Diät und körperliche Aktivität empfohlen werden. Cholesterin ist nur in tierischen Produkten enthalten. Der Konsum von gesättigten Fettsäuren (Wurst, fettes Fleisch, Vollmilchprodukte, fette Käsesorten, Palm- und Kokosnussöl) soll reduziert und der von ungesättigten Fettsäuren (Fisch, pflanzliche Fette, Nüsse) sowie von Ballaststoffen (Vollkornprodukte, Hülsenfrüchte, Gemüse, Obst) soll gesteigert werden. Auch Nahrungsergänzungsmittel mit rotem Reismehl (circa 2,5–10 mg Monacolin K pro Tag) können bei Patienten mit niedrigem Risiko als Bestandteil der Diät verwendet werden und können das LDL-C um 10–20 % senken. Falls nach drei Monaten weiterhin die angegebenen Schwellenwerte (Tab. 1) überschritten werden, soll eine medikamentöse Therapie eingeleitet werden.
Medikamentöse Therapie
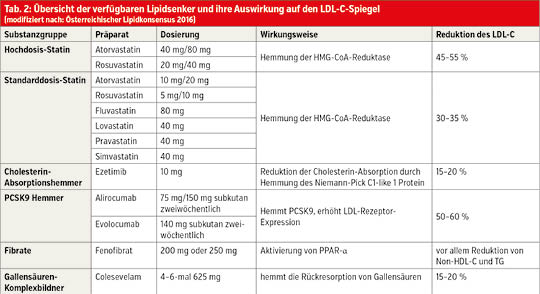
Statine: Statine hemmen die Cholesterinsynthese der Leber. Hochdosis-Statine (Tab. 2) senken den LDL-C-Wert im Mittel um 45–55 % und sind Erstlinientherapie bei Patienten mit hohem oder sehr hohem kardiovaskulären Risiko. Statine gehören zu den am meisten untersuchten Medikamenten in der kardiovaskulären Medizin. Daten der Cholesterol Treatment Trialists (CTT) von mehr als 170.000 Patienten aus 26 randomisierten Studien zeigen, dass eine Reduktion des LDL-C um 40 mg/dl zu 20 % relativer Reduktion der kardiovaskulären Mortalität führt. Statine erhöhen minimal das Risiko für Diabetes mellitus. Dies beeinflusst jedoch nicht die Nutzen-Risiko-Bewertung bei Personen mit mäßigem oder hohem kardiovaskulären Risiko, soll jedoch bei geringem kardiovaskulären Risiko zu einer Nutzen-Risiko-Abwägung führen. Bei 0,5–2 % kommt es zu einem Anstieg der Leberenzyme, weshalb empfohlen wird, die Leber- und Cholesterinwerte 8 Wochen nach Beginn einer Statintherapie zu kontrollieren.
Ezetimib ist ein nebenwirkungsarmer Hemmer der Cholesterinresorption in der Darmwand und senkt das LDL-C in der Monotherapie und in Kombination mit Statinen um circa 15–20 %. Falls der LDL-C-Zielwert mit der maximal tolerierten Statindosis nicht erreicht wird, soll Ezetimib kombiniert werden. Diese Kombination zeigte auch eine signifikante Reduktion von kardiovaskulären Ereignissen.
Die PCSK9-Hemmer Alirocumab und Evolocumab werden alle zwei Wochen subkutan verabreicht, senken das LDL-C um 50 % bis 60 %, haben in Studien die Rate von kardiovaskulären Ereignissen reduziert und sind sehr nebenwirkungsarm. Derzeit werden diese Medikamente nach akuten kardiovaskulären Ereignissen erstattet, wenn mit der Kombination aus Hochdosis-Statin und Ezetimib ein LDL-C-Wert von unter 100 mg/dl nicht erreicht wird. PCSK9-Hemmer dürfen derzeit nur von spezialisierten Stoffwechselzentren verschrieben werden.
Fibrate: Bei Hochrisikopatienten mit TG > 200 mg/dl soll versucht werden, mittels Statintherapie das Non-HDL-Ziel von 100 mg/dl oder 130 mg/dl zu erreichen. Falls dies nicht gelingt, kann Fenofibrat kombiniert werden. Man soll Fenofibrat nicht mit der höchsten Statindosis (Atorvastatin 80 mg oder Rosuvastatin 40 mg) kombinieren, und die GFR muss > 60 ml/min/1,73 m² sein. Bezafibrat und Gemfibrozil sollen nicht mit Statinen kombiniert werden.
Spezielle Patientengruppen
Lipoprotein(a)-Erhöhung: Lipoprotein(a) [Lp(a)] zeigt große Ähnlichkeit zu LDL-C, enthält aber das Protein Apolipoprotein(a). Lp(a) ist ein unabhängiger Risikofaktor, die Höhe von Lp(a) ist genetisch determiniert und kann durch Diät oder Statintherapie nicht verändert werden. Lp(a) soll bei Patienten mit frühzeitiger KHK, positiver Familienanamnese oder mäßig bis hohem kardiovaskulären Risiko bestimmt werden. Ein Wert von über 50 mg/dl (125 nmol/l) ist mit einer Erhöhung des kardiovaskulären Risikos assoziiert. Da Lp(a) derzeit noch nicht gesenkt werden kann, sollte bei diesen Patienten versucht werden, das kardiovaskuläre Risiko durch intensive LDL-Senkung zu reduzieren. Wenn Patienten nach kardiovaskulären Ereignissen mit einem Lp(a) > 100 mg/dl (250 nmol/l) unter maximaler LDL-Therapie eine Progression ihrer Erkrankung aufweisen, soll eine Lipidapherese evaluiert werden.
Akutes Koronarsyndrom: Jeder Patient mit akutem Koronarsyndrom soll so rasch wie möglich ein Hochdosis-Statin erhalten, unabhängig von seinem LDL-C-Wert. Falls zu erwarten ist, dass der Zielwert von < 70 mg/dl mittels Statin-Monotherapie nicht sicher erreicht werden kann, soll frühzeitig Ezetimib kombiniert und eine Kontrolle zur Evaluierung einer PCSK9-Hemmer-Therapie vereinbart werden.
Statinunverträglichkeit: Häufig klagen Patienten über Muskelbeschwerden unter Statintherapie. Studien haben jedoch gezeigt, dass nur 5–10 % der Patienten eine wirkliche Statinunverträglichkeit haben. Ein Absetzen des Statins in der Sekundärprävention ist einer der wichtigsten Risikofaktoren für ein neuerliches kardiovaskuläres Ereignis, weshalb klinisch beobachtet werden soll, ob die Beschwerden nach Pausierung des Statins wirklich besser werden und nach Therapie mit zumindest einem zweiten Statin neuerlich auftreten. Es ist auch zu empfehlen, Ezetimib mit einer niedrigeren Statindosis zu kombinieren. In seltenen Fällen kann auch versucht werden, den Gallensäuren-Komplexbildner Colesevelam zu verwenden. Falls in der Sekundärprävention Atorvastatin und Rosuvastatin nicht vertragen werden und das LDL-C trotz Ezetimib > 100 mg/dl ist, soll die Indikation zur PCSK9-Hemmer-Therapie gestellt werden.
Wissenswertes für die Praxis
- In der Primärprävention richtet sich der LDL-C-Zielwert nach dem kardiovaskulären Risiko.
- HDL-Ratios dürfen nicht mehr zur Risikostratifizierung oder als Therapieziel herangezogen werden.
- Alle Patienten mit kardiovaskulärer Erkrankung oder einem signifikanten Plaque im Carotis-Duplex oder im Koronar-CT benötigen ein Hochdosis-Statin.
- Nur 30 % der Hochrisikopatienten erreichen ihren Zielwert, Ezetimib senkt das LDL-C um weitere 15–20 %.
- PCSK9-Hemmer sind bei sehr hohem LDL-C oder bei Statinunverträglichkeit eine neue Therapieoption.
- Bei LDL-C > 190 mg/dl und positiver Familienanamnese muss an eine familiäre Hypercholesterinämie gedacht werden.