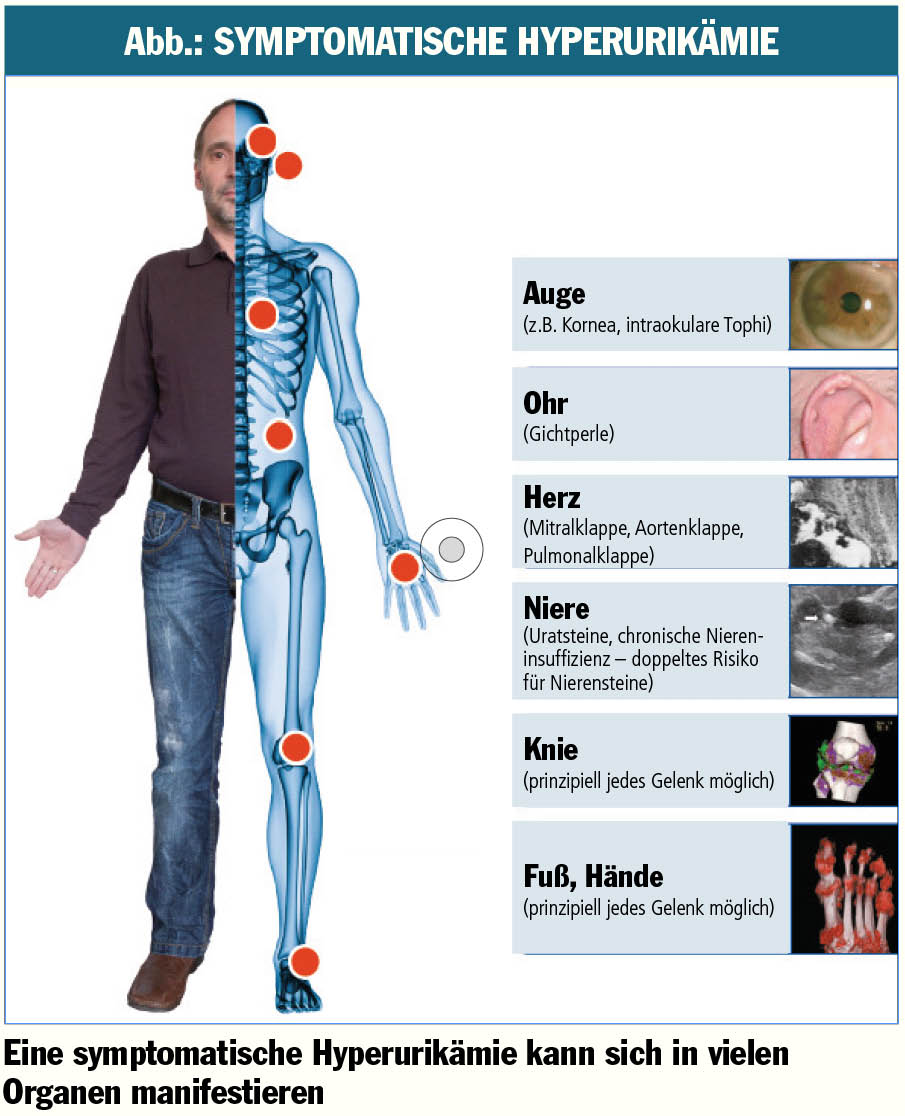
Symptomatische Hyperurikämie – eine chronische Systemerkrankung
Unabhängiger Risikofaktor für kardiovaskuläre Erkrankungen
Eine Assoziation zwischen erhöhten Harnsäurewerten bzw. einer symptomatischen Hyperurikämie und dem Auftreten kardiovaskulärer Erkrankungen wird seit mehr als 100 Jahren vermutet. Dass eine solche Verbindung besteht, zeigen viele epidemiologische Studien, in denen erhöhte Harnsäurespiegel mit verschiedenen Erkrankungen verbunden waren, wie etwa arterieller Hypertonie, metabolischem Syndrom und Niereninsuffizienz.1, 2 Bislang war jedoch unklar, ob erhöhte Harnsäurewerte lediglich mit solchen Erkrankungen gemeinsam auftreten oder ob sie selbst als eigener Risikofaktor an der Entstehung von Herz-Kreislauf-Erkrankungen beteiligt sind. Neuere Studien belegen, dass symptomatische Hyperurikämie – aber auch bereits lediglich erhöhte Harnsäurewerte – unabhängige kardiovaskuläre Risikofaktoren sind.
So kam unter anderem die Mehrheit der kürzlich durchgeführten epidemiologischen Studien, die sich mit Bluthochdruck und Hyperurikämie befassten, zu dem Schluss, dass Harnsäure ein unabhängiger Risikofaktor für die Entwicklung von Bluthochdruck ist. Die „Normative Aging Study“3 hat gezeigt, dass der Urat-Wert im Serum unabhängig die Entwicklung von Bluthochdruck vorhersagt, wenn altersangepasste und multivariate Modelle verwendet wurden, die den Body-Mass-Index, den Bauchumfang, den Alkoholkonsum, die Blutfettwerte, den Glukosespiegel im Plasma und den Raucherstatus zusammen mit der Nierenfunktion und der Insulinresistenz miteinbezogen. Darüber hinaus hat eine neue Analyse der MRFIT-Studie4 gezeigt, dass zum Studienbeginn normotensive Männer mit Hyperurikämie im Vergleich zur Gruppe ohne Hyperurikämie ein zusätzliches Risiko von 80% hatten, Bluthochdruck zu entwickeln.
Symptomatische Hyperurikämie erhöht Mortalitätsrisiko
Wesentliche erste Hinweise auf den Zusammenhang einer symptomatischen Hyperurikämie und einem erhöhten Mortalitätsrisiko ergaben sich u.a. aus einer Arbeit von Choi et al. (2007).5 In der multivariaten Analyse zeigte sich, dass bei Patienten ohne zu Studienbeginn vorliegender koronarer Herzerkrankung (CHD) eine symptomatische Hyperurikämie zu einer um 28% erhöhten Gesamtmortalität gegenüber der Vergleichsgruppe führte. Hierbei war die Sterblichkeit durch kardiovaskuläre Ursachen (CVD) um 38% und die durch CHD sogar um 55% gesteigert. Auch wenn nur die Patienten in die Auswertung einbezogen wurden, bei denen bereits am Studienbeginn eine CHD bestand, war das Risiko an einer CVD oder CHD zu versterben bei denjenigen mit symptomatischer Hyperurikämie um 26 bzw. 24% höher als in der Vergleichsgruppe. Hieraus schlossen die Autoren, dass Männer mit einer symptomatischen Hyperurikämie ein höheres Sterberisiko aufweisen.
Weitere Belege lieferte 2012 eine systematische Übersichtsarbeit von Lottmann et al.6 Trotz der sehr heterogenen Patientenpopulationen und Studiendesigns zeigte sich in allen sieben Langzeitstudien, in denen eine Assoziation zwischen symptomatischer Hyperurikämie und Gesamtmortalität bzw. kardiovaskulärer Mortalität untersucht worden war, dass eine symptomatische Hyperurikämie ein unabhängiger Risikofaktor für eine erhöhte Gesamtmortalität war, der das adjustierte relative Risiko im Vergleich zu Teilnehmern ohne symptomatische Hyperurikämie signifikant um 18–76% steigerte. Auch in den vier Studien, in denen zusätzlich die kardiovaskuläre Sterblichkeit untersucht wurde, war die symptomatische Hyperurikämie ein unabhängiger Risikofaktor, der das adjustierte relative Risiko hierfür um18–97% erhöhte. Zudem konnte in einer Studie beobachtet werden, dass sich die kardiovaskuläre Mortalität bei Männern um 9%, bei Frauen sogar um 26% pro Anstieg der Serum-Harnsäure um 1 mg/dl erhöhte.7
Harnsäurewerte und kardiovaskuläre Ereignisse
Bestätigt wurden diese Mortalitätsrisiken von einer Arbeit, publiziert 2013 von Stack et al.8 Wie die multivariate Analyse zeigte, hatten Teilnehmer mit symptomatischer Hyperurikämie im Vergleich zu solchen ohne die Erkrankung ein um 42% höheres Risiko im Bezug auf die Gesamtmortalität und ein um 58% höheres kardiovaskuläres Sterberisiko. Hierbei erhöhte sich in beiden Endpunkten das Mortalitätsrisiko durch eine Steigerung des Harnsäurewerts um 1 mg/dl um jeweils 16%.
Fazit: Gicht und Serum-Harnsäure sind mit Gesamtmortalität und erhöhtem kardiovaskulären Risiko assoziiert. Das Risiko erhöht sich mit steigender Harnsäurekonzentration. Umso wichtiger erscheint es, in künftigen prospektiven Studien zu untersuchen, inwieweit eine harnsäuresenkende Therapie dazu beitragen kann, dieses Risiko zu mindern. Erste Hinweise hierfür ergeben sich sowohl aus tierexperimentellen als auch aus kleineren klinischen Studien.
Einfluss einer erhöhten Serum-Harnsäure auf die Nieren
Nierenerkrankungen gehören zu den am häufigsten auftretenden Begleiterkrankungen einer symptomatischen Hyperurikämie. Etwa zwei von fünf Patienten leiden unter einer chronischen Form.9 Verschiedene epidemiologische Studien konnten zudem in den vergangenen Jahren einen Zusammenhang zwischen der Entstehung einer chronischen Niereninsuffizienz und hohen Harnsäurespiegeln zeigen.10 Die Entstehung einer chronischen Niereninsuffizienz wird durch Nierensteine begünstigt.11
Wie eine Kohortenstudie aus Kanada11 belegt, kann bereits eine einzelne Episode mit einem signifikant erhöhten Risiko für eine dauerhafte Einschränkung der Nierenfunktion einhergehen. Bei Patienten mit symptomatischer Hyperurikämie besteht ein fast doppelt so hohes Risiko, Nierensteine zu entwickeln wie bei Menschen, die nicht unter dieser Erkrankung leiden.12 So entwickeln circa 4–40% dieser Patienten im Laufe der Zeit Nierensteine. Die Wahrscheinlichkeit hierfür steigt mit einem niedrigen Urinvolumen, dem Ausmaß der Harnsäureausscheidung über den Urin und einem niedrigen Harn-pH-Wert.13 Am häufigsten entwickeln Patienten mit symptomatischer Hyperurikämie reine Harnsäuresteine, seltener Oxalat- oder Mischsteine.14 Unabhängig von der Steinart kann es durch deren Vorhandensein zu heftigen, schmerzhaften Nierenkoliken kommen.15 Wird hierbei nur die Koliksymptomatik behandelt, während die Harnsäurewerte dauerhaft erhöht sind, kann es zu weiteren Ablagerungen von Harnsäurekristallen und damit zur Neubildung von Nierensteinen kommen. Deshalb sollte man bei diesen Patienten eine geeignete harnsäuresenkende Therapie ansetzen, um den Zielwert von < 6 mg/dl zu erreichen und der weiteren Steinbildung vorzubeugen.16
Hohe Harnsäurespiegel auch für Gesunde gefährlich
Die Nierenleistung von Patienten, die bisher keine symptomatische Hyperurikämie haben, ist ebenfalls durch ständig erhöhte Harnsäurewerte bedroht. Studien zeigen, dass der Hauptmechanismus in einer harnsäureinduzierten endothelialen Dysfunktion und einer lokalen Entzündungsreaktion in der Niere besteht17. Wie tierexperimentelle Studien belegen, kommt es hierdurch zur Umwandlung renaler Tubuszellen in Fibroblasten und damit zur Reduktion der Nierenfunktion.17 Dass das Risiko für die Entstehung einer Niereninsuffizienz mit steigender Harnsäurekonzentration wächst, belegt auch die Studie von Obermayr et al.10, in der bei 21.000 gesunden Menschen der Einfluss der Harnsäurewerte auf das Niereninsuffizienz-Risiko ermittelt wurde. Danach war das Risiko für eine Niereninsuffizienz bei Harnsäurewerten zwischen 7–9 mg/dl (420–540 mmol/l) doppelt so hoch wie bei Harnsäurespiegeln unter 7 mg/dl (420 mmol/l). Bei Harnsäurewerten über 9 mg/dl war das Risiko sogar dreifach erhöht. Ein erhöhter Harnsäurespiegel im Blut dürfte also an der Entstehung von chronischen Nierenerkrankungen beteiligt sein. Es sind jedoch noch weitere Studien erforderlich, bevor harnsäuresenkende Therapien bei Patienten mit chronischer Nierenerkrankung Anwendung finden können.
Therapeutischer Zielwert: Serum-Harnsäure ≤ 6 mg/dl
Die klinischen Manifestationen der symptomatischen Hyperurikämie in Form von wiederkehrenden Gichtanfällen sowie der Ausbildung von Gichttophi sind auf die Ablagerung von Mononatriumuratkristallen zurückzuführen. Wenn diese vollständig aufgelöst werden und sich keine neuen Kristalle mehr bilden können, treten keine weiteren Gichtanfälle mehr auf; bestehende Tophi werden aufgelöst. Um dieses Ziel zu erreichen, muss der Harnsäurespiegel im Serum – und somit auch der Harnsäurespiegel im Gewebe und in den Gelenken – unterhalb des Sättigungspunktes für Mononatriumurat liegen.18
Die Arbeitsgruppe für Gicht der Europäischen Liga gegen Rheumatismus (EULAR) rät in ihren evidenzbasierten Empfehlungen, die Harnsäure im Serum auf einen Zielwert von ≤ 6 mg/dl (360 mmol/l) zu senken.18,19 Zudem weisen die EULAR-Empfehlungen darauf hin, dass bei Patienten mit einer sehr starken Kristallablagerung womöglich ein niedrigerer Zielwert angemessen erscheinen kann. Das bestätigen auch die Leitlinien des American College of Rheumatology (ACR), die als Minimalziel eine dauerhafte Harnsäuresenkung unter 6 mg/dl (360 mmol/l), in schweren Fällen sogar unter 5 mg/dl empfehlen.16
Am häufigsten wird zur Senkung des Harnsäurespiegels der nicht-selektive Xanthinoxidaseinhibitor Allopurinol eingesetzt. Bei Intoleranz von Allopurinol, Unwirksamkeit oder Kontraindikation von Urikosurika oder Nicht-Erreichen des Therapieziels (< 6 mg/dl [360 μmol/l] sUA) kann der selektive Xanthinoxidaseinhibitor Febuxostat eingesetzt werden.
Quelle: Veranstaltung „Interdisziplinärer Harnsäuregipfel“, 25. 2. 2014, Berlin
1 Feig DI et al., NEJM 2008; 359 (17):1811–1821
2 Tausche AK et al., Z Rheumatol 2012. DOI 10.1007/s00393-011-0953-9
3 Perlstein TS et al., Hypertension 2006; 48:1031–1036
4 Krishnan E et al., Hypertension 2007; 49:298–303
5 Choi HK et al., Circulation 2007; 116:894–900
6 Lottmann K et al., Curr Rheumatol Rep 2012; 14:195–203
7 Fang Y et al., JAMA 2000; 283.18:2404–2410
8 Stack AG et al., QJM 2013; 106(7):647–58
9 Fuldeore MJ et al., BMC Nephrol 2011, 12:36
10 Obermayr RP, J Am Soc Nephrol. 2008 Dec; 19(12):2407–13
11 BMJ 2012; 345:e5287
12 Kramer HJ, Kidney International 64 (2003), 1022–1026
13 Liebman SE et al., Curr Rheumatol Rep. 2007; 9(3):251–257
14 Marchini GS et al., The Journal of Urology 2013 189:1334–1339
15 Steinberg PL et al., Qual Manag Health Care 2011 Jan–Mar; 20(1):30–6
16 Khanna D et al., Arthritis Care & Research 2012; 10:1431–1446
17 Ryu ES et al., Am. J. Physiol. 2013 Mar 1; 304(5):F471–80
18 Perez-Ruiz F, Rheumatology 48 Suppl 2, 2009:ii9-–i14
19 Zhang W et al. Annals of the Rheumatic Diseases 2006; 65(10):1312–1324