Warum bevorzugen wir Metformin, SGLT2-Hemmer und GLP-1-Agonisten?
Die Herangehensweise an die Auswahl der Substanzen zur Therapie des Typ-2-Diabetes hat sich in den vergangenen Jahren in allen Leitlinien stark geändert. Davor waren alle medikamentösen Therapieoptionen nach Erstlinientherapie mit Metformin annähernd gleichgestellt. Die hervorragenden Outcome-Daten in kardiovaskulären Endpunktstudien mit SGLT2-Hemmern und GLP-1-Agonisten haben dazu geführt, dass diese beiden Substanzen (abhängig von den Komorbiditäten) teils sogar als Erstlinientherapie vor Metformin empfohlen werden.
Metformin
Metformin ist ein ausgezeichneter Blutzuckersenker, der HbA1c um ca. 1,5 % (!) und die Nüchtern-Blutglukose um 30–40 mg/dl reduziert – ein Effekt, der von vielen anderen oralen Antidiabetika bei weitem nicht erreicht wird. Metformin hemmt die Glukoneogenese und senkt auf diese Weise die endogene Glukoseproduktion. Die hepatische und (in geringerem Maße) die periphere Insulinsensitivität werden verbessert, was wiederum zu einem geringeren Insulinbedarf führt. Wenn auch nicht als Adipositas-Medikament zugelassen, ist eine Metformintherapie in vielen Fällen mit einer langfristigen Gewichtsreduktion assoziiert, die u. a. durch eine gewisse appetithemmende Wirkung ausgelöst wird. In den letzten Jahren wird eine Änderung des Mikrobioms im Darm durch Metformin als Ursache der vielen Benefits diskutiert.
Senkt Metformin kardiovaskuläre Ereignisse? In der UK Prospective Diabetes Study (UKPDS) wurde in erster Linie der Effekt der Blutzucker- bzw. HbA1c-Senkung auf kardiovaskuläre Endpunkte untersucht. Ein substanzspezifischer Vorteil zeigte sich nur in der Subgruppe der metforminbehandelten Pa-tient:innen: Myokardinfarkte sowie diabetesassoziierte Mortalität und Gesamtmortalität wurden signifikant gesenkt. In Summe wurden die positiven Effekte von Metformin auf kardiovaskuläre Endpunkte in vielen Studien, Subgruppenanalysen und Metaanalysen bestätigt.
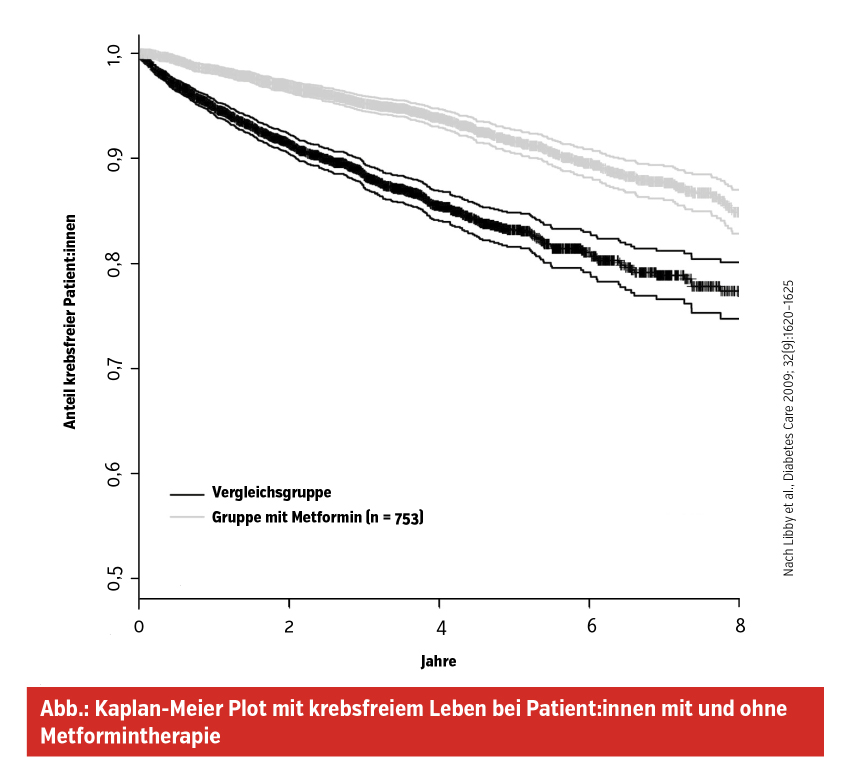
Metformin hat auch positive Effekte im onkologischen Bereich. So konnte in einer großen schottischen Kohortenstudie gezeigt werden, dass bei metforminbehandelten Patient:innen die Krebsinzidenz um 37 % gesenkt ist (Abb.) und auch die Krebsmortalität deutlich reduziert ist.
Dieser Effekt dürfte dosisabhängig sein. Bei niedrigen Dosierungen konnte keine statistische Signifikanz erreicht werden, während bei mittleren und höheren Dosierungen die Krebsinzidenz dosisabhängig sank. Die Reduktion der Insulinresistenz könnte in der Karzinogenese pathogenetisch bedeutsam sein. Studien, in denen Remissionsraten nach Chemotherapie bei Mammakarzinom unter Metformintherapie deutlich höher sind, werfen die Frage auf, ob auch zelluläre Effekte eine Rolle spielen.
SGLT2-Hemmer
2015 konnte mit dem SGLT2-Hemmer Empagliflozin erstmals für eine antidiabetische Substanz eine Senkung des kombinierten Endpunktes aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall gezeigt werden. Das Risiko für kardiovaskulären Tod konnte um 38 % gesenkt werden, trotz einer relativ kurzen Studiendauer von weniger als 4 Jahren. 2017 und 2018 folgten für Canagliflozin und Dapagliflozin vergleichbare Daten. Die Studien zeigten zudem eine signifikante Reduktion der Spitalsaufnahmen aufgrund von Herzinsuffizienz – eine neue Klasse an Herzinsuffizienzmedikamenten war geboren. Beginnend mit Dapagliflozin wurde 2019 die erste große Herzinsuffizienz-Studie mit einem SGLT2-Hemmer präsentiert. Es zeigte sich eine 26%ige Risikoreduktion für den primären Endpunkt (kardiovaskulärer Tod, Hospitalisierung für Herzinsuffizienz, akute Verschlechterung der Herzinsuffizienz), die NNT lag bei 21. Auffallend war, dass dieser positive Effekt bei Menschen sowohl mit als auch ohne Diabetes auftrat und unabhängig vom HbA1c war. Die Daten konnten 2020 für Empagliflozin bestätigt werden. Ganz aktuell konnten sowohl für Empagliflozin als auch für Dapagliflozin positive Effekte bei Herzinsuffizienz mit erhaltener Linksventrikelfunktion (HFpEF) gezeigt werden, womit nun erstmals eine effektive Therapieoption in dieser Indikation zur Verfügung steht.
Neben dem Herz rückte bald auch die Niere in den Fokus der Studien. In den Diabetes-Outcome-Studien zeigte sich, dass die eGFR nach Beginn einer SGLT2-Hemmertherapie zwar leicht absinkt, dann aber über Jahre erhalten bleibt. Dies führte wiederum zu niedrigeren Raten von Nierenersatztherapie und renalem Tod. In großen Folgestudien zeigte sich sowohl für Canagliflozin als auch für Dapagliflozin und Empagliflozin eine deutliche Reduktion renaler Endpunkte. Auch hier war der Effekt unabhängig vom HbA1c und dem Vorliegen eines Diabetes mellitus. In den internationalen, aber auch den neuen österreichischen Leitlinien zur Diabetestherapie stehen die SGLT2-Hemmer daher im Vordergrund, wenn eine Nierenerkrankung oder eine Herzinsuffizienz, eine kardiovaskuläre Erkrankung oder ein hohes Risiko für diese Erkrankungen vorliegen.
Was die Nebenwirkungen der SGLT2-Inhibitoren betrifft, sollte neben der Neigung zu Urogenitalinfektionen, die sich aus der Glukosurie ergeben und gut behandelbar sind, auch die seltene, aber klinisch relevante euglykämische Ketoazidose erwähnt werden. Fast immer entsteht diese durch einen (relativen) Insulinmangel bei gleichzeitig durch die Glukosurie maskierter (und daher nur milder) Hyperglykämie, oft getriggert durch einen fieberhaften Infekt, eingeschränkte Nahrungs- oder Flüssigkeitszufuhr oder Diarrhö. Eine entsprechende Aufklärung der Patient:innen und Pausierung der Medikation während solcher Episoden sind für die Vermeidung der Ketoazidose wesentlich.
GLP-1-Agonisten
GLP-1-Agonisten wirken unter anderem über eine glukoseabhängige Steigerung der pankreatischen Insulinsekretion, was wiederum eine Blutzuckersenkung ohne gesteigerte Hypoglykämieneigung bewirkt. Zusätzlich wird die Glukagonsekretion gehemmt, die Magenentleerung verlangsamt und das Sättigungszentrum im Gehirn stimuliert. Dies bewirkt bei manchen Patient:innen eine deutliche Gewichtsreduktion. Die gastrointestinalen Nebenwirkungen führen nur selten zu einem Therapieabbruch.
Auch für diese Substanzgruppe liegen inzwischen kardiovaskuläre Endpunktstudien vor: Für Liraglutid konnte 2016 eine Reduktion des kombinierten primären Endpunktes (CV-Tod, Myokardinfarkt, Schlaganfall) gezeigt werden. In den Jahren danach folgten ähnlich positive Daten für Semaglutid und Dulaglutid. Im Vergleich zu den SGLT2-Hemmern dürften die genannten GLP-1-Agonisten vor allem atherosklerotische Ereignisse senken. Die genauen Mechanismen sind noch nicht völlig klar, Reduktion von endothelialer Inflammation, Wirkungen auf die Plättchenaggregation und auf die Produktion von Zytokin im Fettgewebe dürften aber eine Rolle spielen.
Besonders erwähnenswert – auch weil im österreichischen Kassenstatus immer noch problematisch – sind die positiven synergistischen Effekte bei einer Kombination aus GLP-1-Agonisten und SGLT2-Hemmern (und Metformin). Sowohl was die Blutzuckersenkung betrifft als auch Gewichtsabnahme und Reduktion von kardiovaskulären und renalen Ereignissen sprechen für eine solche Kombination, wodurch diese in sämtlichen Leitlinien befürwortet wird.
Und die anderen?
DPP-4-Hemmer bewirken eine gewisse HbA1c-Senkung ohne Hypoglykämieneigung, sind allerdings in klinischen Outcome-Studien im Wesentlichen neutral. Pioglitazon senkt zwar kardiovaskuläre Ereignisse, wird allerdings aufgrund der Nebenwirkungen nur noch selten eingesetzt. Sulfonylharnstoffe und Glinide sind aufgrund der Hypoglykämieneigung ohnehin kaum mehr in Verwendung. Insulin dient weiterhin der Therapieerweiterung, wenn die empfohlenen Antidiabetika das HbA1c nicht ausreichend senken.