Brexit als Gefahr für Versorgung
Langsam wird es eng mit den Verhandlungen zum EU-Austritt von Großbritannien. Auf der Insel mehren sich die Forderungen nach einem harten Brexit – ohne Verhandlungserfolg mit der EU. Doch so ein No-Deal-Szenario könnte auch massive Auswirkungen für die Arzneimittelversorgung innerhalb der EU haben – und damit auch in Österreich. „Der Austritt Großbritanniens aus der Europäischen Union gefährdet die Sicherheit der Arzneimittelversorgung auf beiden Seiten“, warnt etwa der Bundesverband der Arzneimittel-Hersteller (BAH). Und auch aus Österreich kommen warnende Stimmen aus der Industrie.
Der Hintergrund: Hunderte Arzneimittel, die in Österreich verschrieben und verkauft werden, sind in Großbritannien zugelassen – stellvertretend für die gesamte EU. Mit dem Brexit können die Hersteller die britische Zulassung dann nicht mehr nutzen, um ihre Medikamente in der übrigen EU zu verkaufen. „Die beiden Zulassungsbehörden MHRA (Medicines and Healthcare Products Regulatory Agency) und VMD (Veterinary Medicines Directorate) stehen aus derzeitiger Sicht danach voraussichtlich nicht mehr für die Verfahrensführung in EU-Zulassungs- und Lifecycle-Verfahren zur Verfügung“, teilt der Branchenverband Pharmig auf Anfrage der Apotheker Krone mit. Auch die Zertifikate des britischen Arzneimittelkontrolllabors NIBSC, das für die Chargenprüfung von Plasmaprodukten und Impfstoffen und die Testung von Plasmapools zuständig ist, werden nach dem Brexit aus derzeitiger Sicht nicht mehr gültig sein, sodass eine gegenseitige Anerkennung von Chargenfreigaben nicht mehr möglich sein wird. Aktuell sind in Österreich noch über 600 Human- und über 300 Veterinärarzneispezialitäten zugelassen, bei denen Großbritannien als Referenzstaat fungiert.
Ein Rückzug Großbritanniens vom europäischen Binnenmarkt ohne entsprechende Regelung hätte somit für Arzneimittelhersteller negative ökonomische Konsequenzen: Im einfacheren Fall durch Handelsverzögerungen, im Extremfall durch Exportausfälle. Das würde dann auch Apotheken und den Großhandel betreffen. Britische Unternehmen müssen sich damit auch auf Folgen in weiteren „europäisierten“ Bereichen einstellen. Dies betrifft neben der Arzneimittelzulassung auch die klinische Prüfung und die Arzneimittelsicherheit, darüber hinaus die Forschungsförderung und die europäische Kooperation bei der Nutzenbewertung von Arzneimitteln, das sogenannte European Network for Health Technology Assessment.
„Um die Versorgung der Patienten mit Arzneimitteln, bewährte wie innovative, auf beiden Seiten der zukünftigen Grenze sicherzustellen, ist es essenziell, dass die Politik für angemessene Rahmenbedingungen sorgt“, warnt Mag. Alexander Herzog, Generalsekretär der Pharmig im Gespräch mit der Apotheker Krone. Er fordert rasche Verhandlungen und entsprechende Lösungen. „Der Zugang zu allen verfügbaren Arzneimitteln muss auch für die Zeit nach dem Brexit gewährleistet bleiben – für die Patienten in der EU und jene in Großbritannien.“
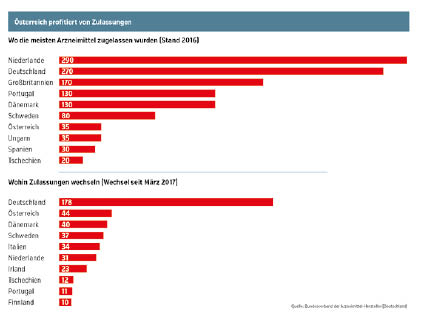
Schon jetzt hat für die betroffenen Unternehmen – und das sind praktisch alle großen internationalen Pharmakonzerne und viele kleinere Firmen – ein Rennen gegen die Zeit begonnen, denn sie müssen ihre britischen Zulassungen auf den Kontinent ziehen. Davon profitiert übrigens auch schon Österreich. Bis zum Frühjahr wechselten bereits 44 Medikamente mit der Zulassung nach Österreich. Im EU-Vergleich konnte nur Deutschland noch stärker profitieren. Bei der Chargenfreigabe verfügt das Bundesamt für Sicherheit im Gesundheitswesen über langjährige Erfahrung und würde bei Bedarf auch diese Chargenprüfungen übernehmen können, heißt es aus der Pharmaindustrie. Allerdings seien hier nicht alle Produktarten und Testmethoden im Routinebetrieb etabliert, sodass hier eine längere Vorlaufzeit von sechs bis neun Monaten für den Transfer nötig sein wird. Termin für den EU-Austritt ist Ende März 2019. Die Zeit drängt also.