EUDAMED: Aktueller Stand und Ausblick
EUDAMED ist eine zentrale digitale Datenbank, die von der Europäischen Kommission programmiert und betrieben wird und aus sechs Modulen besteht:
- Modul 1: Registrierung der Wirtschaftsakteure
- Modul 2: Registrierung von Produkten
- Modul 3: Benannte Stellen und Bescheinigungen
- Modul 4: Klinische Prüfungen und Leistungsstudien
- Modul 5: Vigilanz und Überwachung nach dem Inverkehrbringen
- Modul 6: Marktüberwachung
Ziel ist es, die Transparenz, Rückverfolgbarkeit und Marktüberwachung von Medizinprodukten im europäischen Markt zu verbessern sowie den Informationsaustausch zwischen nationalen Behörden, Benannten Stellen und Wirtschaftsakteuren zu vereinfachen. In Bezug auf EUDAMED umfassen Wirtschaftsakteure Hersteller, Hersteller von Systemen und Behandlungseinheiten, Bevollmächtigte und Importeure. Händler von Medizinprodukten und Hersteller von Sonderanfertigungen sind auch Wirtschaftsakteure, die jedoch in EUDAMED nicht registrierungspflichtig sind.
Die Europäische Kommission hat das erste Modul zur Registrierung von Wirtschaftsakteuren am 1. Dezember 2020 und die beiden weiteren Module 2 und 3 am 30. September 2021 freigeschaltet. Alle drei Module können seither von den Wirtschaftsakteuren auf freiwilliger Basis genutzt werden. Eine Ausnahme bilden die Funktionalitäten zu den Scrutiny-Verfahren sowie Konsultationsverfahren zum Clinical Evaluation Consultation Procedure (CECP) bei Modul 3, die noch nicht umgesetzt wurden. Die Module 4 bis 6 sind derzeit noch nicht in Betrieb und stehen als „Playground“ zum Testen zur Verfügung.
Mit Datenstand September 2025 haben sich auf der öffentlichen EUDAMED-Website über 28.400 Hersteller, 1.340 Hersteller von Systemen und Behandlungseinheiten, 9.160 Importeure sowie mehr als 2.600 Bevollmächtigte eingetragen (Modul 1). Diese Akteure haben über 858.000 Produkte, Systeme und Behandlungseinheiten registriert, die am EU-Markt verfügbar sind (Modul 2). In Modul 3 sind Informationen zu mehr als 1.500 Zertifikaten (mit unterschiedlichem Status) publiziert. Diese Daten sind öffentlich zugänglich: https://ec.europa.eu/tools/eudamed/#/screen/home.
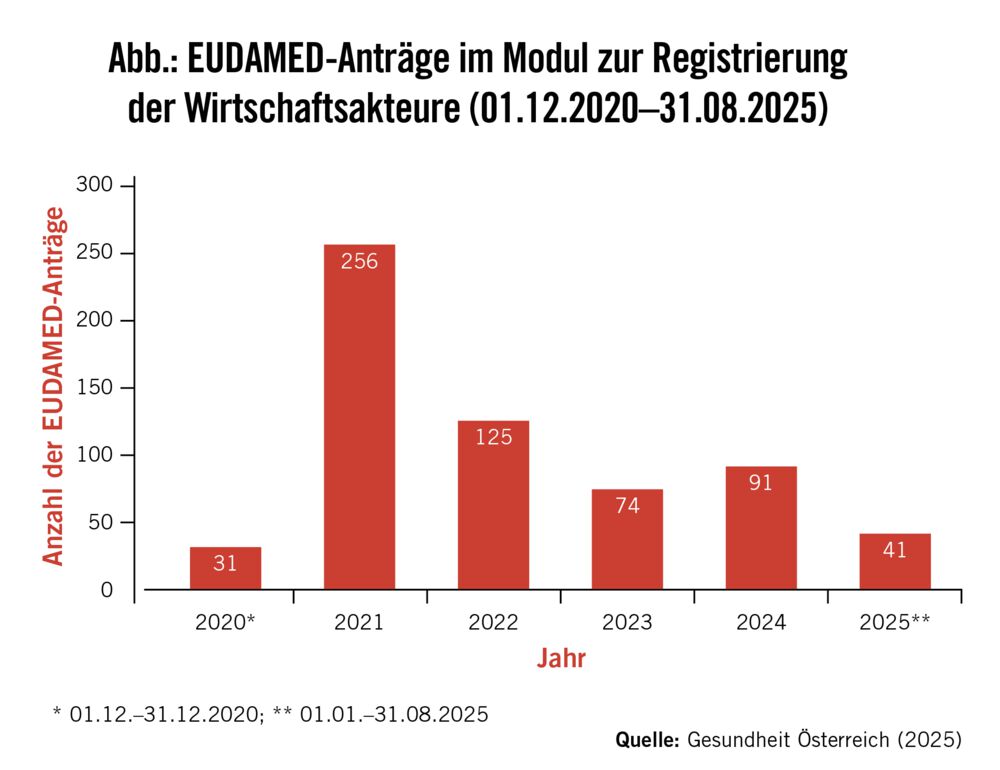
Insgesamt 618 Anträge wurden im Zeitraum von Anfang Dezember 2020 bis Ende August 2025 von österreichischen Akteuren im EUDAMED-Modul zur Registrierung der Wirtschaftsakteure gestellt und von der Gesundheit Österreich GmbH (GÖG) als zuständiger Stelle bearbeitet – die meisten davon im Jahr 2021 (Abb.). Davon wurden 486 Anträge (ca. 79 %) freigegeben und 70 Anträge abgelehnt (ca. 14 %). Die übrigen Anträge benötigten eine Überarbeitung durch die Akteure, die aktuell erfolgt. Die häufigsten Gründe für eine Ablehnung sind Anträge in der falschen Rolle, keine bestehende Registrierungspflicht (z. B. als Händler von Medizinprodukten oder Hersteller von Sonderanfertigungen) und Duplikate (zwei Anträge in der gleichen Rolle). Gelegentlich werden Anträge auch von den Wirtschaftsakteuren selbst wieder zurückgezogen.
Sobald ein Antrag von der GÖG validiert und freigegeben wurde, wird durch EUDAMED automatisch eine Single Registration Number (SRN) an die Wirtschaftsakteure übermittelt. Die SRN ermöglicht eine eindeutige Identifizierung jedes Wirtschaftsakteurs (in seinen unterschied-lichen Rollen) und ist Voraussetzung für sämtliche weitere Aktivitäten in den weiteren EUDAMED-Modulen.
Mit der Verordnung (EU) 2024/1860 hat die Europäische Union den Kurs für EUDAMED neu gesetzt. Statt auf die Fertigstellung aller Module zu warten, erfolgt die Einführung nun schrittweise. Vier Module (Modul 1, 2, 3 und 6) wurden bereits einem unabhängigen externen Audit mit einer Sicherheitsprüfung und einem Leistungstest unterzogen, das positiv abgeschlossen werden konnte. In einem nächsten Schritt ist die Publikation im Amtsblatt der Europäischen Union (Official Journal of the European Union [OJEU]) vorgesehen (voraussichtlich im November 2025). Ab diesem Zeitpunkt starten auch die verbindlichen Übergangsfristen für die verpflichtende Nutzung der Module durch Hersteller, Hersteller von Systemen und Behandlungseinheiten, Bevollmächtigte und Importeure. Das Audit von Modul 5 (Vigilanz) soll im ersten Quartal 2026 durchgeführt werden. Die Entwicklung von Modul 4 (Klinische Prüfungen und Leistungsstudien) wurde von der Europäischen Kommission verschoben und wird zu einem späteren Zeitpunkt finalisiert und veröffentlicht werden.
Die verpflichtende Nutzung der ersten EUDAMED-Module – voraussichtlich im zweiten Quartal 2026 – markiert einen wichtigen Meilenstein für die europäische Medizinproduktebranche. Allen österreichischen Wirtschaftsakteuren, die noch nicht in EUDAMED registriert sind, wird empfohlen, die Registrierung zeitnah vorzunehmen und nicht bis zum zweiten Quartal 2026 zu warten. Die Eintragung ist im Modul zur Registrierung von Wirtschaftsakteuren unter folgendem Link möglich: https://webgate.ec.europa.eu/eudamed/landing-page.
Durch die zentrale europäische Datenerfassung trägt EUDAMED wesentlich zur Erhöhung der Transparenz und zur Verbesserung der Nachverfolgbarkeit bei. Der Verwaltungsaufwand wird für Wirtschaftsakteure erheblich reduziert, weil die einmalige Registrierung die Identifikation und Kommunikation innerhalb der Europäischen Union erleichtert und auch weitere Daten über diese Datenbank administriert werden können.