Kongressbericht – 47. Jahrestagung der European Association for the Study of Diabetes
Auf dem weitläufigen Kongressgelände konnten sich 17.462 Teilnehmer aus 127 Ländern einen Überblick über die aktuellen Möglichkeiten und Herausforderungen in der Diabetologie verschaffen. Aus der Vielzahl der Kongressbeiträge wird nachfolgend eine subjektive Auswahl aus Bereichen vorgestellt, die auch im DIABETES FORUM immer wieder thematisiert werden.
Die vielen Gesichter der Nephropathie
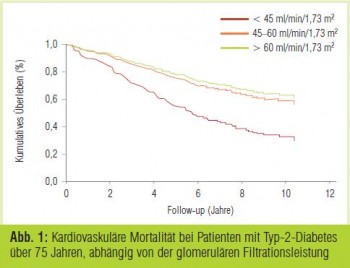
ZODIAC-24, RIACE: Wie vielschichtig sich die diabetische Nephropathie darstellen kann, illustrieren diese beiden Studien. ZODIAC-24 (Drion et al., EASD 2011; Abstr 37) verfolgte 1.022 Patienten mit Typ-2-Diabetes, die in niederländischen Allgemeinpraxen betreut wurden, prospektiv über median 10 Jahre. Im Vergleich zu Teilnehmern mit normaler Nierenfunktion (glomeruläre Filtrationsrate [GFR] > 60 ml/min/1,73 m2) wurde in der Altersgruppe 60– 75 Jahre bei moderat reduzierter GFR (45–60 ml/min/1,73 m2) eine erhöhte kardiovaskuläre Mortalität registriert (Hazard Ratio [HR] = 3,1 bis 6,2, je nach Formel, die der GFR-Berechnung zugrunde gelegt wurde). Bei Patienten ab 75 Jahren war die Mortalität erst bei GFR-Werten < 45 ml/min/1,73 m2 signifikant erhöht (Abb. 1). Im Gegensatz dazu korrelierte Albuminurie in beiden Altersgruppen unabhängig vom GFR-Niveau stark mit der kardiovaskulären und der totalen Mortalität. Die Autoren werten dies als Bestätigung früherer Ergebnisse (u. a. aus UKPDS, NEFRON und ADVANCE), die nahelegen, dass Albuminurie und GFR-Abfall komplementäre Manifestationen mit unterschiedlicher Ätiologie und Prognose darstellen.
Zu einem ähnlichen Ergebnis kamen Pugliese et al. (EASD 2011; Abstr 38) in einer Analyse der italienischen RIACE-Kohorte (n = 15.773), in der 57 % der Typ-2-Diabetiker mit chronischer Nierenschädigung (definiert GFR < 60 ml/min/1,73 m2) normoalbuminurisch waren. Im Vergleich zu Patienten mit normaler GFR (mit oder ohne Albuminurie) war dieser Phänotyp stärker mit kardiovaskulären Ereignissen assoziiert (Odds Ratio [OR] = 1,52 vs. 1,20), allerdings nicht in dem Ausmaß wie das kombinierte Auftreten von reduzierter Filtrationsleistung und Albuminurie (OR = 1,90). Interessanterweise war die nichtalbuminurische Nieren – erkrankung stärker mit koronaren Ereignissen assoziiert, während bei Patienten mit Albuminurie, aber normaler GFR vermehrt zerebrale und periphere Gefäßkomplikationen auftraten.
Renale Outcomes großer Interventionsstudien
ADVANCE, ACCORD: Zur EASD-Jahrestagung wurden weiters zusätzliche Analysen großer Outcome-Studien der letzten Jahre präsentiert. Von der ADVANCE-Studie, die in der Erstauswertung eine signifikante Reduktion renaler Endpunkte (Neuauftreten oder Verschlechterung der Nephropathie: – 21%; neu aufgetretene Albuminurie: –9 %) durch intensivierte Blutzuckerkontrolle ergeben hatte (ADVANCE Collaborative Group, New Engl J Med 2008), wurde eine massive Reduktion der terminalen Nieren – erkrankung (ESKD; HR = 0,35; 0,15–0,83) berichtet. Andere späte Endpunkte (ESKD oder Tod, Verdoppelung bzw. anhaltende Erhöhung des Kreatinins) waren in der intensiviert behandelten Gruppe lediglich tendenziell erniedrigt (Zoungas et al., EASD 2011; Abstr 39).
In der ACCORD-Studie, in der die intensivierte Therapie auf mikrovaskulärer Seite das Neuauftreten von Mikround Makroalbuminurie signifikant um 21 % bzw. 32 % reduzierte (Ismail-Beigi et al., Lancet 2010), ergab die Auswertung des Blutdruckarms mit 4.733 Patienten, dass die intensivierte Blutdruckintervention über die Glukose – kontrolle hinaus keinen Benefit hat (O’Connor et al., EASD 2011; Abstr 40). Auch in dieser Auswertung kommen die ACCORD-Autoren zum Schluss, dass die beobachteten mikrovaskulären Effekte im Kontext der makrovaskulären Risiken gesehen werden müssen.
FIELD: Im Kontext der Beobachtung, dass die Therapie mit Fenofibrat einen reversiblen Anstieg des Serumkreatinins verursacht, steht die von R. Ting (Sydney, Australien) vorgestellte Auswertung der FIELD-Studie, die auf die Evaluation der kardiovaskulären Konsequenzen bei Personen mit mäßiggradiger Nierenschädigung fokusierte. Dabei erweisen sich sowohl erniedrigte GFR als auch Albuminurie als starke und voneinander unabhängige Prädiktoren für kardiovaskuläre Ereignisse. Fenofibrat verlangsamte die GFR-Abnahme, und der kardiovaskuläre Benefit wurde durch den Kreatininanstieg nicht kompromittiert. Im GFRBereich zwischen 30 und 60 ml/min/1,73 m2 wurden auch keine negativen Therapieeffekte auf die Niere beobachtet (Ting et al., EASD 2011; Abstr 41).
GLP-1-Agonisten im Head-to-Head-Vergleich
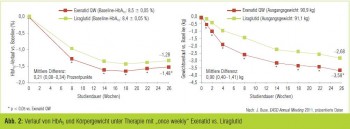
Auch wenn die wichtigsten Resultate von DURATION-6 schon im Frühjahr 2011 öfffentlich gemacht wurden, so war die erstmalige Präsentation der Studie vor internationalem Fachpublikum durch J. Buse (Chapel Hill, USA) mit einiger Spannung erwartet worden. Dieser erste Head-to-Head- Vergleich von Exenatid in retardierter, einmal wöchentlich zu verabreichender Form und Liraglutid inkludierte 911 Patienten mit Typ-2-Diabetes (mittlere Diabetesdauer: 9 Jahre; Body Mass Index [BMI]: 32 kg/m2; Baseline-HbA1c: 7,1–11 %), die randomisiert mit Exenatid (2 mg QW) vs. Liraglutid (1,8 mg QD) zusätzlich zu oralen Antidiabetika (überwiegend Metformin ± Sulfonylharnstoffe) behandelt wurden.
Im Follow-up von 26 Wochen sank das HbA1c um durchschnittlich 1,28 (Exenatid) bzw. 1,48 (Liraglutid) Prozentpunkte. Damit verfehlte Exenatid das primäre Studienziel der Überlegenheit oder zumindest Noninferioritität hinsichtlich der erzielten HbA1c-Reduktion knapp, aber signifikant. Auch waren der Anteil der Patienten, die ein HbA1c < 7 % erreichten (60 % vs. 52 %) und die mittleren Gewichts – abnahme (–2,7 kg vs. – 3,6 kg) unter Exenatid signifikant niedriger als unter Liraglutid (Abb. 2). Auf der anderen Seite traten in der mit Exenatid behandelten Gruppe nur halb so viele gastrointestinale Nebenwirkungen auf wie in der Vergleichsgruppe und auch Therapieabbrüche aufgrund von Nebenwirkungen waren seltener (2,6 % vs. 5,3 %). Hautirritationen an der Injektionsstelle waren, bedingt durch das Trägersystem, bei Exenatid jedoch häufiger (1 % vs. 10 %) als bei Liraglutid. Die Hypoglykämieraten lagen in beiden Gruppen auf dem für die Therapieklasse typischen niedrigen Niveau (Buse et al., EASD 2011; Abstr 75).
Diabetes und Krebs – EASD-Update 2011
Die Bewertung der Malignomrisiken im Zusammenhang mit Diabetes mellitus und verschiedenenen antidiabetischen Therapien, war auch in Lissabon Thema mehrerer Kongressbeiträge.
Diabetes und Pankreaskrebs – eine verkehrte Ursache-Wirkung- Beziehung? Karzinome des Pankreas sind mit einer Inzidenz von 8–12 Fällen pro 100.000 Personen und Jahr eine der weniger häufigen Krebsformen, sind aber mit einer sehr ungünstigen Prognose assoziiert. Das Fünfjahresüberleben liegt aktuell bei 5–10 %, in den USA ist Pankreaskrebs die vierthäufigste Ursache für Krebstod. Als wichtigste Determinanten gelten chronsiche Pankreatitis, Rauchen, Adipositas sowie Typ-2-Diabetes.
E. Gale (Bristol, Großbritannien), Leiter der „Diabetes and Cancer Research Task Force“ der EASD, ging im Rahmen einer „Diabetes and cancer related mechanisms“-Session auf weniger beachtete Zusammenhänge zwischen Pankreaskrebs und Diabetes ein. Nachdem zum Zeitpunkt der Krebsdiagnose bei ca. 80 % der Betroffenen eine Glukosetoleranzstörung vorliegt, gingt man lange davon aus, dass der Diabetes eine Folge der Inselzelldestruktion durch den Tumor sei. Allerdings betreffen 75 % der Karzinome den Pankreaskopf, während die insulinproduzierenden Bereiche großteils in der Cauda lokalisiert sind; zudem spricht dagegen, dass sich die Stoffwechsellage nach Tumorresektion meist normalisiert. Experimentelle Studien geben Hinweise darauf, dass Pankreas krebs über die Insulinresistenz Diabetes auslösen könnte (Wang et al., Mol Cancer 2003). Dies hätte nicht zuletzt Auswirkungen auf die Interpretation epidemiologischen Studien, aus denen ein erhöhtes Krebsrisiko verschiedener antidiabetischer Therapien abgeleitetet wurde (siehe Kasten).
Für die therapeutische Praxis ergibt sich da rüber hinaus die Forderung, bei schlanken Personen mit neu manifestiertem Typ-2-Diabetes ohne entsprechende Familienanamnese und ebenso bei plötzlicher unerwarteter Gewichtsabnahme oder rascher, nicht erklärlicher Verschlechterung der Stoffwechselkontrolle an die Möglichkeit eines Pankreaskarzinoms zu denken.
Wie sicher sind GLP-1-basierte Therapien? Ein Kongress- Highlights war die „Pro & Contra“-Session zur Frage, ob GLP-1-basierte Therapien das Krebsrisiko erhöhen.
P. Butler (Los Angeles, USA), dessen Arbeitsgruppe aus Meldedaten für Arzneimittelnebenwirkungen für Exenatid und Sitagliptin ein mehrfach erhöhtes Risiko für Pankreatitis und Pankreaskrebs abgeleitet hatte (Elashoff et al., Gastroenterology 2011), gab einen Überblick über die Hintergründe der Analysen: Butler stellte eine Reihe von Studien vor, die zeigen, dass GLP-1-basierte Therapeutika bei Nagetieren proliferative Veränderungen in duktalen Zellen des Pankreaskopfes induzieren (Gier et al., Endocr Rev 2011) und dass humane duktale Zellen auf die entsprechenden proliferativen GLP-1-Signale reagieren können; auch werden GLP- 1-Rezeptoren in pankreatischen prämalignen Läsionen (PanIN) beim Menschen exprimiert (Butler et al., Diabetologia 2010).
Butler wies auch darauf hin, dass in der Elashoff-Publikation explizit darauf hingewiesen wurde, dass mit den Ergebnissen der Datenbankauswertung noch nicht der Nachweis erbracht wurde, dass GLP-1-basierte Therapien Pankreatitis oder Krebs des Pankreas und der Schilddrüse verursachen. Allerdings sei zu fordern, dass den Bedenken durch entsprechende Vorsicht bei der Therapiegestaltung und durch weitere Studien Rechnung getragen wird.
M. Nauck (Bad Lauterberg, Deutschland) führte dagegen an, dass die etablierte Entwicklungsdauer von Pankreaskarzinomen (ca. 12 Jahre von den initialen zellulären Veränderungen bis zur klonalen Expansion zum Primärtumor; Yachida et al., Nature 2010) den postulierten Zusammenhang wenig plausibel erschienen lässt. Die tierexperimentellen Ergebnisse zu Pankreatitis und Pankreaskrebs stehen aus verschiedenen Gründen (Verwendung sehr spezifischer Tiermodelle ohne Bestätigung der Ergebnisse in alternativen Modellen, der Konnex von Pankreatitis und Pankreaskrebs wurde experimentell nicht erbracht etc.) unter Vorbehalt. Dies gilt mehr noch für Karzinome der Schilddrüse, deren Biologie beim Menschen stark von jener der verwendeten Nagetiere abweicht. So machen medulläre C-Zell-Karzinome, für die als einzige Entität ein Zusammenhang mit GLP-1 theoretisch möglich erscheint, nur einen Bruchteil der humanen Schilddrüsenkarzinome aus. Nauck ging auch auf methodische Limitationen der Elashoff- Publikation ein (unter anderem wurden Confounders wie Adipositas, Anamnese oder Komedikation nicht berücksichtigt und Pioglitazon aus der Kontrollgruppe „because of high event rate“ exkludiert). Schließlich präsentierte Nauck eine Reanalyse der Nebenwirkungsmeldungen mit alternativen Kontrollmedikationen und -ereignissen, um zu illustrieren, wie Bias-Effekte durch die Verwendung einer per se ungeeigneten Datenbasis die Ergebnisse und die Interpretationen beeinflussen können.