SGLT2-Hemmer als Einzeldosis: akute Effekte auf Glykogenolyse, Leberfett und Co
|
Wolf P, Fellinger P, Pfleger L, Beiglböck H, Krumpolec P, Barbieri C, Gastaldelli A, Harreiter J, Metz M, Scherer T, Zeyda M, Baumgartner-Parzer S, Marculescu R, Trattnig S, Kautzky-Willer A, Krššák M, Krebs M, Gluconeogenesis, But Not Glycogenolysis, Contributes to the Increase in Endogenous Glucose Production by SGLT2 Inhibition. Diabetes Care 2021; 44(2): 541–548
|
Wirkweise von SGLT2-Inhibitoren: Die Blutzuckersenkung entsteht durch eine vermehrte Glukoseausscheidung über die Niere aufgrund der Hemmung des SGLT2-Rezeptors, was von einer Abnahme der Insulinsekretion, einer Gewichtsabnahme und einer Verbesserung der Insulinsensitivität begleitet wird. Weiters kommt es zu einer gesteigerten Oxidation von Fettsäuren und einer Reduktion des Fettgewebes wie auch des Leberfettgehalts nach längerfristiger Gabe.2 Interessanterweise kommt es mit Beginn der Therapie mit SGLT2-Hemmern zu einem Anstieg der endogenen Glukoseproduktion, was eigentlich der Blutzuckersenkung entgegenwirkt. Als Ursache hierfür wurden der ebenfalls beobachtete Anstieg von Glukagon sowie die Veränderung des Verhältnisses von Glukagon zu Insulin genannt.3, 4
Effekte auf Glykogenolyse und/oder Glukoneogenese
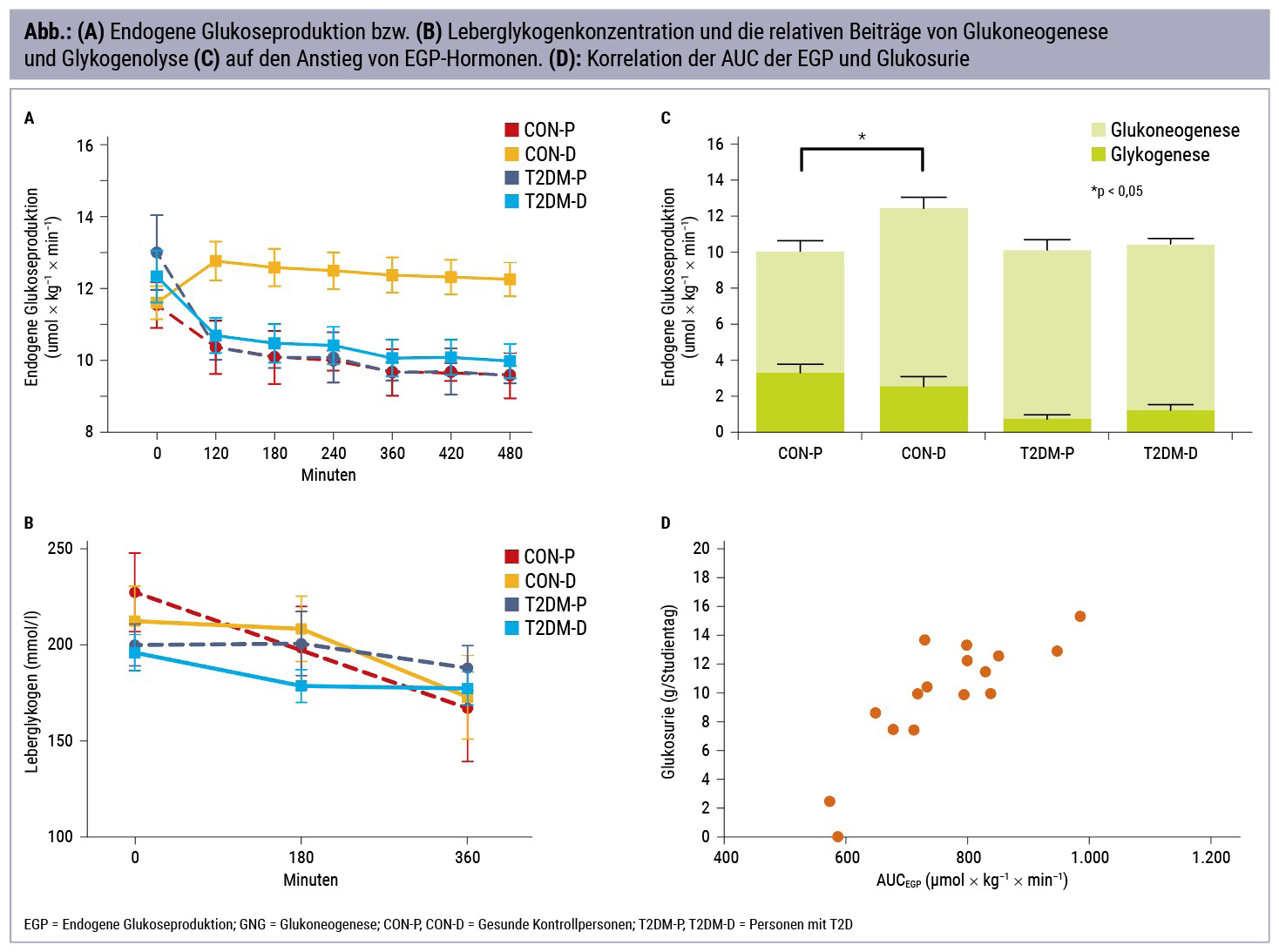
Die endogene Glukoseproduktion ist die Summe der Zuckerneubildung durch Glukoneogenese in der Leber und den Nieren und die Freisetzung von gespeichertem Zucker durch Glykogenolyse aus der Leber und dem Skelettmuskel. Glukagon wirkt akut vor allem über eine Steigerung der Glykogenolyse.
Im Rahmen dieser Studie haben wir den Effekt einer einmaligen Gabe eines SGLT2-Hemmers (Dapagliflozin) auf die Glykogenolyse und deren Anteil an der endogenen Glukoseproduktion untersucht. Weiters haben wir akute Veränderungen des Leberfettgehaltes und des Leberenergiestoffwechsels bei gesunden KontrollprobandInnen und PatientInnen mit Typ-2-Diabetes untersucht.
Bereits kurz nach einmaliger Gabe von Dapagliflozin kam es bei den ProbandInnen zu einem deutlichen Anstieg der endogenen Glukoseproduktion. Die Glykogenolyse war jedoch hiervon unbeeinflusst, was für eine deutliche Steigerung der Glukoneogenese spricht. Die endogene Glukoseproduktion korrelierte stark mit der renalen Zuckerausscheidung und scheint dieser entgegenzuwirken. Bei PatientInnen mit Typ-2-Diabetes fanden wir keine akuten Veränderungen, vermutlich aufgrund der nicht ausreichenden Dosis nach einmaliger Gabe.
Im Leberfettgehalt und Leberenergiestoffwechsel konnten wir keine akuten Veränderungen nach einmaliger Gabe von Dapagliflozin finden.
Diese Ergebnisse sprechen gegen Glukagon als Ursache für den Anstieg in der endogenen Glukoseproduktion, da dies auch die Glykogenolyse verstärken würde. Aufgrund des schnellen Anstiegs bereits innerhalb der ersten Stunde nach Einnahme von Dapagliflozin könnte ein Einfluss des sympathischen Nervensystems eine Rolle spielen, die systemischen Konzentration von Adrenalin und Noradrenalin war jedoch unverändert. Eine weitere Hypothese wäre ein durch die SGLT2-Hemmung oder Glukosurie verstärkter Mediator in der Niere, der lokal die Glukoseneubildung antreibt.
Da Dapagliflozin keinen akuten Einfluss auf den Leberfettgehalt und den Leberenergiestoffwechsel hatte, ist anzunehmen, dass die nach langfristiger Therapie beobachteten Veränderungen eher sekundär durch die Gewichtsabnahme und die verbesserte Insulinsensitivität bedingt sind als direkt durch die SGLT2 Hemmung.
- Buse JB et al., Diabetes Care 2020; 43(2): 487–93
- Kuchay MS et al., Diabetes Care 2018; 41(8): 1801–8
- Merovci A et al., J Clin Invest 2014; 124(2): 509–14
- Ferrannini E et al., J Clin Invest 2014;124(2):499–508
 Peter Wolf studierte Medizin an der Medizinischen Universität Wien und ist seit 2014 klinisch an der Abteilung für Endokrinologie und Stoffwechsel der Medizinischen Universität Wien tätig. Der Forschungsschwerpunkt seiner Arbeitsgruppe (Metabolic MR Imaging, Leitung: Michael Krebs, Martin Krššák) liegt in der Untersuchung akuter hormoneller oder pharmakologischer Effekte auf den Zucker-, Fett- und Energiestoffwechsel in unterschiedlichen Organen mittels Magnetresonanzspektroskopie in Kombination mit Tracerinfusionstechniken. Aktuell absolviert er ein Postdoc Fellowship an der Abteilung für Endokrinologie des Hôpital Bicêtre (Leitung: Philippe Chanson) in Frankreich.
|