Evidenzbasierte Therapieentscheidungen im Krankheitsverlauf – Teil 4: Lipide – aus Anlass der Aktualisierung der Europäischen Leitlinien zur Behandlung von Dyslipidämien1
Unser Patient ist ein 52-jähriger Mann. Von Beruf Angestellter eines öffentlichen Verkehrsbetriebes, er fährt dort unterschiedliche Linienbusse. Er lebt allein. Ein Typ-2-Diabetes wurde vor 16 Monaten zufällig anlässlich einer Operationsfreigabe für eine Herniotomie (inguinal) diagnostiziert.
Seit dem letzten Besuch hat er begonnen – zusätzlich zu Bewegung und mediterraner Ernährung – sein Gewicht durch Intervallfasten zu reduzieren. Er isst nun an 2 Tagen der Woche (Montag und Mittwoch) nichts. So hat er in 6 Monaten seinen BMI von 34,3 kg/m2 auf 30,5 kg/m2 reduziert. Sein aktuelles HbA1c beträgt 6,1 % unter der unveränderten Therapie mit Metformin 2-mal 1.000 mg. Die Triglyzeride haben sich weiter auf 138 mg/dl reduziert, das Gesamtcholesterin beträgt 179 mg/dl, das LDL-C ist mit 98 mg/dl quasi unverändert, und HDL-C beträgt 53 mg/dl. Nach wie vor besteht keine weitere Medikation, unser Patient ist nicht hypertensiv.
Im Folgenden sollen nun Aspekte der Lipidtherapie zur kardiovaskulären Risikoreduktion für unseren Patienten erörtert werden.
Diabetes und Atherosklerose
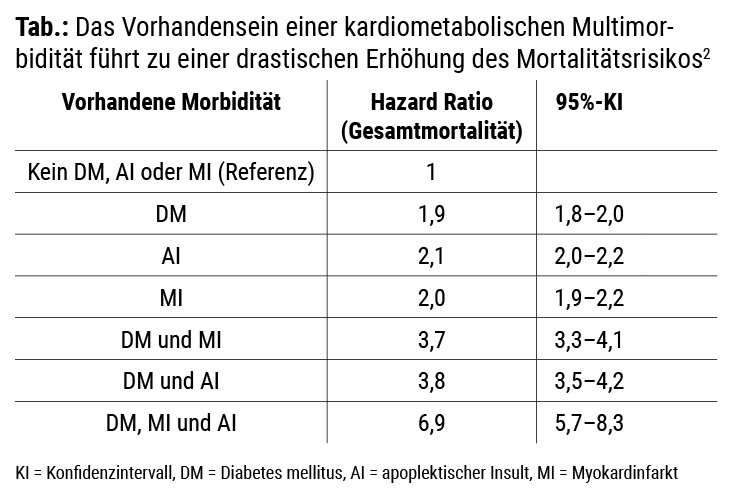
Hyperglykämie, Hypertonie, Hyper- bzw. Dyslipidämie stellen klare und starke Risikofaktoren für die beschleunigte Entwicklung der Atherosklerose dar. Damit ist die Diagnose „Diabetes mellitus“ im Besonderen mit einem hohen Risiko für deren kardiale, zerebrale, aber auch peripher-vaskuläre Manifestationen assoziiert. Konsequenterweise ist die Diagnose Diabetes mit einer deutlichen Steigerung der Mortalität vergesellschaftet, die in ihrem Ausmaß einem vorangegangenen Schlaganfall oder Herzinfarkt entspricht (Info-Box A).2
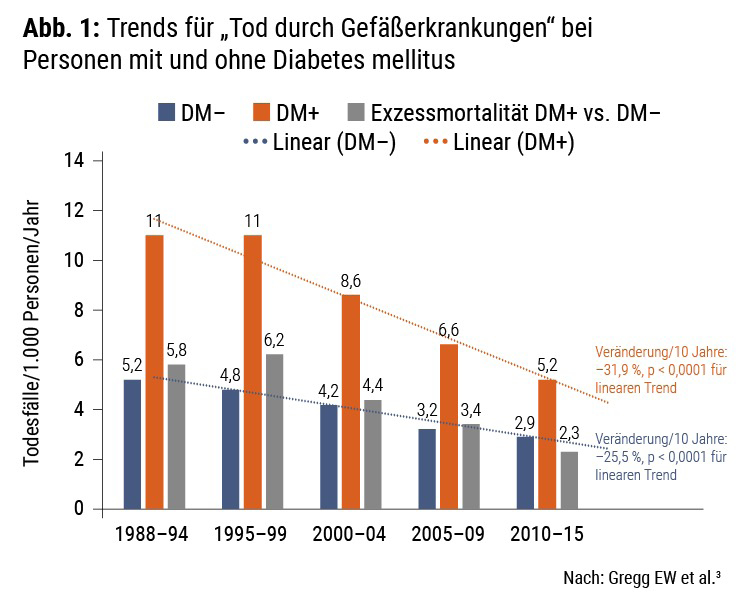
In unseren Vorstellungen über Diabetes und Atherosklerose scheint engrammiert, dass Menschen mit Diabetes überwiegend vaskulär erkranken und 6–7 von 10 Betroffenen auch an vaskulären Ursachen versterben. Neueste Analysen zeigen jedoch: Das ist nicht mehr der Fall. In einer großen US-amerikanischen Untersuchung fand sich, dass 34 % der Menschen mit Diabetes gegenüber 30 % jener Menschen ohne Diabetes an vaskulären Ursachen versterben. Nach wie vor trifft jedoch zu, dass die Todesrate im Vergleich zu Nichtdiabetikern gut doppelt so hoch ist (Info-Box B).3 Damit ist das kardiovaskuläre Risiko von Personen, die an Diabetes leiden, unabhängig von anderen Risikofaktoren jedenfalls mit „hoch“ bis „sehr hoch“ (s. u.) zu beurteilen.
Wie soll Atheroskleroseklinisch diagnostiziert werden?
Trotzdem ist auch für Menschen mit Diabetes ein formeller Nachweis einer manifesten Atherosklerose zur Differenzierung zwischen hohem und sehr hohem Risiko notwendig. Hier soll kurz auf einige diagnostische Grundsätze eingegangen werden. Klar ist natürlich, dass ein akutes Koronarsyndrom oder auch ein zerebrales Ereignis wie ein Schlaganfall oder eine TIA ebenso wie eine symptomatische PAVK die Diagnose der manifesten Atherosklerose evident machen. Die brandneuen Lipid-Leitlinien der Europäischen Kardiologischen Gesellschaft (ESC) und Europäischen Atherosklerose Gesellschaft (EAS) zählen aber auch mittels Ultraschall in den Karotiden oder mittels CT oder Angiografie in den Koronarien nachgewiesene signifikante Plaques dazu, da diese prädiktiv für das Auftreten klinischer Ereignisse sind, und klassifizieren die Betroffenen entsprechend in die Kategorie „sehr hohes Risiko“.1 Das Ausmaß der koronaren Verkalkung – der koronare Kalzium-Score (Agatston-Score) – zählt explizit nicht zu diesen Atherosklerose-Äquivalenten, sondern soll bei Personen mit mittlerem oder hohem Risiko als modifizierende Variable gesehen werden.
Kardiovaskuläre Risikoabschätzungbei Menschen mit Diabetes
Menschen mit Diabetes werden in den neuen Leitlinien der ESC/EAS in die Kategorie „hohes“ oder „sehr hohes“ Risiko eingeordnet, wenn folgende Kriterien erfüllt sind1:
Sehr hohes Risiko:
- Diabetes mit Endorganerkrankung (Mikroalbuminurie, Retinopathie, Neuropathie)
- Diabetes mit 3 weiteren kardiovaskulären Risikofaktoren (z. B. Hypertonie, Rauchen, hohes Lp[a], niedriges HDL-C)
- Typ-1-Diabetes mit frühem Beginn und mehr als 20 Jahren Diabetesdauer (z. B., wenn jünger als 30 Jahre)
Hohes Risiko:
- Diabetes ohne Endorganerkrankung
- Diabetes mit 1 weiteren kardiovaskulären Risikofaktor
- Diabetes mit mehr als 10 Jahren Diabetesdauer
Welche Zielwerte sollten wie erreicht werden?
Bei sehr hohem Risiko sollen eine Reduktion des Ausgangswertes um ≥ 50 % und ein Zielwert von < 55 mg/dl erreicht werden.
Bei hohem Risiko sollen eine Reduktion des Ausgangswertes um ≥ 50 % und ein Zielwert von < 70 mg/dl erreicht werden.
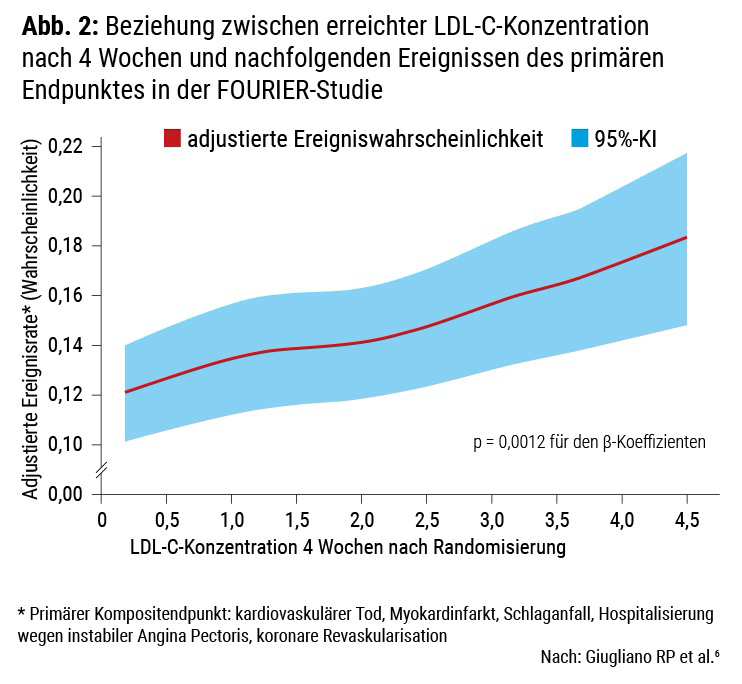
Damit haben die neuen Leitlinien zwei wichtige Änderungen erfahren. Einerseits werden sowohl Zielwert wie auch 50 % Senkung junktimiert und gemeinsam verlangt. Andererseits – und noch viel wichtiger – tragen die neuen Zielwerte der rezenten Studienevidenz Rechnung. Nicht zuletzt seit FOURIER4 und ODYSSEY OUTCOMES5 – den rezenten Outcomestudien mit den PCSK9-Hemmern Evolocumab bzw. Alirocumab – ist ja unbestreitbar klar, dass es offenbar kein zu tiefes LDL-C gibt und dass jede Reduktion auch in einen klinischen Benefit übersetzt wird. Dieses „the lower the better“ wird insbesondere durch das Studiendesign von FOURIER und die Resultate dieser Studie unterstützt (Info-Box C).4
Nach wie vor stellen Statine – die ja nun alle generisch verfügbar und entsprechend kostengünstig sind – das Rückgrat der lipidsenkenden Therapie dar. Bei Nichterreichen des Therapiezieles mit der maximal verfügbaren bzw. vertragenen Statindosis kommt zusätzlich Ezetimib (ebenfalls generisch) zum Einsatz. Die neue Klasse der PCSK9-Hemmer stellt on Top zu Statinen und Ezetimib eine wichtige Erweiterung des therapeutischen Spektrums dar. Sie bleibt allerdings speziellen Indikationen vorbehalten und bedarf zurzeit der Erstbewilligung durch spezialisierte Zentren.
Was tun bei unserem Patienten?
Unser Patient hat nun nach vernünftigem Ausschöpfen aller lebensstilmodifizierenden Maßnahmen ein LDL-C von 98 mg/dl. Er ist ein quasi „gesunder“ Typ-2-Diabetiker, der keine weiteren Risikofaktoren aufweist. Zur weiteren Risikoklassifikation ist nun der Ausschluss einer asymptomatischen PAVK mit Hilfe des Knöchel-Arm-Index sowie von Karotisplaques mittels Sonografie notwendig, um zwischen „hohem“ und „sehr hohem“ Risiko unterscheiden zu können. Beides erweist sich als unauffällig, und der Patient fällt in die Kategorie hohes Risiko. Damit hätte für ihn bis vor kurzem ein Zielwert von < 100 mg/dl gegolten, und eine weitere Senkung wäre nicht zwingend indiziert gewesen.
Nun gelten aber ein LDL-C von < 70 mg/dl und eine Reduktion von zumindest 50 % unter den Ausgangswert als Therapieziel. Das wäre also ein LDL-C ≤ 46 mg/dl. Eine solche Reduktion kann mit Atorvastatin 80 mg oder Rosuvastatin 40 mg erreicht werden. Er erhält 40 mg Rosuvastatin 1-mal tgl., nach 6 Wochen ist sein LDL-C auf 42 mg/dl gefallen. Damit sind beide Therapieziele erreicht.
Zusammenfassend legen die neuen Lipid-Leitlinien der ESC/EAS noch größeren Wert auf das Erreichen noch strikterer, aber trotzdem evidenzbasierter Zielwerte für das LDL-Cholesterin.
To be continued …