Tumornekrosefaktor-alpha-Inhibition
Tumornekrosefaktor (TNF) alpha
Tumornekrosefaktor (TNF) alpha, ein entzündungsfördernder Botenstoff, ist ganz wesentlich in die Pathogenese der rheumatoiden Arthritis (RA), Psoriasisarthritis (PsA) und ankylosierenden Spondylitis (AS), aber auch einer Reihe anderer chronisch entzündlicher Krankheiten (z. B. Psoriasis, M. Crohn, Colitis ulcerosa, sytemischer Lupus erythematosdes) pathogenetisch involviert. TNF wird von vielen Zelltypen produziert, etwa aktivierten Monozyten/ Makrophagen, T-Lymphozyten, dendritischen Zellen, Fibroblasten, und von bakteriellen Produkten (z. B. Lipopolysaccharid), Immunkomplexen, aber auch anderen Cytokinen, wie Interferon gamma oder Interleukin (IL) -1, induziert. Es kommt membranständig und in löslicher Form vor, wobei Letztere üblicherweise durch Enzymwirkung (TNF converting enzyme) aus dem Membran-TNF abgespalten wird. Löslicher wie membranständiger TNF aktivieren Zellen, die TNF-Rezeptoren tragen, zur Produktion von Cytokinen, wie IL-1 oder IL-6, aber auch gewebsdestruierenden Metalloproteasen oder Prostaglandinen, und induzieren auf diese Weise die gesamte Entzündungskaskade 1, 2. Neben dieser entzündungsfördernden Wirkung ist TNF aber auch ein wichtiger Verursacher des Knorpelabbaus durch Stimulation kataboler Effekte in Chondrozyten und der mit der Arthritis in Zusammenhang stehenden Knochendestruktion durch Aktivierung von Osteoklasten in der Synovialmembran3. TNF führt direkt oder im Wege über IL-1 und IL-6 zu einer Reihe klinischer Symptome, etwa Gelenkschwellung und Gelenkschmerzen, Fieber, Abgeschlagenheit, Gewichtsverlust, und zu mittels Laboruntersuchungen erfassbaren Zeichen der Entzündung, wie Erhöhung des C-reaktiven Proteins (CRP) oder der Blutsenkungsgeschwindigkeit bzw. chronischen Entzündungsanämie.
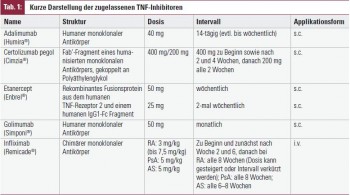
TNF-Inhibitoren: Diesen Charakteristika entsprechend ist TNF eine wichtige therapeutische Zielstruktur, deren Bedeutung im Allgemeinen erstmals von Cerami1 und für die RA von den britischen Forschern Maini und Feldmann4 erkannt wurde. Tatsächlich hat die Blockade des TNF die therapeutische Revolution in der Rheumatologie ausgelöst und das Zeitalter der Biologika eingeläutet. Bereits bei der ersten je durchgeführten randomisierten, kontrollierten klinischen Studie eines TNF-Blockers bei einer entzündlich rheumatischen Erkrankung, in der PatientInnen mit RA eine einzige Infusion von Infliximab appliziert und die – neben drei anderen europäischen Zentren – auch in Wien durchgeführt wurde, konnten die wesentlichen Qualitäten der TNF-Blockade wahrgenommen werden: Innerhalb von zwei bis drei Tagen kam es zu globaler Besserung des Patientenbefindens und fiel das CRP um fast zwei Drittel des Ausgangswertes, und innerhalb einer Woche war die Zahl der betroffenen Gelenke um mehr als die Hälfte reduziert5. Weitere Studien mit Infliximab folgten, ebenso Studien mit Etanercept und später Adalimumab, und in den letzten Jahren auch Golimumab und Certolizumab Pegol; das Wirkprinzip ist mittlerweile seit mehr als 10 Jahren für die Behandlung der RA, später auch in anderen rheumatologischen Indikationen, zugelassen. In Tabelle 1 sind die heute verfügbaren TNF-Inhibitoren kurz dargestellt.
Klinische Effizienz
Rheumatoide Arthritis
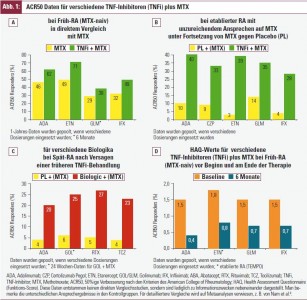
Alle TNF-Inhibitoren haben eine etwa gleiche Wirksamkeit. Dies lässt sich aus den klinischen Studien ableiten und ging auch aus Metanalysen hervor6; diese Evidenz ist aber lediglich indirekt, da direkte Vergleichsstudien fehlen. Die klinische Effizienz betrifft einerseits alle Endpunkte, die klinischen, funktionellen und radiologischen, und andererseits alle RA-Populationen, nämlich Patienten mit früher RA noch vor Beginn einer MTX-Therapie, Patienten mit etablierter RA, die auf MTX nicht hinreichend angesprochen haben, und auch Patienten, die auf früher durchgeführte TNF-Inhibitor-Behandlung nicht hinreichend angesprochen haben. Hinzuweisen ist jedenfalls in diesem Zusammenhang, darauf dass TNF-Blocker bei RA generell in Kombination besser wirksam sind als MTX- oder auch TNF-Blocker-Monotherapie, wobei Adalimumab und Etanercept auch als Monotherapie zugelassen sind, obwohl keine konsistent bessere klinische Wirksamkeit als jene von MTX gezeigt werden konnte, wohl aber hemmen sie die radiologische Progression stärker als MTX (wenn auch weniger gut als in Kombination mit MTX). In Abbildung 1 sind die Daten für eine etwa 50 % klinische Verbesserung nach den Kriterien des American College of Rheumatology (ACR50) dargestellt, und zwar für frühe RA in direktem Vergleich mit MTX (Abb. 1A) und etablierte RA in Vergleich zu Placebo unter Fortsetzung des nicht ausreichend wirksamen MTX (Abb. 1B). Wenn die Daten auch zwecks besserer Anschaulichkeit nebeneinander dargestellt sind, handelt es sich nicht um direkte Vergleichsstudien – dies sieht man schon allein an der Unterschiedlichkeit der Ergebnisse bei den sonst analogen Kontrollpopulationen. Vergleicht man aber die jeweilige Wirksamkeit mit jener der Kontrollgruppen, findet man ähnliche ACR50-Ergebnisse, und auch Metanalysen haben dies untermauert. In Abb. 1C sind Daten der derzeit publizierten Studien bei Patienten gezeigt, die zuvor bereits mit TNF-Inhibitoren behandelt wurden; unter den TNF-Blockern ist lediglich Golimumab in dieser Population untersucht worden, doch ist davon auszugehen, dass auch die anderen TNF-Inhibitoren in dieser Situation ähnliche Ergebnisse zeitigen würden. Jedenfalls sind die mit Golimumab erzielten Resultate unter Berücksichtigung von 6-Monats-Daten und gleichzeitiger MTX-Gabe jenen, die mit anderen Biologika in dieser Patientengruppe erzielt wurden, gleichfalls ähnlich. Schließlich zeigt Abb. 1D die Verbesserung der körperlichen Funktionsfähigkeit, gemessen mittels Health Assessment Questionnaire (HAQ), bei Patienten mit früher RA.
Dosisreduktion: In zunehmendem Maße wird heute die Frage gestellt, ob bzw. wann eine TNF-Inhibitor-Therapie bei sehr gutem Ansprechen abgesetzt werden kann. Randomisierte, kontrollierte Studien dieser Frage sind derzeit nicht verfügbar. Allerdings zeitigen Beobachtungsuntersuchungen, dass das Absetzen von TNF-Blockern häufig von Exazerbationen der RA gefolgt ist, wobei dies insbesondere bei Patienten, die vor dem Einsatz von Biologika schon eine lange Krankheitsdauer aufweisen, der Fall ist 7–9. Daher ist, entsprechend den EULAR Empfehlungen10, bei längerfristiger Remission eine vorsichtige Dosisreduktion oder Intervallverlängerung und allenfalls ein Absetzen unter Beigehaltung der Therapie mit einem synthetischen Basistherapeutikum wie MTX denkbar.
Psoriasisarthritis (PsA) und ankylosierende Spondylitis (AS)
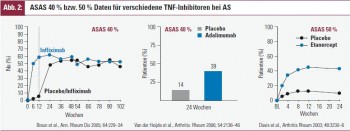
Alle TNF-Inhibitoren, die entsprechend untersucht wurden, zeitigen eine hohe Wirksamkeit bei PsA und AS 11, 12. Bei der PsA betrifft dies artikuläre ebenso wie extraartikuläre Manifestationen, wie Enthesiopathie oder Hautveränderungen, und auch bei AS werden nicht nur die axialen, sondern auch die peripheren Manifestationen deutlich verbessert. Dies gilt nicht nur für die lange verfügbaren TNF-Inhibitoren Adalimumab, Etanercept und Infliximab, sondern auch für Golimumab 13, 14, während Certolizumab Pegol in diesen Indikationen noch nicht untersucht wurde. Bei PsA führen die TNF-Inhibitoren durchwegs zu etwa 40–50%igen Ansprechraten nach den ACR50-Responsekriterien. Neuere Kriterien, wie der DAPSA/DAREA sind für die Verlaufsbeobachtung der PsA sehr gut geeignet15. Abbildung 2 zeigt die wiederum sehr ähnlichen klinischen Ergebnisse für Adalimumab, Etanercept und Infliximab nach ASAS-Kriterien, wobei auch Golimumab ähnliche Daten zeitigt. Ähnlich wie für die RA gilt auch für die AS, dass nach Absetzen der TNF-Inhibitoren bei fast allen Patienten eine Exazerbation der Krankheitsaktivität folgt16 (Abb. 3). Wichtig ist festzuhalten, dass für die RA neben den TNF-Inhibitoren auch eine Reihe anderer Medikamente, wie Abatacept, Rituximab und Tocilizumab zugelassen sind, während in der PsA und der AS bisher nur die Wirksamkeit von TNF-Inhibitoren bei Patienten, die auf andere Therapien nicht hinreichend ansprachen, nachweisbar war. Daher ist bei unzureichendem Ansprechen auf einen TNF-Blocker ein Wechsel zu einem gegen andere Zielstrukturen gerichteten Biologikum nicht möglich, wohl aber ist vielfach beobachtet worden, dass ein Wechsel von einem TNF-Inhibitor zu einem anderen erfolgreich ist 17–19. Bezüglich der Wirksamkeit der TNF-Inhibitoren bei Psoriasis ist anzumerken, dass – bei Fehlen direkter Vergleiche – die Reduktion des Hautindex unter Anti-TNF-Antikörpertherapie effizienter ausfiel als unter Therapie mit dem TNF-Rezeptorkonstrukt. Erwähnenswert ist in diesem Zusammenhang, dass ein neues Therapeutikum für Psoriasis, der Anti-Interleukin-12/23-Antikörper Ustekinumab, bei Psoriasis bessere Ergebnisse zeitigte als Etanercept20, während die Effizienz bei Psoriasisarthritis, wo Etanercept ausgezeichnet wirksam ist, eine nur milde zu sein scheint21. Im Hinblick auf die AS ist auch anzumerken, dass bei gleichzeitigem Befall des Darmes im Sinne eines M. Crohn oder einer Colitis ulcerosa den Antikörpern der Vorzug zu geben ist, da Adalimumab und Infliximab, aber auch Certolizumab, nicht aber Etanercept, bei entzündlicher Darmerkrankung effizient sind 22, 23.
Unerwünschte Wirkungen
TNF-Inhibitoren führen, wie alle Medikamente, die mit dem Immunsystem interferieren, zu einer Reihe möglicher unerwünschter Wirkungen. Sie im Detail hier anzuführen, würde den Rahmen dieser Übersicht sprengen, und es wird daher diesbezüglich auf die Beipacktexte und Übersichtsarbeiten verwiesen24. Zum einen können subkutane Injektionen lokale Reaktionen auslösen und die Infusion mit einem chimären Antikörper wie Infliximab zu einer – wenn auch selten auftretenden – Hypersensitivitätsreaktion führen. Darüber hinaus sind u.a. Fragen zu Infekthäufigkeit, malignen Erkrankungen, Auslösung von Autoimmunkrankheiten, kardiovaskulären Ereignissen und demyelinisierenden Krankheiten von besonderem Interesse und zusätzlich Fragen zur Zeugungsfähigkeit und Schwangerschaft. Die Daten, die diesbezüglich verfügbar sind, stammen aus kontrollierten Studien, aus Verlängerungsstudien und Informationen der Herstellerfirmen sowie insbesondere von Biologikaregistern. Biologikaregister, die üblicherweise von den jeweiligen nationalen rheumatologischen Gesellschaften organisiert werden, um eine möglichst breite Teilnahme zu erzielen, sind eine äußerst wertvolle Quelle für Informationen zu unerwünschten Wirkungen; allerdings sind Aussagen zur Wirksamkeit sehr eingeschränkt.
Malignome
Aus den vorliegenden Daten, insbesondere auch jenen verschiedener nationaler Biologikaregister, lässt sich ableiten, dass Malignome unter TNF-Inhibitoren nicht gesteigert sind25. Dies gilt auch für Zustände nach Malignomen und grundsätzlich auch für Lymphome, obwohl hierbei weitere Langzeitbeobachtungen wohl notwendig sind26. Allerdings sind bei Patienten mit Wegener’scher Granulomatose, die Cyclophosphamid erhielten, unter Etanercept 6 Fälle von soliden Malignomen gegenüber keinem derartigen Fall in der Kontrollgruppe aufgetreten27; dies weist darauf hin, dass TNF-Inhibitoren, insbesondere Etanercept, nicht mit Cyclophosphamid kombiniert werden sollten.
Autoimmunkrankheiten
Autoimmunkrankheiten wie medikamenteninduzierter Lupus erythemato oder Antiphospholipidsyndrom können auftreten28, sind aber eher selten. Ähnliches gilt für demyelinisierende Krankheiten, wie multiple Sklerose29; bei Bestehen einer demyelinisierenden Erkrankung sind TNF-Inhibitoren kontraindiziert, da eine Exazerbation auftreten kann. Bei Versagen synthetischer Basistherapeutika in einer derartigen Situation ist wohl Rituximab geeignet, da Studien bei multipler Sklerose eine gute Effizienz dieser Therapie zeitigten30.
Infekte
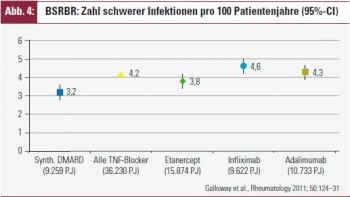
Schwerwiegende Infektionen (definiert als Infekte, die einer parenteralen antibiotischen Therapie oder eines stationären Aufenthaltes bedürfen, treten unter TNF-Inhibitoren im Vergleich zu Kontrollpatienten, die synthetische Basistherapeutika erhalten, häufiger auf (Abb. 4)31. Dies gilt für alle TNF-Blocker gleichermaßen. Allerdings nimmt das Risiko für schwerwiegende Infektionen im Laufe der Behandlungszeit ab, vermutlich bedingt durch einen „Gesunde Kohorten“-effekt, indem bei Patienten mit schweren Infekten die TNF-Inhibitoren abgesetzt und bei jenen mit geringerem Risiko fortgesetzt werden. Das Risiko für schwerwiegende Infektionen steigt mit dem Vorhandensein von Komorbiditäten (z. B. Diabetes, chronische Lungenerkrankungen), dem Alter und dem Einsatz von Glukokortikoiden. Das deutsche RABBIT-Register beobachtete auch eine Reihe von Fällen mit septischem Schock (3 unter Etanercept, 2 unter synthetischen Basistherapeutika und keinen unter Infliximab)31. Auch das Risiko einer H.-zoster-Infektion ist unter TNF-Blockern erhöht32. Um das Infektionsrisiko zu verringern, werden vor Einleitung einer Biologikatherapie entsprechende Impfungen (z. B. Grippe, Pneumokokken und notwendige Auffrischungsimpfungen) empfohlen. Allerdings sollten unter immunsuppressiver Therapie keine Impfungen mit Lebendimpfstoffen (z. B. Gelbfieber) erfolgen, Totimpfstoffe können aber bedenkenlos eingesetzt werden. Im Zusammenhang mit Infektionen ist erwähnenswert, dass im Rahmen septischer Schockzustände TNF erhöht ist und die TNF-Inhibition vor zwei Jahrzehnten zunächst in klinischen Studien an Sepsispatienten erprobt wurde, in der Hoffnung, die Mortalität zu senken1. Allerdings war die Effizienz in dieser Situation nur bescheiden33, und teilweise wurde eine erhöhte Mortalität beobachtet34. Opportunistische Infektionen treten unter TNF-Blockern ebenfalls häufiger auf als unter synthetischen Basistherapeutika 24, 35. Im Hinblick auf Infekte ist es wichtig zu bedenken – und Patienten entsprechend zu informieren –, dass Infektzeichen, wie Fieber, oder auch Laborsurrogate, wie CRP-Anstieg, unter TNF-Inhibitoren kaschiert sein können.
Chronische Hepatitiden stellen oft ein besonderes Problem in der Behandlung der RA dar, weil einige der Basistherapeutika, insbesondere MTX, hepatotoxisch sind. Vor allem bei chronischer Hepatitis B ist auch unter synthetischen Basistherapeutika eine Reaktivierung bis zu fulminanter Hepatitis beobachtet worden, insbesondere nach Dosisreduktion oder Absetzen der Therapie36. Ähnliches gilt für die Behandlung mit TNF-Inhibitoren, wobei unter Infliximab auch 2 Todesfälle nach Aktivierung einer fulminanten Hepatitis beobachtet wurden 37, 38. Zu Details hinsichtlich der Charakteristika des Hepatitis-B-Antigen bzw. -Antikörperprofils wird auf die Literatur verwiesen36. Hinsichtlich der Hepatitis C liegen keine sicheren Hinweise auf Reaktivierungen im Rahmen der TNFBlocker- Therapie vor39; dennoch sollten die Leberenzymwerte und allenfalls HCV-RNA regelmäßig kontrolliert werden. Generell wird empfohlen, Patienten vor Beginn einer Biologikatherapie auf das Vorliegen einer Hepatitis, insbesondere Hepatitis B (HBs Ag, Anti- HBs, Anti-HBc) zu screenen. Bei HBs-Ag-Positivität sollte eine prophylaktische Therapie, etwa mit Lamuvidin (Konsultierung eines Hepatologen), 1 Woche vor Beginn der Biologikabehandlung institutiert werden; bei HBs-Ag-Negativität aber positivem Anti- HBc-Befund liegt der Verdacht auf eine okkulte Hepatitis-BInfektion vor und sollte eine prophylaktische antivirale Therapie in Absprache mit einem Hepatologen erwogen werden. Bei Patienten ohne Hinweis auf eine HBV-Infektion sollte eine entsprechende Impfung in Erwägung gezogen werden.
Tuberkulose: Einen besonderen Stellenwert unter den Infektionen während TNF-Inhibitor-Therapien nimmt die Tuberkulose ein. Mycobacterium tuberculosis wird, ähnlich wie andere intrazelluläre Keime, mit Hilfe von TNF unter Kontrolle gehalten. Dabei spielt einerseits TNF der Makrophagen, das T-Lymphozyten aktivieren kann, andererseits TNF und Gamma-Interferon der T-Zellen, die Makrophagen aktivieren, eine besondere Rolle, die in einer Granulombildung bestehend aus Makrophagen und T-Lymphozyten mündet. Dadurch wird die Ausbreitung der Tuberkelbazillen kontrolliert, doch können sie in Makrophagen dieser Granulome Jahrzehnte überleben, sofern nicht eine adäquate tuberkulostatische Therapie durchgeführt wurde. Wird TNF dann inhibiert, kann die Granulombildung nicht mehr aufrechterhalten werden, und es kommt zur Dissemination der Keime40. Die Diagnose einer latenten Tuberkulose ist in den letzten Jahren vielfach diskutiert und durch Neuentwicklungen einem Wandel unterzogen worden. Fast ein Jahrhundert lang wurde der intradermale Tuberkulin-Hauttest (Mendel-Mantoux) mittels PPD (purified protein derivative) durchgeführt, doch kann dieser einerseits bei immunsupprimierten Patienten falsch negativ, andererseits durch eine frühere BCG-Vakzination (Bacille Calmuette Guerin) oder nach Infektionen mit nicht tuberkulösen Arten von Mycobakterien durch Kreuzreaktion falsch positiv sein40. Aus diesem und anderen Gründen, die von M. Gaugg in diesem Heft (Seite 23) im Detail diskutiert werden, haben einige europäische Gesellschaften den Tuberkulintest zum Nachweis einer latenten Tuberkulose zuletzt nicht mehr empfohlen. Allerdings zeigt eine rezente Untersuchung, dass zum Nachweis einer latenten TB in einer Population mit niedriger Prävalenz an BCG-Vakzinationen der Hauttest dem IGRA überlegen zu sein scheint, und es wird empfohlen, zur Maximierung der Diagnose latenter TB-Infektionen beide Tests durchzuführen41. Darüber hinaus ist in einer Metanalyse hingewiesen worden, dass eine mehr als 15 Jahre vor dem Hauttest durchgeführt BCG-Vakzination keinen großen Einfluss auf den PPD-Test hat, insbesondere wenn die Reaktion 15 mm übersteigt42. Überdies ist bisher die Effektivität einer prophylaktischen Therapie nur für im Tuberkulintest positive PatientInnen, und nicht für IGRA-positive, erwiesen 40, 43. Das letzte Wort scheint somit noch nicht gesprochen zu sein.
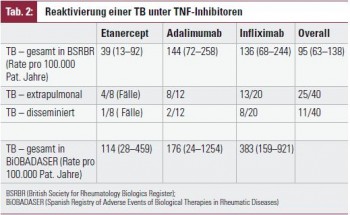
Die Reaktivierung einer TB ist generell unter TNF-Inhibitoren häufiger als unter synthetischen Basistherapeutika, wenn auch bei Therapie mit dem TNF-Rezeptor-Konstrukt geringer als bei Antikörpertherapie 43, 44 (Tabelle 2).
Ein ausgezeichneter europäischer Konsens von Experten auf dem Gebiet der Tuberkulose und von Rheumatologen mit großer Erfahrung hinsichtlich des Auftretens einer TB bei RA aus Registern nationaler rheumatologischer Gesellschaften wurde rezent im European Respiratory Journal publiziert40, und dieser Konsens könnte als gegenwärtiger Stand des Wissens auch für Österreich direkt übernommen werden. In dieser Übersichtsarbeit wird auch eine Reihe von wiederholt gestellten Fragen beantwortet. So wird etwa festgehalten, dass das Risiko, eine TB zu entwickeln, unter Etanercept geringer ist als unter Therapie mit Anti-TNFAntikörpern, dass aber dennoch bei latenter TB eine prophylaktische Therapie nötig ist, weil auch unter Etanercept TB auftritt; und – im Sinne der obigen Diskussion – wird klargestellt, dass es gegenwärtig keine sichere Aussage hinsichtlich der Über legenheit von IGRA gegenüber dem Tuberkulintest gibt. Grundsätzlich kann aber davon ausgegangen werden, dass bei IGRA-negativem Befund, negativem Lungenröntgen und negativer TB-Anamnese eine weitere Diagnostik nicht notwendig ist. Es ist auch wichtig zu bedenken, dass eine TB nicht nur reaktiviert, sondern auch de novo auftreten kann. In jedem Falle ist sowohl vor als auch während der TNF-Blocker-Therapie eine exakte Anamnese unter Berücksichtigung der Herkunftsländer oder Reisetätigkeit von Patienten wesentlich.
Schwangerschaft
Da viele Patientinnen mit rheumatoider Arthritis im gebärfähigen Alter stehen, kommt der Frage der Sicherheit von TNFInhibitoren in der Schwangerschaft eine besondere Bedeutung zu. Kürzlich wurden 130 Schwangerschaften des britischen Registers ausgewertet; dabei traten spontane Aborte unter TNF-Inhibitoren mit oder ohne gleichzeitige Gabe von MTX oder Leflunomid häufiger auf als bei Patientinnen, die nicht mit TNF-Blockern behandelt wurden oder in der Kontrollgruppe45. Missbildungen scheinen nicht häufiger zu sein als in Kontrollen. Die Autoren schließen, dass weiterhin keine ausreichende Evidenz zur Sicherheit von TNF-Inhibitoren in der Schwangerschaft besteht, sodass die Empfehlung, diese Substanzen zum Zeitpunkt der Konzeption zu vermeiden, aufrecht bleiben sollte. Zur Frage eines potenziell negativen Effekts von TNF-Inhibitoren auf die männliche Zeugungsfähigkeit liegen keine hinreichenden Daten vor, aber eine kürzlich publizierte Studie zu Patienten mit M. Bechterew unter TNF-Blockern zeigte, dass die Spermienqualität jener von Gesunden ähnlich war46.
Kardiovaskuläres Risiko
Immer wieder wird auch die kardiovaskuläre Sicherheit der TNF-Inhibitor-Therapie hinterfragt, zumal in klinischen Studien bei Patienten mit ausgeprägter Herzinsuffizienz, bei denen ja TNF-Spiegel erhöht sind, eine höhere Mortalität auftrat und diese Substanzen bei Herzinsuffizienz NYHA III und IV kontraindiziert sind (siehe Produktbeschreibungen). Andererseits ist eine Komplikation der RA die verminderte Lebenserwartung, die insbesondere auf eine vermehrte kardiovaskuläre Mortalität zurückgeht, wie sie bei chronischen Entzündungen generell bekannt ist und bei RA vom Ausmaß der Krankheitsaktivität abhängt 47, 48. In diesem Zusammenhang soll zum Abschluss darauf hingewiesen werden, dass in einer Reihe observationeller Studien durchwegs eine Reduktion von Myokardinfarkten und anderen tödlichen kardiovaskulären Ereignissen unter Therapie mit TNF-Inhibitoren beobachtet wurde 49–51; dies spricht für den positiven Effekt eine guten antiinflammatorischen Therapie auf das kardiovaskuläre Risiko bei RA. Hinsichtlich Kontraindikationen und unerwünschter Wirkungen, die hier nicht im Detail besprochen wurden, wird auf den Beipacktext verwiesen.
Zusammenfassend sind TNF-Inhibitoren nicht nur die ersten Biologika, die je erfolgreich bei RA eingesetzt wurden und die einzigen, die erfolgreich bei AS und PsA verwendet werden, sondern haben zugleich in all diesen Indiktionen – unter Berücksichtigung der Kontraindikationen und Sicherheitsmaßnahmen und konsequenter Kontrolluntersuchungen – zufriedenstellendes Nutzen-Risiko-Profil.
1 Tracey KJ, Cerami A., Tumor necrosis factor: a pleiotropic cytokine and therapeutic target. Annu Rev Med 1994; 45:491–503.
2 Feldmann M, Brennan FM, Foxwell BM, Maini RN. The role of TNF alpha and IL-1 in rheumatoid arthritis. Curr Dir Autoimmun 2001;
3, 188–199. 3 Redlich K, Hayer S, Ricci R, David JP, Tohidast-Akrad M, Kollias G et al., Osteoclasts are essential for TNF-alpha-mediated joint destruction. J Clin Invest 2002; 110(10):1419–1427.
4 Feldmann M, Brennan FM, Maini RN, Role of cytokines in rheumatoid arthritis. Annu Rev Immunol 1996; 14:397–440.
5 Elliott MJ, Maini RN, Feldmann M, Kalden JR, Antoni C, Smolen JS et al., Randomised double-blind comparison of chimeric monoclonal antibody to tumour necrosis factor alpha (cA2) versus placebo in rheumatoid arthritis. Lancet 1994; 344(8930):1105–1110.
6 Nam JL, Winthrop KL, van Vollenhoven RF, Pavelka K, Valesini G, Hensor EM et al., Current evidence for the management of rheumatoid arthritis with biological disease-modifying antirheumatic drugs: a systematic literature review informing the EULAR recommendations for the management of RA. Ann Rheum Dis 2010; 69(6):976–986.
7 Saleem B, Keen H, Goeb V, Parmar R, Nizam S, Hensor EM et al., Patients with RA in remission on TNF blockers: when and in whom can TNF blocker therapy be stopped? Ann Rheum Dis 2010; 69(9):1636–1642.
8 Tanaka Y, Takeuchi T, Mimori T, Saito K, Nawata M, Kameda H et al., Discontinuation of infliximab after attaining low disease activity in patients with rheumatoid arthritis: RRR (remission induction by Remicade in RA) study. Ann Rheum Dis 2010; 69(7):1286–1291.
9 Brocq O, Millasseau E, Albert C, Grisot C, Flory P, Roux CH et al., Effect of discontinuing TNFalpha antagonist therapy in patients with remission of rheumatoid arthritis. Joint Bone Spine 2009; 76(4):350–355.
10 Smolen JS, Landewe R, Breedveld FC, Dougados M, Emery P, Gaujoux-Viala C et al., EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 2010; 69(6):964–975.
11 Braun J, Sieper J., Ankylosing spondylitis. Lancet 2007; 369(9570):1379–1390.
12 Ravindran V, Scott DL, Choy EH., A systematic review and meta-analysis of efficacy and toxicity of disease modifying anti-rheumatic drugs and biological agents for psoriatic arthritis. Ann Rheum Dis 2008; 67(6):855–859.
13 Kavanaugh A, McInnes I, Mease P, Krueger GG, Gladman D, Gomez-Reino J et al., Golimumab, a new human tumor necrosis factor alpha antibody, administered every four weeks as a subcutaneous injection in psoriatic arthritis: Twenty-fourweek efficacy and safety results of a randomized, placebo-controlled study. Arthritis Rheum 2009; 60(4):976–986.
14 Inman RD, Davis JC, Jr., Heijde D, Diekman L, Sieper J, Kim SI et al., Efficacy and safety of golimumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial. Arthritis Rheum 2008; 58(11):3402–3412.
15 Schoels M, Aletaha D, Funovits J, Kavanaugh A, Baker D, Smolen JS., Application of the DAREA/DAPSA score for assessment of disease activity in psoriatic arthritis. Ann Rheum Dis 2010; 69(8):1441–1447.
16 Baraliakos X, Listing J, Brandt J, Zink A, Alten R, Burmester G et al., Clinical response to discontinuation of anti-TNF therapy in patients with ankylosing spondylitis after 3 years of continuous treatment with infliximab. Arthritis Res Ther 2005; 7(3):R439–R444.
17 Haberhauer G, Strehblow C, Fasching P., Observational study of switching anti-TNF agents in ankylosing spondylitis and psoriatic arthritis versus rheumatoid arthritis. Wien Med Wochenschr 2010; 160(9-10):220–224.
18 Lie E, van der HD, Uhlig T, Mikkelsen K, Rodevand E, Koldingsnes W et al., Effectiveness of switching between TNF inhibitors in ankylosing spondylitis: data from the NOR-DMARD register. Ann Rheum Dis 2011; 70(1):157–163.
19 Conti F, Ceccarelli F, Marocchi E, Magrini L, Spinelli FR, Spadaro A et al., Switching tumour necrosis factor alpha antagonists in patients with ankylosing spondylitis and psoriatic arthritis: an observational study over a 5-year period. Ann Rheum Dis 2007; 66(10):1393-1397.
20 Griffiths CE, Strober BE, van de KP, Ho V, Fidelus-Gort R, Yeilding N et al., Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. N Engl J Med 2010; 362(2):118–128.
21 Gottlieb A, Menter A, Mendelsohn A, Shen YK, Li S, Guzzo C et al., Usteki numab, a human interleukin 12/23 monoclonal antibody, for psoriatic arthritis: randomised, double-blind, placebo-controlled, crossover trial. Lancet 2009; 373(9664):633–640.
22 Pache I, Rogler G, Felley C., TNF-alpha blockers in inflammatory bowel diseases: practical consensus recommendations and a user’s guide. Swiss Med Wkly 2009; 139(19-20):278–287.
23 Leso V, Leggio L, Armuzzi A, Gasbarrini G, Gasbarrini A, Addolorato G., Role of the tumor necrosis factor antagonists in the treatment of inflammatory bowel disease: an update. Eur J Gastroenterol Hepatol 2010; 22(7):779–786.
24 Furst DE, Keystone EC, Braun J, Breedveld FC, Burmester GR, De BF et al., Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2010. Ann Rheum Dis 2011; 70 Suppl 1:i2–36.
25 Askling J, van Vollenhoven RF, Granath F, Raaschou P, Fored CM, Baecklund E et al., Cancer risk in patients with rheumatoid arthritis treated with anti-tumor necrosis factor alpha therapies: does the risk change with the time since start of treatment? Arthritis Rheum 2009; 60(11):3180–3189.
26 Strangfeld A, Hierse F, Rau R, Burmester GR, Krummel-Lorenz B, Demary W et al., Risk of incident or recurrent malignancies among patients with rheumatoid arthritis exposed to biologic therapy in the German biologics register RABBIT. Arthritis Res Ther 2010; 12(1):R5.
27 Stone JH, Holbrook JT, Marriott MA, Tibbs AK, Sejismundo LP, Min YI et al., Solid malignancies among patients in the Wegener’s Granulomatosis Etanercept Trial. Arthritis Rheum 2006; 54(5):1608–1618.
28 Ramos-Casals M, Roberto PA, az-Lagares C, Cuadrado MJ, Khamashta MA, Autoimmune diseases induced by biological agents: a double-edged sword? Autoimmun Rev 2010; 9(3):188-193.
29 Mohan N, Edwards ET, Cupps TR, Oliverio PJ, Sandberg G, Crayton H et al., Demyelination occurring during anti-tumor necrosis factor alpha therapy for inflammatory arthritides. Arthritis Rheum 2001; 44(12):2862–2869.
30 Hauser SL, Waubant E, Arnold DL, Vollmer T, Antel J, Fox RJ et al., B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. N Engl J Med 2008; 358(7):676–688. 31 Listing J, Strangfeld A, Kary S, Rau R, von HU, Stoyanova-Scholz M et al., Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum 2005; 52(11):3403–3412.
32 Strangfeld A, Listing J, Herzer P, Liebhaber A, Rockwitz K, Richter C et al., Risk of herpes zoster in patients with rheumatoid arthritis treated with anti-TNF-alpha agents. JAMA 2009; 301(7):737–744. 33 Reinhart K, Karzai W, Anti-tumor necrosis factor therapy in sepsis: update on clinical trials and lessons learned. Crit Care Med 2001; 29(7 Suppl):S121–S125.
34 Fisher CJ, Jr., Agosti JM, Opal SM, Lowry SF, Balk RA, Sadoff JC et al., Treatment of septic shock with the tumor necrosis factor receptor:Fc fusion protein. The Soluble TNF Receptor Sepsis Study Group. N Engl J Med 1996; 334(26):1697–1702.
35 Strangfeld A, Listing J, Infection and musculoskeletal conditions: Bacterial and opportunistic infections during anti-TNF therapy. Best Pract Res Clin Rheumatol 2006; 20(6):1181–1195.
36 Calabrese LH, Zein NN, Vassilopoulos D, Hepatitis B virus (HBV) reactivation with immunosuppressive therapy in rheumatic diseases: assessment and preventive strategies. Ann Rheum Dis 2006; 65(8):983–989.
37 Carroll MB, Forgione MA, Use of tumor necrosis factor alpha inhibitors in hepatitis B surface antigen-positive patients: a literature review and potential mechanisms of action. Clin Rheumatol 2010; 29(9):1021–1029.
38 Zingarelli S, Frassi M, Bazzani C, Scarsi M, Puoti M, Airo P, Use of tumor necrosis factor-alpha-blocking agents in hepatitis B virus-positive patients: reports of 3 cases and review of the literature. J Rheumatol 2009; 36(6):1188–1194.
39 Calabrese LH, Zein N, Vassilopoulos D, Safety of antitumour necrosis factor (anti- TNF) therapy in patients with chronic viral infections: hepatitis C, hepatitis B, and HIV infection. Ann Rheum Dis 2004; 63 Suppl 2:ii18–ii24.
40 Solovic I, Sester M, Gomez-Reino JJ, Rieder HL, Ehlers S, Milburn HJ et al., The risk of tuberculosis related to tumour necrosis factor antagonist therapies: a TBNET consensus statement. Eur Respir J 2010; 36(5):1185–1206.
41 Bartalesi F, Vicidomini S, Goletti D, Fiorelli C, Fiori G, Melchiorre D et al., QuantiFERON-TB Gold and the TST are both useful for latent tuberculosis infection screening in autoimmune diseases. Eur Respir J 2009; 33(3):586–593.
42 Wang L, Turner MO, Elwood RK, Schulzer M, FitzGerald JM, A meta-analysis of the effect of Bacille Calmette Guerin vaccination on tuberculin skin test measurements. Thorax 2002; 57(9):804–809. 43 Gomez-Reino JJ, Carmona L, Angel DM, Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007; 57(5):756–761.
44 Dixon WG, Hyrich KL, Watson KD, Lunt M, Galloway J, Ustianowski A et al., Drugspecific risk of tuberculosis in patients with rheumatoid arthritis treated with anti- TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann Rheum Dis 2010; 69(3):522–528.
45 Verstappen SM, King Y, Watson KD, Symmons DP, Hyrich KL, Anti-TNF therapies and pregnancy: outcome of 130 pregnancies in the British Society for Rheumatology Biologics Register. Ann Rheum Dis 2011.
46 Villiger PM, Caliezi G, Cottin V, Forger F, Senn A, Ostensen M, Effects of TNF antagonists on sperm characteristics in patients with spondyloarthritis. Ann Rheum Dis 2010; 69(10):1842–1844.
47 Kremers HM, Crowson CS, Therneau TM, Roger VL, Gabriel SE, High ten-year risk of cardiovascular disease in newly diagnosed rheumatoid arthritis patients: a population- based cohort study. Arthritis Rheum 2008; 58(8):2268–2274. 48 Kitas GD, Gabriel SE, Cardiovascular disease in rheumatoid arthritis: state of the art and future perspectives. Ann Rheum Dis 2011; 70(1):8–14.
49 Listing J, Strangfeld A, Kekow J, Schneider M, Kapelle A, Wassenberg S et al., Does tumor necrosis factor alpha inhibition promote or prevent heart failure in patients with rheumatoid arthritis? Arthritis Rheum 2008; 58(3):667–677.
50 Naranjo A, Sokka T, Descalzo MA, Calvo-Alen J, Horslev-Petersen K, Luuk kainen RK et al., Cardiovascular disease in patients with rheumatoid arthritis: results from the QUEST-RA study. Arthritis Res Ther 2008; 10(2):R30.
51 Jacobsson LT, Turesson C, Nilsson JA, Petersson IF, Lindqvist E, Saxne T et al., Treatment with TNF blockers and mortality risk in patients with rheumatoid arthritis. Ann Rheum Dis 2007; 66(5):670–675.