EULAR-Empfehlungen: Management der rheumatoiden Arthritis
Die Europäische Rheumaliga (EULAR) hat im Jahre 2010 ihre ersten Empfehlungen zur Therapie der rheumatoiden Arthritis (RA) mit Basistherapeutika („Disease Modifying Anti- Rheumatic Drugs“, DMARDs) veröffentlicht.1 Seither gab es, in Abhängigkeit von neuen Entwicklungen, drei Neufassungen (Updates), die nunmehr letzte entstand im Jahre 2019 und ist kürzlich publiziert worden.2 Bevor diese neuesten Empfehlungen dargelegt werden, sollte nicht unerwähnt bleiben, dass der EULAR-Behandlungsalgorithmus für die RA im Laufe des letzten Jahrzehntes eine deutliche Verfestigung erfahren hat, was sich an der Übernahme vieler Punkte in konsekutive Neufassungen manifestiert, aber auch durch die Übernahme von wesentlichen Aspekten der EULAR-Empfehlungen in die entsprechenden Empfehlungen anderer nationaler und regionaler Gesellschaften ersehen lässt.
Die Behandlungsempfehlungen der EULAR basieren stets auf den Daten von systematischen Literaturrecherchen (SLRs) und auf einer im Zusammenhang mit diesen Daten entwickelten Expertenmeinung. Die Revision des Jahres 2019 erfolgte auf Basis von 2 SLRs, einem zur Wirksamkeit von DMARDs3 und einem zur Sicherheit von DMARDs.4
Wesentliche Aspekte der Empfehlung
Folgende EULAR-Standpunkte haben sich im Laufe der Jahre bestätigen und sogar stärker untermauern lassen:
(a) Therapieziel ist Remission: Das therapeutische Ziel sollte die Remission nach den ACR-EULAR-Kriterien (z. B. indexbasiert nach CDAI oder SDAI) oder zumindest die niedrige Krankheitsaktivität sein; eine höhere als die niedrige Krankheitsaktivität nach entsprechenden Scores darf nicht toleriert werden. Diesbezüglich ist auch festzuhalten, dass das Anstreben einer Remission mittels bildgebender Verfahren nicht nur unnötig, sondern sogar kontraproduktiv – weil mit höheren Kosten und schweren Nebenwirkungen ohne bessere Wirksamkeit vergesellschaftet – ist, wie nicht nur sonographische Studien nachwiesen, sondern rezent auch eine MRI-Studie gezeigt hat.5
(b) „Treat to target“: Die therapeutische Strategie ist wesentlich und sollte sich nach den Treat-to-Target-Empfehlungen ausrichten6, die eine Reduktion von zumindest 50 % der Krankheitsaktivität nach 3 Monaten Therapie und die Erreichung des therapeutischen Ziels nach 6 Monaten vorsehen.
(c) Initial MTX + GC: Initial sollte eine Kombination von Methotrexat (MTX) und Glukokortikoiden (GC) eingesetzt werden.
Gerade dieser letztere Aspekt ist immer wieder in Frage gestellt worden: Würden die Patientinnen nicht doch von einer initialen Therapie mit biologischen (b) DMARDs oder Januskinase-Inhibitoren (JAKi) stärker profitieren als von MTX + GC war eine Frage, die ebenso wiederholt diskutiert wurde wie jene nach einer allfällig besseren Effizienz einer Dreifachkombination von MTX + Hydroxychloroquin + Salazopyrin. Doch die EULAR-Arbeitsgruppe blieb mehrheitlich standfest, weil die Evidenz aus den schon früher abgehandelten BeSt-, tREACH-, CareRA- und IDEA-Studien einfach eine gegenteilige Information erbracht hatte. Und diese evidenzbasierte Empfehlung für MTX + GC als initiale Therapiestrategie wurde nun in noch stärkerem Maße durch die rezente NORD-STAR-Studie bestätigt, die ergab, dass die Effektivität von MTX + GC nicht nur von einem TNF-Inhibitor + MTX nicht übertroffen wurde, wie dies zuvor schon gezeigt worden war, sondern auch nicht von Tocilizumab + MTX oder Abatacept + MTX.7
5 übergeordnete Prinzipien
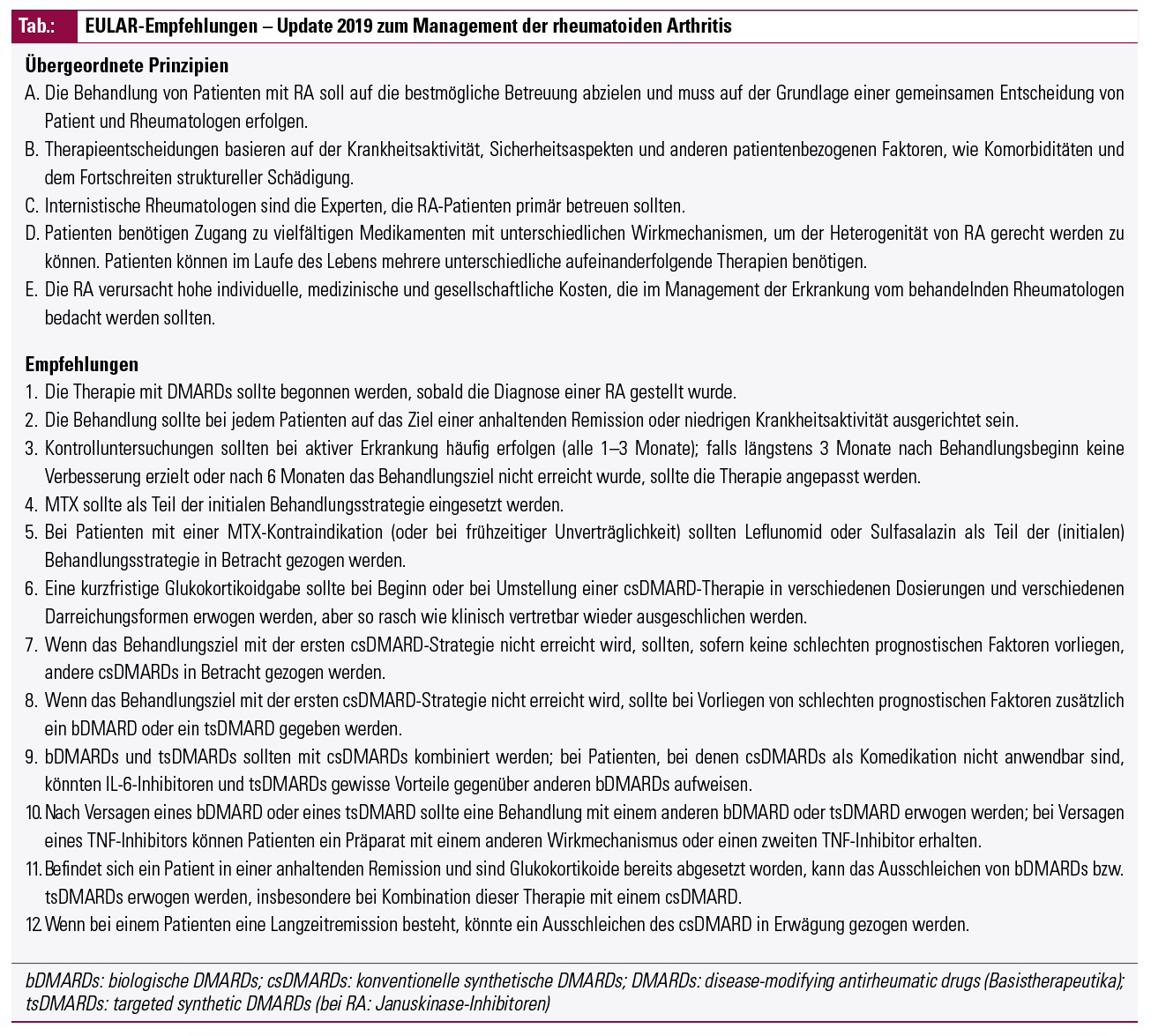
Die neuen EULAR-Empfehlungen haben 5 übergeordnete Prinzipien und 12 spezifische Punkte. Zu den übergeordneten Prinzipien zählt zuallererst die Einbeziehung der PatientInnen in eine gemeinsame Entscheidungsfindung zum Therapieziel und zum einzuschlagenden Behandlungsweg dahin. 4 der 5 übergeordneten Prinzipien sind jenen aus 2016 gleich.
Eines ist hinzugekommen und vermittelt, dass die RA eine chronische Erkrankung ist, die oft vieler therapeutischer Veränderungen und unter Umständen auch vielfältiger bDMARDs bedarf, um zum Ziel zu gelangen. Dieses Prinzip wurde eingefügt, weil in manchen Ländern die Zahl von bDMARDs, die auf Kosten der Krankenkassen eingesetzt werden dürfen, limitiert und eine solche Limitierung inakzeptabel ist.
12 spezifische Empfehlungen
Die detaillierten Empfehlungen sind in der Tabelle wiedergegeben und haben sich in vielerlei Hinsicht gegenüber 2016 nicht verändert (z. B. Punkte 1–7 sowie 9 und 12), was die Validität der früheren Entscheidungen untermauert. Seit 2016 haben wir aber hinsichtlich der Januskinase-Inhibitoren (JAKi) wesentlich mehr Informationen sowohl bezüglich Langzeiteffizienz und -sicherheit aufgrund langer Beobachtungszeiten als auch im Hinblick auf neue Medikamente aus der Substanzklasse und damit einer größeren Datenmenge für JAKi. Daher sind in der aktuellen Empfehlung Nr. 8 die JAKi den bDMARDs gleichgestellt worden, hinsichtlich eines Einsatzes nach Versagen von MTX + GC bei Patienten mit schlechten prognostischen Faktoren. Darüber hinaus sind sie auch in die Punkte 10 und 11 gleichrangig mit bDMARDs einbezogen worden.
Obwohl einige Vergleichsstudien von JAKi gegen einen TNF-Inhibitor in einer signifikant besseren Wirksamkeit der neuen Subtanzen resultierten8, 9, sah die EULAR-Arbeitsgruppe angesichts des Fehlens einer solchen Superiorität mit einer dritten Substanz10 und angesichts des Umstandes, dass in den beiden anderen Studien die besseren Resultate die Zahl geschwollener und druckschmerzhafter Gelenke nicht umfassten, die Unterschiede nicht als klinisch wesentlich an, zumal die Zahl an Herpes-Zoster-Infektionen bei JAKi höher ist als bei Vergleichsmedikamenten und die Frage eines erhöhten Risikos anderer Komplikationen (z. B. Thromboembolien) besteht. Jedenfalls sind bis heute 3 JAKi in der Europäischen Union zugelassen: Tofacitinib, Baricitinib und Upadacitinib; eine Zulassung von Filgotinib wird demnächst erwartet. Und in den revidierten EULAR-Empfehlungen werden sie, wie bereits erwähnt, gegenüber der Nachrangigkeit des Jahres 2016 den bDMARDs gleichgestellt. Die Frage, ob ein bDMARD nach Versagen eines JAKi wirksam ist, die Teil der Forschungsagenda war, wurde kürzlich zumindest für einen JAKi positiv beantwortet.11
Auch bezüglich der IL-6-Rezeptor-Inhibition (IL-6Ri) ist mit Sarilumab eine neue Substanz zugelassen worden – zusätzlich zu Tocilizumab. Für andere bDMARDs (TNF-Inhibitoren, Rituximab) gibt es schon seit längerer Zeit Biosimilars, deren Wirksamkeit und Sicherheit sich im Zuge der neuen SLRs weiter bestätigt hat.
Ein weiterer wesentlicher Aspekt wird in der Empfehlung 9 abgehandelt. Die Arbeitsgruppe der EULAR ist weiterhin der Auffassung, dass die Datenlage eine bessere Wirksamkeit der Kombination von bDMARDs oder JAKi mit MTX oder anderen konventionellen synthetischen (cs)DMARDs zeigt, als dies für eine Monotherapie der Fall ist. Dies betrifft klinische und/oder strukturelle Aspekte. Sollte keines der csDMARDs vertragen werden, dann bestätigen auch neuere Daten eine bessere Wirksamkeit einer Monotherapie von IL-6-Rezeptorblockern (IL-6Ri) oder JAKi etwa im Vergleich zu einer TNF-Inhibitor-Monotherapie, die ja auch, im Gegensatz zu JAKi gegenüber MTX-Monotherapie, schon vor vielen Jahren keine bessere klinische Wirksamkeit ergaben.
Bei Versagen eines bDMARDs oder tsDMARDs kann eine andere Wirksubstanz aus der gleichen oder einer anderen Substanzklasse eingesetzt werden (Empfehlung 10). Sollte eine stringente klinische Remission über zumindest 6 Monate bestehen, kann die Dosis des DMARDs verringert oder das Intervall der Applikationen verlängert werden (Nr. 11).
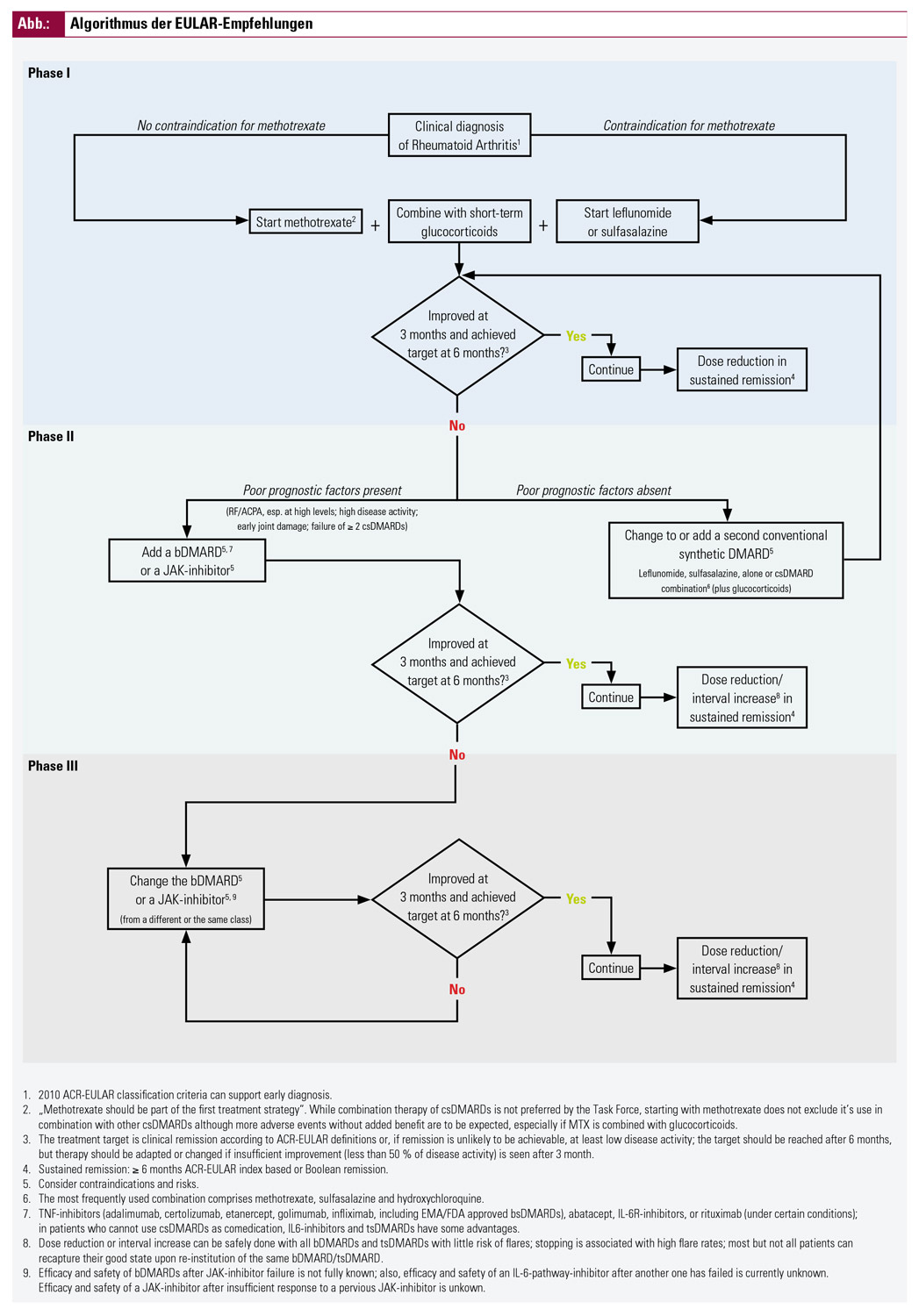
Eine verkürzte Übersicht über die EULAR-Empfehlungen ist als graphischer Algorithmus in der Abbildung dargestellt. Auch die einzelnen Punkte in der Tabelle stellen nur eine Kurzzusammenfassung der Überlegungen dar; die Details der Diskussion und einige Abstimmungswege sind in der Publikation2 nachzulesen bzw. wurden hier teilweise schon erwähnt.
Die EULAR-Empfehlungen sprechen auch stets Therapiekosten an und vermitteln, dass bei gleicher Wirksamkeit und ähnlichem Nebenwirkungsprofil das kostengünstigere Medikament eingesetzt werden sollte.
Zusammenfassend haben die EULAR-Empfehlungen für die Behandlung der RA eine weitere Konsolidierung und Erweiterung erfahren. Es ist jedenfalls erwähnenswert, dass viele der früheren Empfehlungen, die teilweise nur gering mit Daten abgesichert waren, durch die neue Datenlage bestätigt und gestärkt wurden, was für die verantwortliche Tätigkeit der Arbeitsgruppe spricht. Es ist jedenfalls auch erfreulich, dass Wissenschafter den sich aus den Diskussionen und Beschlüssen ergebenden Forschungsfragen widmen und damit die Evidenzlage erweitern – die Empfehlungen der EULAR bisher stets bestätigend. Auch im Jahre 2019 wurde eine Reihe von Forschungsfragen aufgeworfen, die hoffentlich erfolgreich aufgearbeitet werden können.