HLA-B27-positive Uveitis – Herausforderung für die Ophthalmologen
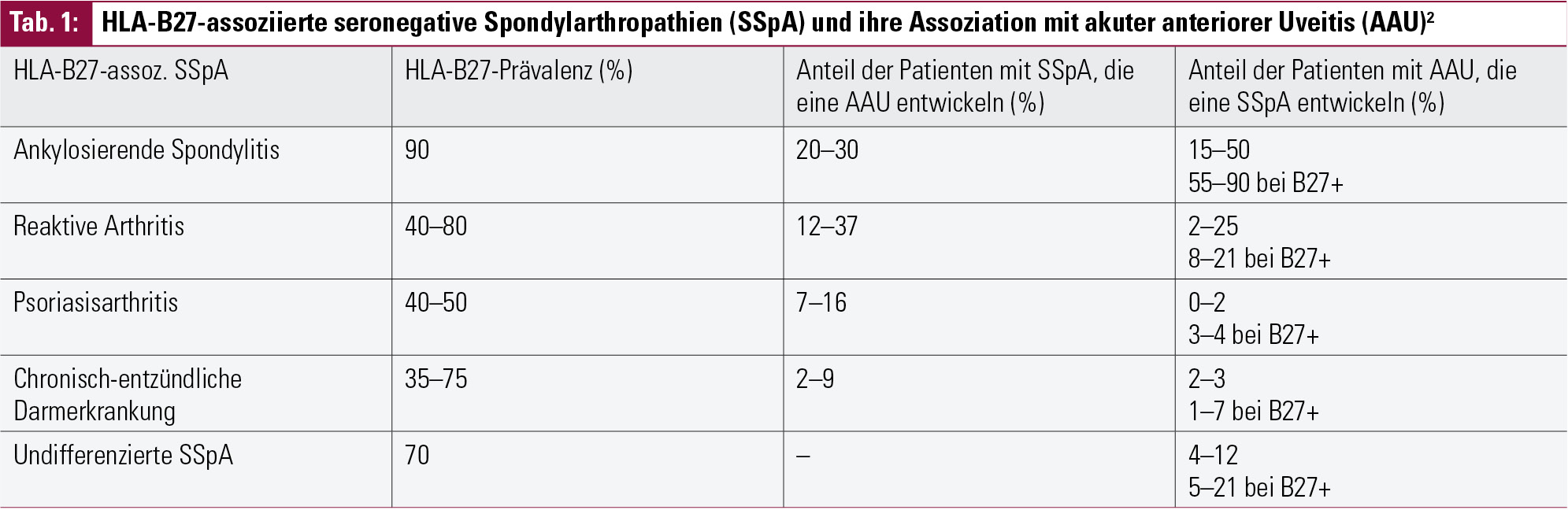
In Europa beträgt die Prävalenz des HLA-B27-Antigens ca. 8–10 %. Generell haben Patienten mit HLA-B27 ein Lebensrisiko von ca. 1–2 %, an einer Uveitis zu erkranken.1 Dieses Risiko steigt jedoch deutlich an, wenn zusätzlich eine SSpA vorliegt: ankylosierende Spondylitis (AS), reaktive Arthritis (ReA), Psoriasisarthritis (PsA), chron. entzündl. Darmerkrankungen („inflammatory bowel disease“, IBD) und undifferenzierte SSpA (Tab. 1).2, 3
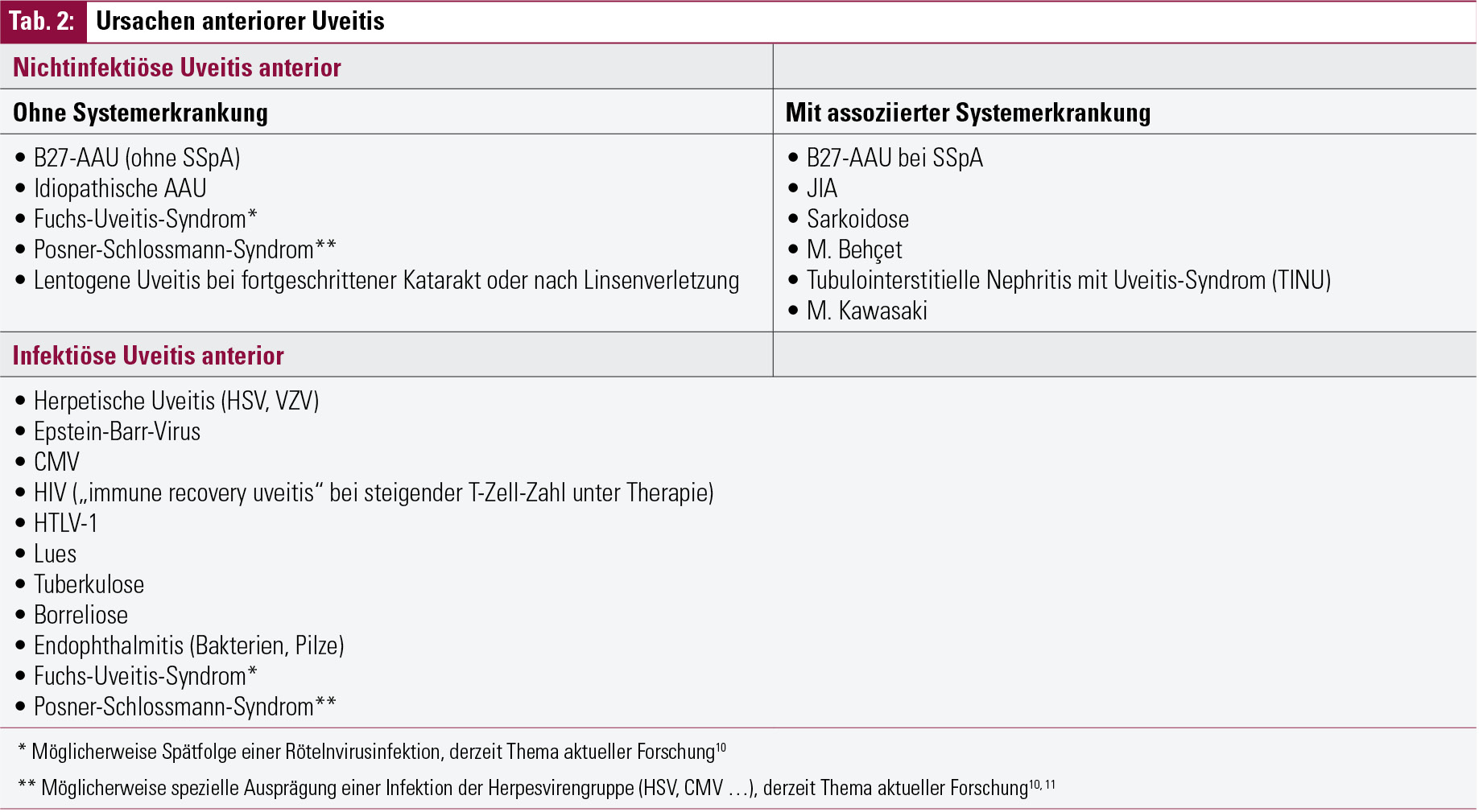
Wenn man das Patientengut mit akuter anteriorer Uveitis (AAU; in älteren Klassifikationen: Iritis oder Iridozyklitis) betrachtet, beträgt die Prävalenz des HLA-B27-Antigens ca. 50 %, wobei die Prozentsätze je nach geographisch-genetischem Hintergrund zwischen 19–88 % schwanken können.4 Die restlichen Fälle von AAU können jedoch andere systemische Erkrankungen oder Infektionen als Ursache haben, daher ist neben einer genauen Spaltlampenuntersuchung und Klassifikation immer auch eine eingehende Anamnese wichtig (Tab. 2). Sowohl für die Ophthalmologen als auch für die oftmals mit der Bitte um „Durchuntersuchung“ konsultierten Rheumatologen ist es wichtig und hilfreich, diese möglichen Differenzialdiagnosen zu kennen. Die Uveitis anterior kann dabei das erste Symptom einer noch unbekannten systemischen Erkrankung darstellen und anderen Manifestationen vorausgehen, oder sie kann das klinische Bild einer Erkrankung vervollständigen und gemeinsam mit früheren, möglicherweise leichteren oder unspezifischen Symptomen die Diagnose festigen.5
Entscheidend: rasches Erkennen
Vor allem für die Ophthalmologen ist die genaue Kenntnis der typischen klinischen Merkmale der B27-AAU wesentlich, da die Therapie möglichst rasch initiiert werden muss, und das Ergebnis einer systemischen Durchuntersuchung dabei in der Regel nicht abgewartet werden kann. Eine der Herausforderungen besteht also darin, dass man es bei einer AAU einerseits mit einer aggressiven Entzündung zu tun hat, die bei suboptimaler Behandlung bleibende Veränderungen hinterlassen kann und daher möglichst rasch intensiv lokal und evtl. systemisch behandelt werden sollte – und andererseits bei Erstmanifestationen nur die genaue Kenntnis möglicher Differenzialdiagnosen diese Therapie auch sicher für die Patienten macht. Würde z. B. eine akute herpetische Uveitis mit subklinisch beginnender Netzhautbeteiligung alleinig mit Steroiden behandelt werden, so könnte diese innerhalb von wenigen Tagen als akute retinale Nekrose einen katastrophalen Verlauf nehmen.
Klinisches Erscheinungsbild
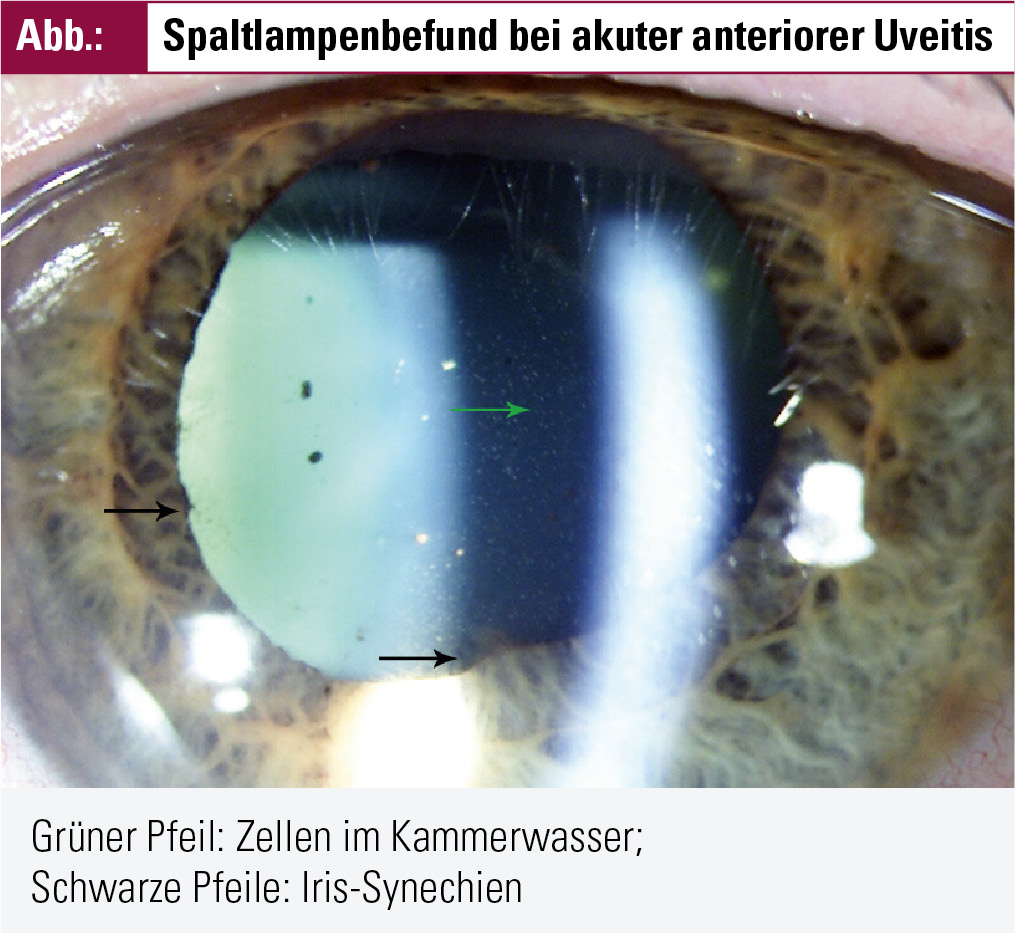
Die typische B27-AAU ist charakterisiert durch akuten Beginn, Lichtempfindlichkeit und tiefe, bohrende Augenschmerzen. Die Betroffenen sind häufiger männlich (m : w = 1,5–2,5 : 1), und bei Erstmanifestation im Mittel zw. 20 und 40 Jahren alt. Meistens ist nur ein Auge betroffen, mit ziliarer Rötung der Bindehaut und deutlicher Reizung im Bereich der Vorderkammer (Abb. 1).
Entzündliche Veränderungen in der Vorderkammer
Die an der Spaltlampe sichtbaren entzündlichen Veränderungen in der Vorderkammer entstehen durch einen Zusammenbruch der Blut-Kammerwasser-Schranke der Blutgefäße im Bereich der Iris und des Ziliarkörpers, dadurch ein Einwandern von Entzündungszellen und einem erhöhten Eiweißgehalt der Kammerwasserflüssigkeit, dem Tyndall-Phänomen. Die Stärke einer Entzündung wird beschrieben von 0,5+ Zellen bis zum Maximum von 4+, welches dann oft gemeinsam mit einem Hypopyon, der Ansammlung von Entzündungszellen am Boden der Vorderkammer, auftritt. Das Tyndall-Phänomen sollte getrennt davon beschrieben werden – von 0,5+ bis 4+ und der Ausbildung von Fibrinwolken. Die getrennte Beschreibung ist deswegen wichtig, weil nur die Zellzahl die Aktivität der AAU widerspiegelt, das Tyndall-Phänomen jedoch auch aus anderen Gründen positiv bleiben kann und daher kein Aktivitäts- und Therapiekriterium per se darstellt.
Durch die erhöhte Viskosität des Kammerwassers und die entzündungsbedingte Verengung der Pupille (Reizmiosis) kann es zu Verklebungen der Iris mit der knapp dahinter liegenden Augenlinse kommen, so genannten Synechien. Sollten sich diese nicht mehr lösen (Zeitfenster für eine effektive Behandlung mit stark pupillenerweiternden Augentropfen: wenige Tage), so werden vereinzelte Synechien für die Funktion des Auges kein Problem darstellen. Multiple Synechien (die so genannte Kleeblattpupille) können jedoch durch das behinderte Pupillenspiel zu Komplikationen wie Sehbeeinträchtigung und/oder erhöhtem Augeninnendruck führen.
Gerade bei der B27-AAU ist der Augendruck manchmal auch zu Beginn der Entzündung verändert, dann jedoch kommt es (durch die akute Entzündung im Bereich des Ziliarkörpers und die dadurch verminderte Kammerwasserproduktion) zu einem Absinken des Augendrucks (Hypotonie). Dieses Phänomen erholt sich rasch unter adäquater Therapie.
Beteiligung der hinteren Augenabschnitte. Bei stärkeren Schüben kann es auch zu einer Beteiligung der hinteren Augenabschnitte kommen: zu entzündlichen Veränderungen im Bereich des Glaskörpers (Vitritis), Papillenschwellung (Papillitis) oder einem zystoiden Netzhautödem (cystoid macular edema; CME).6
Auch bei wiederholtem Auftreten der B27-AAU ist in der Regel immer nur ein Auge betroffen (unilateral), oftmals sogar dieselbe Seite, manchmal ist aber auch ein Wechsel auf die andere Seite möglich. Ein beidseitiges Auftreten ist selten und sollte den behandelnden Arzt in jedem Fall die Diagnose zumindest überdenken lassen. Ausnahmen stellen die IBD oder PsA dar: hier kann die Entzündung auch beidseits, mehr chronisch als in akuten Schüben und mit häufigerer Beteiligung der posterioren Augenabschnitte verlaufen.7, 8
Unter adäquater Therapie klingt die typische B27-AAU innerhalb von 3–6 Wochen ab.
Therapie
Intensive Lokaltherapie
Als Therapie kommt primär eine intensive Lokaltherapie zur Anwendung:
- Lokale Steroide, wobei nur solche sinnvoll sind, welche auch durch die Hornhaut in die Vorderkammer penetrieren können (z. B. Prednisolonazetat 0,5 % bis 1 %). Kombinationspräparate Antibiotikum + Steroid sind ungeeignet! Die Tropffrequenz sollte anfangs hoch sein (je nach Intensität alle 15 Minuten bis stündlich) und erst nach deutlicher klinischer Besserung schrittweise über 3–6 Wochen ausgeschlichen werden. Eine zu niedrige Tropffrequenz oder zu rasche Reduktion verlangsamt die Abheilung und erhöht dadurch das Komplikationsrisiko. Um jene Patienten mit einem Steroid-Responder-Phänomen herauszufiltern (Anstieg des Augendruckes ca. 10–14 Tage nach (!) Beginn der Steroidtherapie), muss der Augendruck unter Steroidtherapie kontrolliert werden. Bei Verdacht auf Steroid-Response muss das Präparat gewechselt werden (z. B. Loteprednoletabonat, Rimexolon).
- Lokale nichtsteroidale Antiphlogistika (z. B. Diclofenac natrium, Ketorolac trometamol, Bromfenac sesquihydrat), 3–4-mal täglich.
- Lokale Mydriatika/Zykloplegika (z. B. Scopolamin, Zyklopentolat), 3-mal täglich.
Erweitert werden kann diese Therapie durch die Gabe von Steroiden lokal (unter die Bindehaut oder peribulbär; z. B. Prednisolonhemisuccinat, seltener Triamcinolonacetonid) oder systemisch (z. B. Prednisolonhemisuccinat i. v., Methylprednisolon oder Prednisolon oral).
Immunmodulierende Therapie
Einschlägige Literatur empfiehlt eine immunmodulierende Therapie bei rein okulärer Problematik erst bei mehr als 3 Entzündungsschüben pro Jahr.
Studien konnten die effektive Wirkung von Sulfasalazin bei reiner B27-AAU ohne axiale SSPA bestätigen.4 Ebenfalls bestehen Erfahrungen über die Wirksamkeit von Methotrexat, Azathioprin und Zyklosporin A.4 Infliximab könnte in der Behandlung der therapieresistenten oder das Augenlicht bedrohenden B27-AAU als Komanifestation bei Patienten mit SSpA eine Rolle spielen, aufgrund der hohen Kosten, des erheblichen Aufwandes und des Risikoprofils jedoch nicht bei isolierter B27-AAU ohne Systembeteiligung. Bei subkutan applizierten Anti-TNFα-Blockern scheint Adalimumab eine bessere Wirkung auf die B27-AAU aufzuweisen als Etanercept.4 Die Effizienz weiterer Biologika in Bezug auf die B27-AAU muss in laufenden Studien erst gezeigt werden.9
Nachdem immunmodulierende Therapien einer genauen internistischen Vorbereitung und Betreuung bedürfen, ist in jedem Fall eine Kobetreuung zwischen Ophthalmologen und Rheumatologen sinnvoll. Auch wenn Ophthalmologen mit Spezialkenntnis auf dem Gebiet der Uveitis die gängigen Medikationsmöglichkeiten kennen, so ist doch die Rheumatologie mit ihrem internistischen Fachwissen über Kontraindikationen und Komplikationen für die Betreuung der Patienten unersetzlich.9 Probleme in der Zusammenarbeit verursachen hier oft jene Patienten, die zwar aber aufgrund der Schubfrequenz oder Heftigkeit ihrer Augenerkrankung eine systemische Basistherapie benötigen, die Rheumatologen aufgrund fehlender oder nur gering ausgeprägter Systemerkrankung und daher auch fehlender Entzündungsaktivität in humoral messbaren Parametern (die Uveitis per se verursacht keine „erhöhten Entzündungswerte“) keinen unbedingten Handlungsbedarf sehen. Hier kann die vertrauensvolle Zusammenarbeit zwischen Rheumatologen und Ophthalmologen die zukünftige Patientenkarriere entscheidend beeinflussen.