Hype oder ungeahntes Potenzial? Mamma-Diagnostik und KI
Um KI dazu zu „trainieren“, Krankheiten verlässlich zu detektieren, müssen allerdings strukturierte Daten in großer Zahl über einen möglichst langen Zeitraum zur Verfügung stehen – wie es beispielsweise im Rahmen der All of US-Kohortenstudie des US-amerikanischen National Institute of Health (NIH) der Fall sein wird. In dieser Studie wird eine Million Menschen, auf freiwilliger Basis, über viele Jahre hinweg begleitet und ihr Gesundheitszustand, ihre Umwelt und ihr Lebensstil laufend registriert. Die stete eigenständige („un-supervised“) Weiterentwicklung des KI-Algorithmus beruht auf der Nutzung immer wieder neuer Patientendaten (sog. deep learning), es handelt sich also um ein sich ständig veränderndes, „denkendes“ System.
KI spielt in der Mamma-Diagnostik bereits eine Rolle
In der Radiologie gibt es mittlerweile Erfahrungen, die das Einspeisen immer neuer Untersuchungsalgorithmen in Kliniksysteme mit vergleichsweise wenig Aufwand erlauben.
Zwei Bereiche, in denen KI in diesem Kontext hilfreich sein könnte:
- Brustkrebs-Screening: Mittels KI können unauffällige Mammografien herausgefiltert werden. Der Radiologie bewertet nur die, die eine Auffälligkeit aufweisen, und entscheidet, ob sie einer weiteren Abklärung bedürfen. Die Effizienz kann somit gesteigert werden, ohne Krebserkrankungen zu übersehen.
- Zum anderen könnte KI auch im Rahmen von Verlaufskontrolle bzw. Risikostratifizierung nützlich sein.
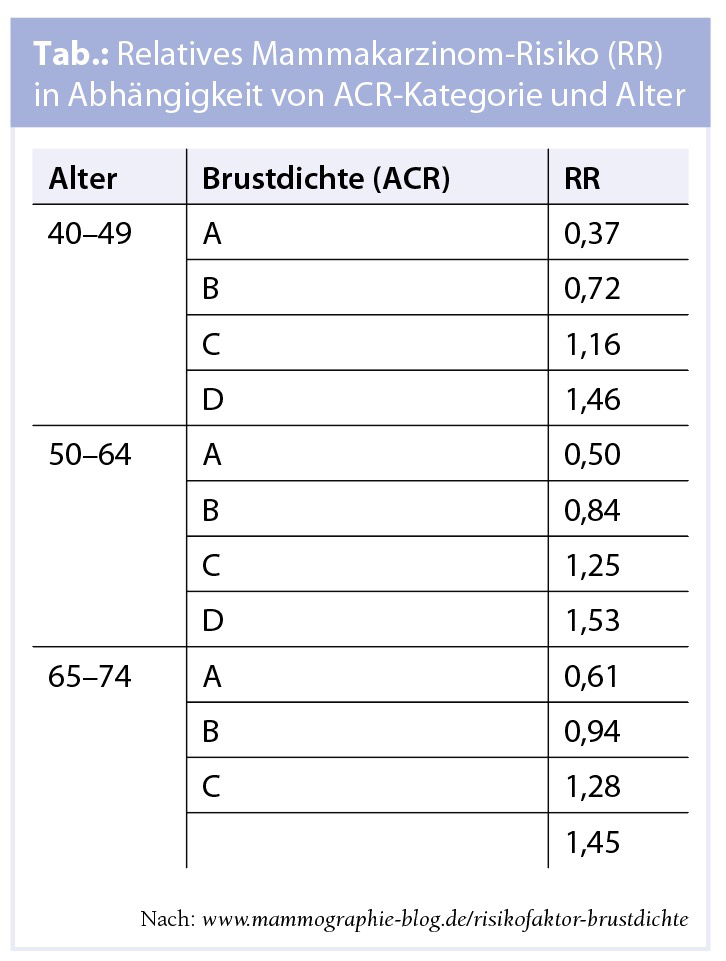
BI-RADS™ und ACR: BI-RADS™ (Breast Imaging Reporting and Data System) und ACR sind Kategorien zum leichteren Verständnis der Mammografiebefunde. Das American College of Radiology (ACR) hat eine subjektive Einstufung der mammografischen Befunde in 7 Kategorien – von unauffällig bis hoch verdächtig – vorgenommen (BI-RADSTM 0–6). Die 4-stufige, ebenfalls subjektive ACR-Einteilung (A–D) nimmt Bezug auf die Parenchymdichte der Brust und gibt im Übrigen, da die Sensitivität in den ACR-Kategorien C und D erniedrigt ist, wichtige Hinweise auf die Zuverlässigkeit der mammografischen Diagnostik. Die Sensitivität der Brustkrebsdetektion nimmt mit dem ACR-Grad ab, wobei erschwerend dazu kommt, dass mit zunehmender Brustdichte das Risiko, an Brustkrebs zu erkranken, steigt (dichtere Brust = höheres Mammakarzinomrisiko [Tab.]).
Da im Übrigen bei der ACR-Beurteilung nicht unwesentliche Interobserver-Differenzen zwischen verschiedenen Befundern bestehen, sind KI-gestützte, standardisierte und automatisierte Brustdichtemessungen wie z. B. Volpara® und Quantra™ klinisch hilfreich.
Tatsächlich gibt es seit Längerem außerdem Bestrebungen, einen Algorithmus zu entwickeln, der anzeigt, wann eine Untersuchung durch eine weitere diagnostische Modalität (z. B. Ultraschall, MRT, Tomosynthese) ergänzt werden sollte. Die Integration von KI kann die Auswertung von Bildmaterial also verbessern, beschleunigen bzw. übernehmen und ist oft bereits unentbehrlich geworden.
Radiogenomics: nächste Generation der Bildgebung
„Omics-Strategien“ (Genomics, Transcriptomics, Proteomics, Metabolomics) haben viele potenzielle Anwendungsgebiete innerhalb der Onkologie und könnten das Verständnis bzgl. Krebsentstehung und Progression signifikant verbessern; durch die Kombination von „Omics-Strategien“ lassen sich große Datenmengen verschiedenster biologischer Informationen schnell auswerten und neue sinnvolle Biomarker entwickeln. Fortschritte in Bildgebungs- und Bildanalysemethoden sowie die Entwicklung von Techniken zur Extraktion verschiedenster Bildgebungsparameter haben die nächste Generation der Bildgebung bereits eingeläutet. Die Integration von Bildgebung und KI in das „Omics“-Konzept (Radiomics) und die Kombination mit molekularen Markern (Radiogenomics) ermöglicht eine non-invasive Erfassung von Bildgebungscharakteristika (Phänotypen) und Korrelationen mit Genexpressionsmustern, Genmutationen und weiteren genomassoziierten Eigenschaften. Radiogenomics ist die Evolution der Korrelation von Radiologie und Pathologie von der anatomisch-histologischen Ebene hin zur molekularen.
Es handelt sich dabei um ist ein sich rapide entwickelndes Forschungsfeld mit vielversprechenden ersten Ergebnissen in Bezug auf Risikoabschätzung, Klassifizierung von Läsionen, Therapieansprechen, Vorliegen von Metastasen und molekularem Profiling. Sehr geehrte Frau Kollegin, sehr geehrter Herr Kollege, die Medizinische Universität Wien hat die medizinische Bildgebung (Medical Imaging) als einen von fünf Forschungsschwerpunkten definiert. Diese Entscheidung beruht auf der bereits vorhandenen, besonderen Expertise in bildgebenden Techniken und in deren breiter Anwendung.
- McKinney S. M. et al: International evaluation of an AI system for breast cancer screening. Nature 2020; 577 (7788): 89–94
- Pinker K., Chin J., Melsaether A.N., Morris E.A., Moy L.: Precision Medicine and Radiogenomics in Breast Cancer: New Approaches toward Diagnosis and Treatment. Radiology. 2018 Jun; 287 (3): 732–747. doi: 10.1148/radiol.2018172171. Review. PubMed PMID: 29782246