Zervixkarzinom-Früherkennung – die neuen Abklärungs-Algorithmen
Zur Erinnerung: Die Österreichische Gesellschaft für Zytologie (ÖGZ) hat in Zusammenarbeit mit der österreichischen Gesellschaft für Pathologie (ÖGPath) und Österreichischen Gesellschaft für Gynäkologie und Geburtshilfe (OEGGG) eine neue Nomenklatur erarbeitet (Regitnig et al., 2017), die sich an den neuen Klassifikationen der WHO 2014 der Neoplasien des weiblichen Genitaltraktes (Kurman R.J. et al., IARC Press WHO 2014; deutschsprachige Darstellung: Reich O. et al., 2015) und der Bethesda-Klassifikation 2015 für die Befunderstellung in der gynäkologischen Zytologie (Nayar R. et al., 2015) orientiert. Die WHO-Klassifikation fasst morphologische HPV-Veränderungen und die ehemalige zervikale intraepitheliale Neoplasie Grad 1 (CIN 1) zur niedriggradigen intraepithelialen plattenzelligen Läsionen (LSIL) und die ehemaligen zervikalen intraepithelialen Neoplasien Grad 2 und 3 (CIN 2 und CIN 3) zu hochgradigen intraepithelialen plattenzelligen Neoplasien (HSIL) zusammen.
Diese Nomenklatur wurde im vergangenen Jahr in unseren Heften ausführlich dargestellt und von namhaften Repräsentanten der einschlägigen Fachgesellschaften kommentiert (Regitnig P. et al., GYN-AKTIV 1/2018; Kohlberger P. et al., GYN-AKTIV 1/2018; Pokieser W., GYN-AKTIV 5/2018).
Kurz ein Resümee der wichtigsten Neuerungen der Pap-Einteilung: HPV-assoziierte Zellveränderungen (Koilozyten, Dyskeratozyten) gehören nun zur Gruppe Pap IIID/LSIL, da eine sichere morphologische Unterscheidung zwischen High-Risk- und Low-Risk-HPV nicht möglich ist – vormals als Pap II mit HPV-assoziierten Veränderungen klassifizierte zytologische Befunde werden nun als Pap IIID befundet, eine Zunahme an Pap-IIID/LSIL-Diagnosen ist deshalb zu erwarten. Hier kommt der HPV-Typisierung in Zukunft eine besondere Bedeutung zu. Weiters kann das unklare Zellbild (Pap III) auch Zellen enthalten, die morphologisch eine HSIL sein können. Dies wird verbal im Diagnosetext vermerkt, ist aber eine sehr seltene Diagnose.
Die modifizierte Pap-Kategorisierung erforderte auch eine Überarbeitung und Anpassung der OEGGG-Leitlinien 2015 zum Abklärungsprozedere nach auffälligen zytologischen Befunden.
Wir haben die Mitautorin und OEGGG-Präsidentin Univ.-Prof. Dr. Petra Kohlberger um eine resümierende Darstellung gebeten.
Univ.-Prof. Dr. Petra Kohlberger: Nachdem die ÖGZ (Österreichische Gesellschaft für Zytologie) mit 1. 1. 2018 die zytologische Nomenklatur überarbeitet und an das international etablierte Bethesda-System (3. Auflage, 2015) und die WHO-Klassifikation (4. Auflage, 2014) angelehnt hatte – in Zusammenarbeit mit Vertretern der ÖGZ, der ÖGPath und der OEGGG/AGO Austria –, mussten seitens der OEGGG konsequenterweise auch die bis jetzt in Österreich gültigen Empfehlungen der Vorgehensweise zur Diagnose und Therapie von CIN sowie Vorgangsweise bei zytologischen Befunden mit eingeschränkter Qualität angepasst werden. Eine komplette Übernahme der S3-Leitlinie „Prävention des Zervixkarzinoms“ ist aufgrund der in Deutschland geltenden München-III-Nomenklatur der gynäkologischen Zytologie für Österreich nicht möglich und daher ergab sich die Notwendigkeit des Verfassens einer eigenen Leitlinie.
Die OEGGG hat in Zusammenarbeit mit repräsentativen Vertretern sowohl der ÖGZ (Österreichischen Gesellschaft für Zytologie), der AGO Austria (Arbeitsgemeinschaft Gynäkologische Onkologie Österreich), der AGK (Arbeitsgemeinschaft Kolposkopie) als auch der niedergelassenen Frauenärzte – nach eingehender Analyse der aktuellen Literatur und insgesamt drei Sitzungen mit zahlreichen fernmündlichen Abstimmungen – einen Konsens der Inhalte erarbeitet. Die Erstellung dieser Leitlinie erfolgte unter besonderer Berücksichtigung der bisherigen Empfehlungen (letzte Erstellung 2015) und den Empfehlungen in der S3-Leitlinie „Prävention des Zervixkarzinoms“.
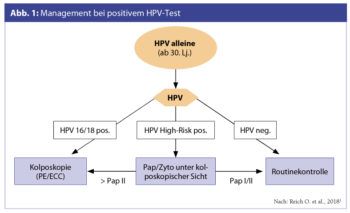
Neben den Grundpfeilern der Inspektion und Kolposkopie, Abnahme der konventionellen Zytologie und Histologie ist die HPV-Testung von entscheidender Relevanz, da eine persistierende Infektion mit humanen Papillomaviren der Hochrisikogruppe (HPV High-Risk) eine notwendige Voraussetzung für die Entwicklung des Zervixkarzinoms und seiner Vorstufen darstellt (Walboomers J.M. et al., 1999; Bosch F.X. et al., 2002). Ausgenommen sind nur wenige seltene Subtypen des Adenokarzinoms der Zervix (Holl K.et al., 2015). Zwischen initialer HPV-Infektion und invasivem Karzinom wird eine Latenz von mehreren Jahren angenommen. Daraus ergibt sich, dass ein negativer Test auf HPV High-Risk einen hohen negativen Vorhersagewert hat; das Vorliegen behandlungsbedürftiger zervikaler Dysplasien kann über einen längeren Zeitraum weitgehend ausgeschlossen werden. Eine subtypenspezifische HPV-Testung (HPV-Typen 16 und 18) liefert zusätzliche prädiktive und prognostische Informationen. Die Untersuchung nach HPV-Niedrigrisikostämmen (HPV Low-Risk) liefert keine relevante Information und soll nicht durchgeführt werden.
Im Rahmen des derzeit bestehenden opportunistischen Zervixkarzinom-Vorsorgeprogramms soll Frauen ab dem 30. Lebensjahr zumindest alle 3 Jahre ein validierter HPV-Test empfohlen werden. Dies gilt für HPV-geimpfte und nicht HPV-geimpfte Frauen. Dabei soll eine routinemäßige Ko-Testung vermieden werden, alternierend können beide Verfahren eingesetzt werden (OEGGG-Positionspapier HPV; S3-Leitlinie Prävention Zervixkarzinom).
Weltweit ist eine Vielzahl von Tests für den Nachweis von HPV-High-Risk-Typen verfügbar. Da HPV-Tests in Europa bisher keiner standardisierten Qualitätskontrolle unterliegen, sollten in der klinischen Routine ausschließlich Tests Anwendung finden, die den international akzeptierten Konsortialkriterien nach Meijer und Stoler entsprechen (Meijer C.J. et al., 2009; Stoler M.H. et al., 2007; Arbyn M. et al., 2015) (siehe Tab.).
Zu auffälligen zytologischen Befunden kommt es sowohl bei einem primären zytologischen als auch bei einem primären HPV-basierten Zervixkarzinomsrceening mit zytologischer Triage.
Diese Leitlinie soll zu einer Vereinheitlichung und Standardisierung des Managements führen, eine Unter- oder Übertherapie sollen verhindert werden. Eine Leitlinien-gerechte Abklärung senkt die Anzahl an Konisationen und verhindert eine Verzögerung in der Diagnostik. Frauen mit zytologischen Auffälligkeiten und mit persistierenden onkogenen HPV-Infektionen benötigen eine differenzialdiagnostische Abklärung und eine kolposkopische Untersuchung.
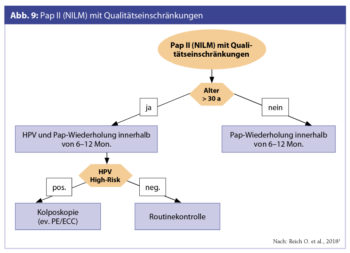
Hochgradige zytologische Läsionen sollten sofort abgeklärt werden, während für grenzwertige und niedriggradige Läsionen mehrere Optionen in Betracht kommen. Die einfache Wiederholung des zytologischen Abstrichs ohne Kolposkopie und ohne HPV-Status (> 30 a) wird nicht empfohlen und stellt in keinem Fall eine geeignete Maßnahme zur Abklärung dar. Laut Österreichischem Impfplan ist die HPV-Impfung bei allen Frauen bis 45 a empfohlen, bei HPV-geimpften Frauen ab 30 a ist die primäre HPV-Testung zu bevorzugen (Joura E. et al., NE
JM 2015). Aus forensischen Gründen wird geraten, ein Abweichen von der vorliegenden Leitlinie zu begründen und zu dokumentieren.
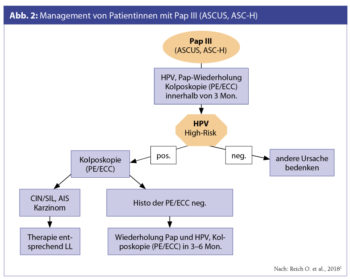
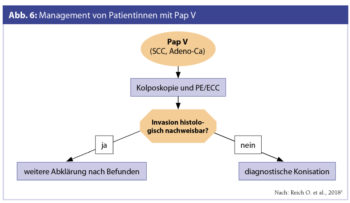
Für die Abklärung eines Pap III wird in Österreich primär der HPV-Test empfohlen. Patientinnen mit nachgewiesener HPV-High-Risk-Infektion sollen umgehend mittels Kolposkopie und Histologie abgeklärt werden. Bei Frauen mit Pap III und bestehender Entzündung und/oder Atrophie kann vor der Wiederholung der Zytologie und vor einer histologischen Abklärung eine Östrogenaufhellung und/oder Kolpitistherapie erfolgen.
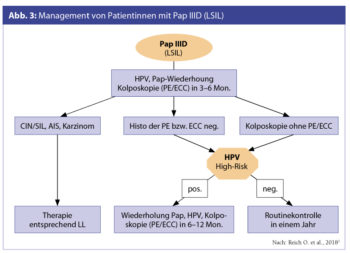
Bei der Abklärung eines Pap IIID ist zu beachten, dass der HPV-High-Risk-Nachweis eine höhere Sensitivität für HSIL+ (CIN 3+) als die wiederholte Zytologie besitzt (S3-Leitlinie Prävention des Zervixkarzinoms 2017). Bei Pap IIIG und HPV-High-Risk-Positivität soll bei negativer Histologie frühzeitig eine Indikation zur diagnostischen Konisation gestellt werden.
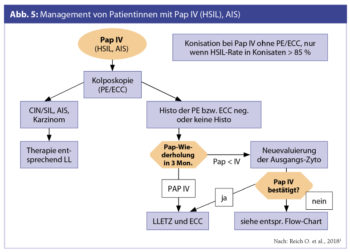
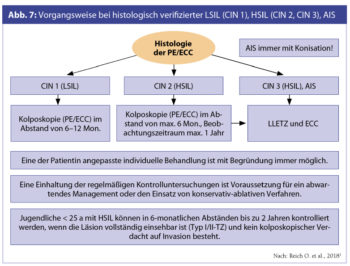
Zur Vorgangsweise bei histologisch verifizierter LSIL (CIN 1), HSIL (CIN 2, CIN 3), AIS bietet die Leitlinie detaillierte Empfehlungen hinsichtlich der Resektion, Oberflächendestruktion und des weiteren Vorgehens nach Konisation.
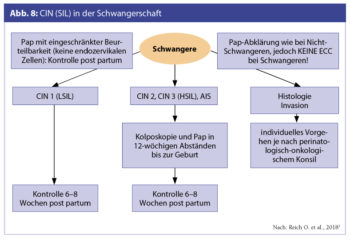
Bei Frauen mit Kinderwunsch sollte im Gespräch mit dem befundenden Pathologen möglichst HSIL/CIN 2 von HSIL/CIN3 unterschieden werden, um die Möglichkeit der Regression einer CIN 2 abzuwarten zu können und spätere geburtshilfliche Komplikationen nach Konisationen zu vermeiden (Tainio K. et al., BMJ 2018). In der Schwangerschaft kann eine Biopsie ohne Gefahr durchgeführt werden und sollte bei unklarem kolposkopischem Befund bei Verdacht auf Invasion eingesetzt werden. Die Durchführung einer endozervikalen Kürettage ist in der Schwangerschaft kontraindiziert.
Eine chirurgische Therapie in der Schwangerschaft bleibt Einzelfällen vorbehalten und sollte nur bei hochgradigem Verdacht auf Invasion in spezialisierten Zentren durchgeführt werden (Abb. 8).
Der überarbeitete Abklärungsalgorithmus wurde positiv von der Kollegenschaft begrüßt und wird bereits flächendeckend angewendet.
Die Zunahme der Pap-IIID-Befunde wurde bereits in der täglichen Praxis bemerkt und die Leitlinie bietet einen guten Rahmen für die effiziente und korrekte Abklärung.
Ich bin sehr stolz, dass es uns gelungen ist, fächerübergreifend einen Konsens herzustellen, und möchte mich bei dieser Gelegenheit nochmals bei meinen Mit-Autoren bedanken.