Im Folgenden wird eine Handlungsempfehlung zur Behandlung von stationären, nicht intensivpflichtigen COVID-19-Patienten wiedergegeben. Sie umfasst aktuelle Hinweise aus der Literatur und praktische Beobachtungen der Autoren. Ärzte aus unterschiedlichen Fachbereichen sind mittlerweile mit der Behandlung von COVID-19-Patienten konfrontiert. Für verschiedene Teilaspekte der Erkrankung und ihrer Behandlung gibt es bislang keine hinreichende Evidenzgrundlage. Am aktuellen Wissensstand zu bleiben ist für alle eine große Herausforderung und setzt ein hohes persönliches Engagement voraus. Diese Handlungsempfehlung soll bei therapeutischen Entscheidungen unterstützen.
Hintergrund
Eine Infektion mit SARS-CoV-2 kann zu schweren Komplikationen führen, die erkannt und behandelt werden müssen. Der Zeitpunkt der Hospitalisation ist typischerweise um den siebten Tag nach Symptombeginn notwendig.1 Patienten, die aufgrund von COVID-19 stationär behandelt werden müssen, zeigen unter anderem respiratorische Komplikationen (12 bis 24 % in Form eines ARDS)2, kardiale Komplikationen (7–17 % in Form von Arrhythmien, Acute Cardiac Injury [ACI] und Schock)3 und thrombotische Komplikationen (16 % in Form von Thromboembolie oder Beinvenenthrombose)4.
Stationäre Versorgung
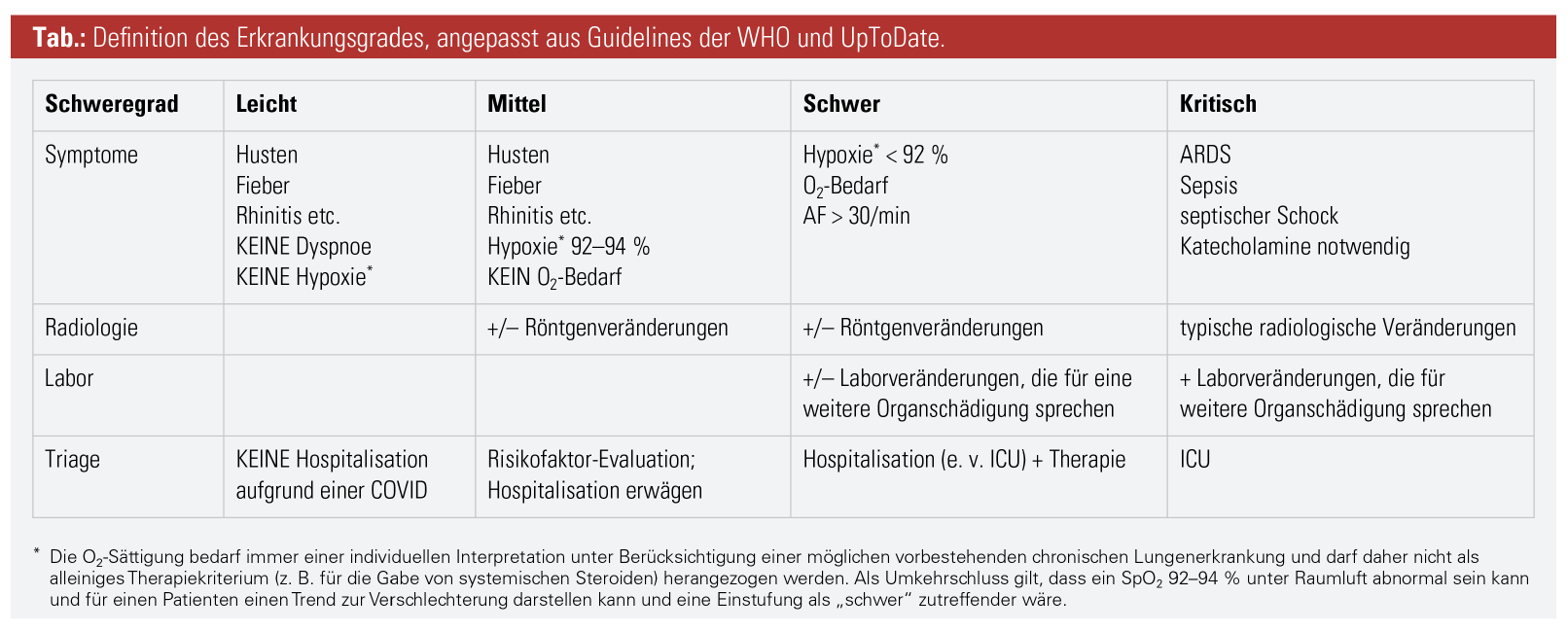
Die Beurteilung des Erkrankungsgrades (Tab.) ist wichtig, um entsprechende Maßnahmen zum richtigen Zeitpunkt setzen zu können, und sollte täglich erfolgen. Neben der wichtigen klinischen Einschätzung werden regelmäßige (ev. sogar tägliche) Laborkontrollen empfohlen. Daraus ergibt sich folgende Empfehlung für den täglichen stationären Ablauf:
- regelmäßige laborchemische Kontrollen (ergänzend zu Routineuntersuchungen: Interleukin-6, Procalcitonin, D-Dimer, Fibrinogen, Prothrombinzeit, Thrombozyten, LDH, NT-pro-BNP, Troponin T, CPK)
- SpO2 mehrmals täglich (mind. 3-mal)
- respiratorische Erschöpfung rechtzeitig erkennen: Atemfrequenz, Atemarbeit, Atemmechanik, Sprechdyspnoe?
- arterielle BGA (obligat bei O2 > 5 l/min und SpO2 < 90 % oder v. a. Minderperfusion [Rekap-Zeit > 2 sek], bei respiratorischen Erschöpfungszeichen)
Medikamentöse Behandlung der schweren COVID-19
Die medikamentöse Therapieempfehlung setzt sich aus verschiedenen Guidelines (u. a. UpToDate und WHO), aktueller Literatur und Expertenmeinungen (u. a. European Respiratory Journal; ÖGARI-Arbeitsgruppe für perioperative Gerinnung) zusammen. Im Zentrum der Behandlung steht Dexamethason, Remdesivir und Rekonvaleszenten-Plasma.
Dexamethason
Es hat sich gezeigt, dass Dexamethason und Hydrokortison zu einer Mortalitätsreduktion unabhängig von Geschlecht und der Symptomdauer bei älteren, jüngeren, beatmeten und nichtbeatmeten Patienten führt.5 Damit ist Dexamethason das bislang einzige Medikament, mit dem eine Reduktion der Sterblichkeit bei COVID-Patienten gezeigt werden konnte.
Indikation
– jeder hospitalisierte Patient mit O2-Bedarf
Dosierung und Verabreichung
– 6 mg 1-mal täglich für maximal 10 Tage oder bis zur Entlassung (falls < 10 d)
– andere Glukokortikoide in äquivalenter Dosis: Hydrokortison 150 mg/d, Methylprednisolone 32 mg/d, oder Prednisolon 40 mg/d
Anmerkung
CAVE: Blutzuckerspiegel
Remdesivir (Veklury®)
Seit Juli 2020 besteht eine Zulassung der EU für Remdesivir zur Behandlung von sauerstoffpflichtigen COVID-19-Pneumonien ab dem 12. Lebensjahr.6 Es gibt Hinweise für eine Verkürzung der Krankheitsdauer und des Spitalaufenthaltes. Der Zeitpunkt (möglichst früh) und eine hohe Viruslast scheinen einen Einfluss auf die positive Wirksamkeit zu haben.7 Laut den WHO-Guidelines (November 2020) besteht keine Empfehlung mehr für den Gebrauch, die Evidenzlage ist jedoch niedrig und genaue Subgruppenanalysen fehlen.8 Da Remdesivir nur begrenzt zur Verfügung steht, muss der Einsatz selektiv erfolgen.
Indikation
– stationärer Patient innerhalb der ersten 10 Symptomtage (CT-Wert in der PCR < 30)
– Alter ≥ 65 Jahre und
– Risikofaktoren (mind. 1): arterielle Hypertonie, Diabetes mellitus Typ I oder Typ II, chronische vorbestehende Lungenerkrankung, Adipositas, vorbestehende Herz-Kreislauf-Erkrankung, aktive Krebserkrankung, Immunsuppression und/oder Chemotherapie
– jüngere Patienten mit Risikofaktoren bzw. „fitte“ ältere Patienten nach interner Fallbesprechung
Dosierung und Verabreichung
– Loading-Dose 200 mg i. v. Tag 1, gefolgt von 100 mg i. v. Tag 2–5
Anmerkung
keine Gabe bei GFR < 30 ml/min/1,73m2
Rekonvaleszenten-Plasma
Abseits von klinischen Studien stellt der Einsatz von Rekonvaleszenten-Plasma einen „Off-Label-Use“ dar. Es gibt Hinweise auf einen Mortalitätsvorteil, in Abhängigkeit vom Zeitpunkt der Verabreichung (möglichst früh), dem Antikörpertiter im Substrat (möglichst hoch) und der Fähigkeit des Empfängers, Antikörper zu bilden.9 Ein Cochrane-Review (Oktober 2020, 19 Studien) beschreibt einen „unsicheren“ Überlebensvorteil.10 Bei vielen Studien bestehen allerdings noch methodische Limitationen.
Indikation
– Patienten mit Risikofaktoren, insbesondere mit vorbestehender Immunsuppression
– Gabe möglichst frühzeitig im Krankheitsverlauf
Dosierung und Verabreichung
200 ml alle 12 h, insgesamt 3 Gaben
Anmerkung
– Off-Label-Use
– Der Transfusionsstandard von Blutprodukten ist zu beachten.
Behandlung der bakteriellen Superinfektion (empirische Therapie)
Eine bakterielle Superinfektion ist möglich, aber im Rahmen einer COVID-19-Erkrankung nicht typisch. Ein erhöhtes Interleukin-(IL-)6 und Procalcitonin (PCT) können hinweisend sein, sind aber nicht immer mit einer bakteriellen Superinfektion assoziiert.1 Besteht der klinische Verdacht, soll eine antibiotische Therapie begonnen werden.
Indikation
– klinischer und laborchemischer (IL-6, PCT) Verdacht auf eine bakterielle Super-infektion
Dosierung und Verabreichung
– Patient < 48 h hospitalisiert, keine respiratorischen Vorerkrankungen: Ampicillin/Sulbactam 3-mal 3 g tgl. oder angepasst an die Nierenfunktion
– Patient > 48 h hospitalisiert und respiratorische Vorerkrankung (z. B. COPD): Piperacillin/Tazobactam 4-mal 4,5 g tgl. oder angepasst an die Nierenfunktion
– Patient mit Penicillinallergie: Moxifloxacin (Avelox) 1-mal 400 mg p. o. tgl.
Anmerkung
– Sputumkultur und Blutkultur vor Beginn einer antibiotischen Therapie
– Harnantigen auf Legionellen
– Adaptierung der antibiotischen Therapie nach Erhalt einer pos. Kultur, ggf. auch entsprechende Deeskalation, bei Bedarf Rücksprache mit Mikrobiologie
Behandlung des erhöhten Thromboserisikos
Mehrere Faktoren führen zu einer erhöhten Thromboseneigung. Post-mortem-Studien zeigen unter anderem Endothelschäden, Stase bei Immobilisation und eine entzündliche Hyperkoagulabilität.11–13 Es gibt Hinweise, dass die geläufige Thromboseprophylaxe mit NMWH 1-mal täglich nicht ausreichend vor thrombotischen Komplikationen schützt.14 D-Dimer und Fibrinogen stellen nützliche Risikomarker dar und sind assoziiert mit einem schweren Krankheitsverlauf und gesteigerter Mortalität.15 Randomisierte klinische Studien zur Thromboseprophylaxe bei COVID-19-Patienten sind noch ausstehend. Empfehlungen stammen daher von Expertengremien und Expertenmeinungen.16 Aus oben genannten Gründen kann eine subtherapeutische Antikoagulation mit NMWH in halbtherapeutischer Dosis (z. B. Enoxaparin 0,5 mg/kg KG 2-mal täglich) verabreicht w
erden. Von manchen Zentren wird eine Vollantikoagulation mit NMWH ab einer D-Dimer-Erhöhung über das 6-Fache der oberen Norm (z. B. D-Dimer > 3 mg/dl, [Ref.: ≤ 0,5mg/dl]) durchgeführt. Auch hierfür fehlen noch klinische Studien.
Indikation
– alle hospitalisierten Patienten mit COVID-19 (ausgenommen Patienten mit Kontraindikationen, z. B. aktive Blutung oder relevante Blutung 24–48 h zuvor; vorangegangene HIT etc.)
Dosierung und Verabreichung
LMWH – z. B. Enoxaparin 0,5 mg/kg KG 2-mal täglich, unter Berücksichtigung der Nierenfunktion
Anmerkung
Gründe zur Fortsetzung der Thromboseprophylaxe nach Entlassung: vorzeitige Entlassung bei Bettenknappheit, Entlassung in eine Rehabilitationseinrichtung, Patienten mit zusätzlichen Risikofaktoren für eine Thromboembolie (starkes Übergewicht, bekannte Thrombophilie, vorangegangene Thromboembolien etc.)17
Management der chronischen Medikation
ACE-Hemmer/ARBs sollen bei Patienten mit COVID-19 weitergegeben werden, außer es gibt andere Gründe, sie zu pausieren (z. B. Hypotonie, akuter Nierenschaden etc.). Es gibt weder Evidenz, dass ACE-Hemmer bei SARS-CoV-2-Infektionen eine Verschlechterung der Erkrankung verursachen, noch dass sie begünstigend wirken.18 SGLT-2-Blocker sollten generell in akuten Erkrankungssituationen pausiert werden (Sick Day Rule). Metformin sollte in Situationen mit Verschlechterung der Nierenfunktion und/oder hämodynamischer Verschlechterung pausiert werden. GLP-1-Analoga sollten in Akutsituationen nicht gegeben werden (bei bereits länger bestehendem Gebrauch ist das Medikament über mehrere Wochen systemisch wirksam). Statine (wenn vorbestehend) sollen nicht abgesetzt werden (antiinflammatorischer Effekt). Die Evidenz wächst, dass eine Statintherapie, in Bezug auf die Entwicklung eines schweren COVID-19-Verlaufes, zu einer Risikoreduktion führt.19
Literatur:
- Wang D et al., JAMA 2020; 323(11):1061–9
- Richardson S et al., JAMA 2020; 323(20):2052–9
- Arentz M et al., JAMA 2020; 323(16):1612–4
- Bilaloglu S et al., JAMA 2020; 324(8):799–801
- Sterne JAC et al., JAMA 2020; 324(13):1330
- European Medicines Agency. Veklury (remdesivir). EMA/197268/2020. [Link]. Published 2020
- Beigel JH et al., N Engl J Med 2020; 383(19):1813–26
- Lamontagne F et al., BMJ 2020; 370:m3379
- Salazar E et al., Am J Pathol 2020; 190(11):2290–303
- Piechotta V et al., Cochrane Database Syst Rev 2020; DOI:10.1002/14651858.CD013600.pub2
- Libby P et al. Eur Heart J 2020; 41(32):3038–44
- Magro C et al., Transl Res 2020; 220:1–13
- Ackermann M et al., N Engl J Med 2020; 383(2):120–8
- Klok FA et al., Thromb Res 2020; 191:145–7
- Medcalf RL et al., J Thromb Haemost 2020; DOI:10.1111/jth.14960
- Empfehlung der Arbeitsgruppe Perioperative Gerinnung der ÖGARI zum Thema: Gerinnungsmanagement bei COVID-19; [Link]
- Schünemann HJ et al., Blood Adv 2018; 2(22):3198–225
- Daniels LB et al., Am J Cardiol 2020; 136:149–55
- Bifulco M et al., Eur Hear J Cardiovasc Pharmacother 2020; 6(6):410–1