Publiziert in:
COVID-19-Impfstoffe
Auf einen Blick: Zulassungsstudien zu COVID-19-Impfstoffen
1. März 2021
Aktuell sind in der EU drei COVID-19-Impfstoffe zugelassen. Die Impfstoffe bauen zwar auf unterschiedlichen Technologien auf, haben aber eines gemeinsam: die Auswirkungen der Pandemie zu verringern. Gerade in Zeiten wie diesen ist es umso wichtiger, ausreichend fundierte Informationen zum Impfen zu liefern. Hier sind die drei Zulassungsstudien in kompakter Form zusammengefasst.
Am Österreichischen Impftag 2021, der in diesem Jahr ganz im Zeichen der COVID-19-Impfstoffe stand, berichtete Mag. Daniela Philadelphy, Institut Begutachtung & Analytik, AGES Medizinmarktaufsicht, Wien, über die globale Bedeutung der Pandemie und die Notwendigkeit robuster Daten, welche die Anfordernisse der verschiedenen Zulassungsbehörden weltweit erfüllen müssen. Um grundlegende Prinzipien zum Studiendesign festzulegen, kommt es zur Gründung globaler Initiativen, wobei hier einerseits die Workshops und Berichte der International Coalition of Medicines Regulatory Authorities (ICMRA), aber auch die entsprechenden Empfehlungen auf europäischer Ebene seitens der European Medicines Agency (EMA) zu erwähnen seien. Da es aufgrund der Neuartigkeit der Erkrankung nur limitiertes Wissen zur Korrelation einer Immunität mit Schutz vor Erkrankung gibt und demnach noch kein sogenanntes immunologisches Schutzkorrelat etabliert ist, müssen die Impfstoffe für eine Zulassung in Europa die Wirksamkeit in klinischen Studien nachweisen. „Ein alleiniger Nachweis einer Immunantwort ist aus derzeitiger Sicht nicht ausreichend“, konstatierte Philadelphy. Die Expertin erklärte weiters, das Design der groß angelegten Wirksamkeits- und Sicherheitsstudien basiere primär auf einem Vergleich von symptomatischer, laborbestätigter COVID-19-Erkrankung zwischen Impfstoff und Placebo. „Neben der Wirksamkeit ist eine umfassende Prüfung der Sicherheit im Rahmen der klinischen Studien erforderlich. Eine Zulassung kann nur dann erfolgen, wenn der gezeigte Nutzen die möglichen Risiken überwiegt und ein positives Nutzen-Risiko-Verhältnis vorliegt“, so Philadelphy.
Die zugelassenen Impfstoffe
mRNA-basierte Vakzine
Pfizers und BioNTechs BNT162b2 (Comirnaty®): Mit der bedingten Zulassung von BNT162b2 am 21. 12. 2020 erfolgte nicht nur die erste EU-Zulassung eines Impfstoffes gegen COVID-19, sondern auch die erste Zulassung eines messenger-RNA-(mRNA-)basierten Impfstoffes überhaupt.1 Die bedingte EU-Marktzulassung gilt für die aktive Immunisierung bei Personen ab 16 Jahren, die Verabreichung des Impfstoffes erfolgt nach Verdünnung intramuskulär in einer Impfserie von 2 Dosen (je 0,3 ml). Es wird empfohlen, die zweite Dosis 3 Wochen nach der ersten Dosis zu verabreichen. Personen, die 1 Dosis Comirnaty® erhalten haben, sollten eine zweite Dosis Comirnaty® erhalten, um die Impfserie abzuschließen.2 Die Zulassung basiert auf den Daten einer laufenden randomisierten, beobachterverblindeten, placebokontrollierten Phase-III-Studie:3
- 43.548 Studienteilnehmer im Alter ≥ 16 Jahre
- 1:1-Randomisierung auf je 2 Dosen BNT162b2 oder Placebo
- intramuskuläre Verabreichung im Abstand von 21 Tagen
- medianes Follow-up von 2 Monaten nach verabreichter zweiter Dosis
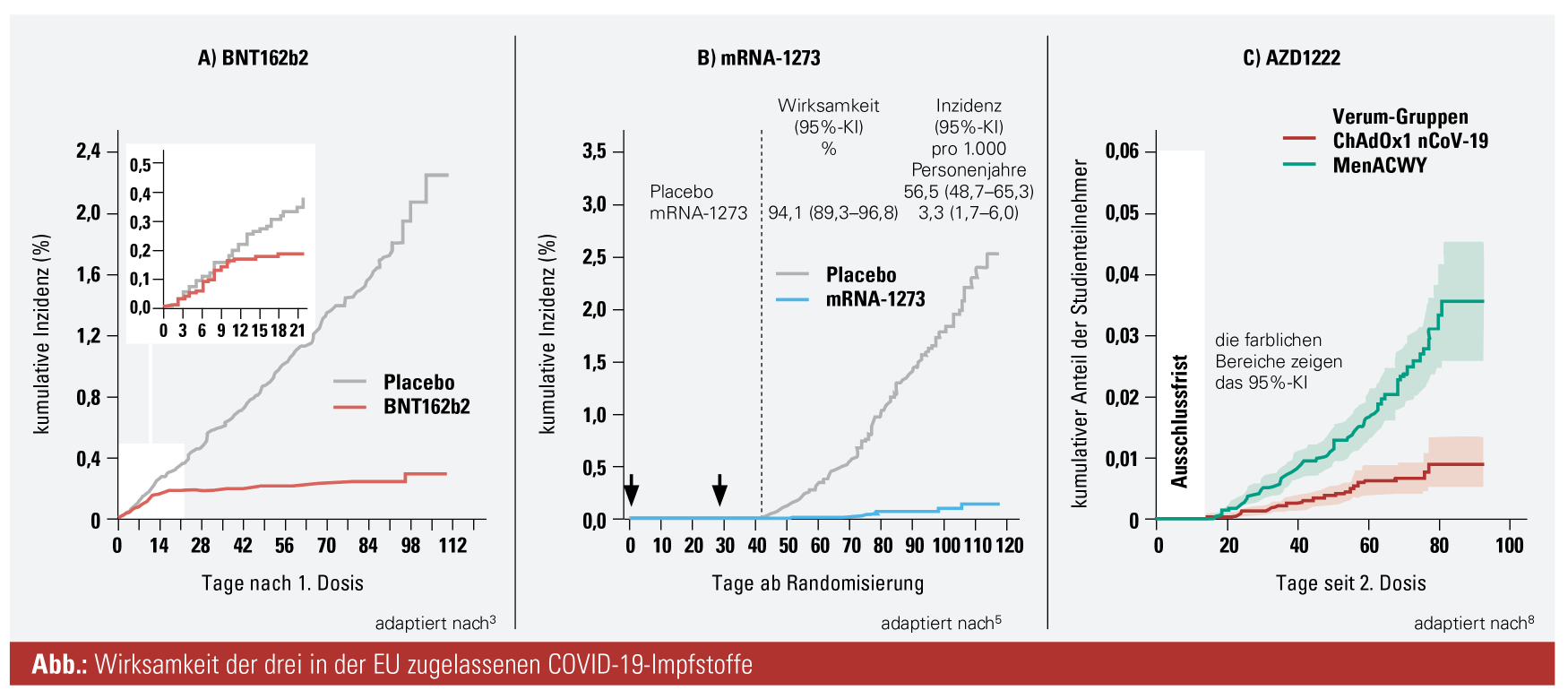
- Wirksamkeit (Abb. A): Impfschutz sieben Tage nach der zweiten Dosis; 95%iger Impfschutz bei Probanden ohne vorherige SARS-CoV-2-Infektion, ähnliche Vakzin-Wirksamkeit innerhalb aller analysierten Subgruppen (stratifiziert nach Alter, Geschlecht, Rasse, ethnischer Zugehörigkeit, BMI und Vorhandensein von Begleiterkrankungen)
- Sicherheit: kurzfristige, leichte bis mittelschwere Schmerzen an der Injektionsstelle, Fatigue, Kopfschmerzen; Inzidenz schwerwiegender unerwünschter Ereignisse niedrig und in der Impfstoff- und Placebogruppe vergleichbar
Moderna Biotechs mRNA-1273 (COVID-19 Vaccine Moderna®): Mit der bedingten Zulassung von mRNA-1273 am 6. 1. 2021 war in der EU der zweite Impfstoff gegen COVID-19 verfügbar. Der Impfstoff basiert wie auch BNT162b2 auf der mRNA-Technologie. Die bedingte EU-Marktzulassung gilt für die aktive Immunisierung bei Personen ab 18 Jahren, die Verabreichung des Impfstoffes erfolgt in zwei Dosen (zu je 0,5 ml). Es wird empfohlen, die zweite Dosis 28 Tage nach der ersten Dosis zu verabreichen. Bei Personen, welche die erste Dosis COVID-19 Vaccine Moderna® erhalten haben, sollte auch die zweite Dosis zum Abschluss der Impfung mit COVID-19 Vaccine Moderna® erfolgen.4 Die Zulassung basiert auf den Daten einer randomisierten, beobachterverblindeten, placebokontrollierten Phase-III-Studie:5
- 30.420 Studienteilnehmer im Alter ≥ 18 Jahre
- 1:1-Randomisierung auf je 2 Dosen mRNA-1273 oder Placebo
- intramuskuläre Verabreichung im Abstand von 28 Tagen
- medianes Follow-up von 2 Monaten nach verabreichter zweiter Dosis
- Wirksamkeit (Abb. B): Impfstoffwirksamkeit von 94,1 %, die mindestens 14 Tage nach der zweiten Dosis auftrat; bei den 18- bis 64-Jährigen relative Risikoreduktion von 95,6 %, bei Probanden ≥ 65 Jahre von 86,4 %
- Sicherheit: höhere Raten an lokalen sowie systemischen Reaktionen unter mRNA-1273 vs. Placebo, die meisten Reaktionen jedoch mild bis moderat und nach 1–3 Tagen verschwunden; niedrige Inzidenz schwerwiegender unerwünschter Ereignisse und in beiden Gruppen vergleichbar
Vektorbasiertes Vakzin
AstraZenecas ChAdOx1 nCoV-19 (AZD1222; COVID-19 Vaccine AstraZeneca®): Mit der rezenten (29. 1. 2021) bedingten Zulassung des vektorbasierten Impfstoffes AZD1222 stehen in der EU aktuell drei Schutzimpfungen gegen eine SARS-CoV-2-Infektion zur Verfügung. Das Präparat ist zur aktiven Immunisierung von Personen ab 18 Jahren indiziert, die Verabreichung des Impfstoffes erfolgt in zwei Dosen (zu je 0,5 ml). Es wird empfohlen, die zweite Dosis zwischen 4 und 12 Wochen nach der ersten Dosis zu verabreichen. Bei Personen, welche die erste Dosis COVID-19 Vaccine AstraZeneca® erhalten haben, sollte auch die zweite Dosis zum Abschluss der Impfung mit COVID-19 Vaccine AstraZeneca® erfolgen.6 Am 31. 1. 2021 empfahl das Nationale Impfgremium in Österreich den Impfstoff jedoch nur für die Gruppe der unter 65-Jährigen. Zwar sei das Vakzin in Bezug auf die Sicherheit unbedenklich, offen sei aber die Frage der Wirksamkeit für Ältere, für die es noch zu wenige Studiendaten gebe.7 Zulassungsrelevant waren die Daten einer Interimsanalyse von vier laufenden verblindeten, randomisierten, kontrollierten Studien zur Wirksamkeit und Sicherheit des ChAdOx1-nCoV-19-Impfstoffes, die in drei Ländern durchgeführt wurden: COV001 (Phase I/II; UK), COV002 (Phase II/III; UK), COV003 (Phase III; Brasilien) und COV005 (Phase I/II; Südafrika). Die Zwischenanalyse zur Wirksamkeit umfasst Daten aus den Studien COV002 und COV003, die Evaluierung der Sicherheit erfolgte unter Einbeziehung der Daten aller 4 Studien:8
- 23.848 Studienteilnehmer (davon 11.636 zur Evaluierung der Wirksamkeit) im Alter ≥ 18 Jahre
- 1:1-Randomisierung auf je 2 Dosen AZD1222 (Standarddosis: 2 volle Dosen vs. modifizierte Dosis: halbe Dosis gefolgt von voller Dosis) oder Kontrolle (Vergleichs-Meningokokken-Konjugat-Impfstoff oder Kochsalzlösung)
- intramuskuläre Verabreichung im Abstand von 4 bis zu 12 Wochen
- medianes Follow-up von 3,4 Monaten nach Dosis 1 und von median 2,0 Monaten nach 2 Dosen
- Wirksamkeit (Abb. C): bei Standarddosierung von AZD1222 Wirksamkeit von 62,1 %, bei modifiziertem Dosierungsschema 90,0 %; kombinierte Analyse beider Dosierungsschemata: Wirksamkeit von 70,4 %
- Sicherheit: 21 Tage nach der 1. Impfdosis 10 Fälle hospitalisiert – alle in der Kontrollgruppe; Inzidenz schwerwiegender unerwünschter Ereignisse in beiden Gruppen vergleichbar (84 im AZD1222-Arm vs. 91 im Kontrollarm)
Hinweis der Redaktion: Am 4. 2. 2021 vermeldete AstraZeneca die neuesten Erkenntnisse zu ihrem COVID-19-Vakzin: 100%iger Schutz vor schwerwiegenden Krankheitsverläufen, Krankenhausaufenthalten und Todesfällen in Primäranalyse der Phase-III-Studien bestätigt; erhöhte Wirksamkeit bei längerem Dosisintervall; Schutz von über 70 % bereits nach der ersten Dosis; erster Hinweis auf Reduktion der Krankheitsübertragung um bis zu 67 %.9
Info
- Für zugelassene Impfstoffe wird – wie für jedes andere zentral zugelassene Arzneimittel – auf der Website der EMA ein sogenannter European Public Assessment Report (EPAR) veröffentlicht
- Fragen-Antworten-Rubrik zur Corona-Schutzimpfung des Bundesministeriums für Soziales, Gesundheit, Pflege und Konsumentenschutz
- Dashboard: der aktuelle Überblick über die Zahl der geimpften Personen in Österreich
1 OTS-Originaltext Presseaussendung: [Link]
2 Fachinformation Comirnaty®, Stand: 28. 1. 2021
3 Polack FC et al., N Engl J Med 2020; 383(27):2603–15
4 Fachinformation COVID-19 Vaccine Moderna®, Stand: 26. 1. 2021
5 Baden LR et al., N Engl J Med 2020; DOI: 10.1056/NEJMoa2035389. Online ahead of print.
6 Fachinformation COVID-19 Vaccine AstraZeneca®, Stand: 29. 1. 2021; [Link]
7 APA-Science Redaktion; [Link]
8 Voysey M et al., Lancet 2021; 397(10269):99–111
9 AstraZeneca, Pressemitteilung für medizinische Fachpresse vom 4. 2. 2021
Aktueller Stand des Artikels: 4. 2. 2021