UIM 05|2019
Asthma im Focus
Bei der Fortbildungsveranstaltung Pneumologie im Focus (PIF2019) referierten zahlreiche Experten unter dem Vorsitz von Prim. Priv.-Doz. Dr. Bernd Lamprecht, Vorstand der Klinik für Lungenheilkunde, Kepler Universitätsklinikum, und Dr. Martin Trinker, MScMBA, Lungenfacharzt, Graz über die neuesten Erkenntnisse aus dem Bereich der Pneumologie. Der folgende Artikel beschränkt sich auf den Einsatz kurzwirksamer β-Mimetika bei Asthma sowie auf Einblicke zum Thema schweres Asthma.
Kurzwirksame β2-Mimetika (SABA)
In einer Pro- und Kontrasitzung diskutierten Prim. Univ.-Prof. Wolfgang Pohl, Vorstand der Abteilung für Atmungs- und Lungenerkrankungen, Krankenhaus Hietzing, Wien, und Prim. Univ.-Prof. Mag. Dr. Thomas Frischer, Abteilung für Kinder- und Jugendheilkunde mit Ambulanz, Wilhelminenspital, gegen und für den Gebrauch von SABA.
Notwendigkeit oder Kunstfehler?
„Asthma ist immer eine chronisch entzündliche Erkrankung, und somit ist eine SABA-Monotherapie nicht ausreichend“, so Pohl, der die Rolle des SABA-Gegners einnahm. Im Vergleich zu Patienten mit 0–2 verordneten SABA pro Jahr, weisen Patienten mit ≥ 3 SABA ein deutlich erhöhtes Risiko für Hospitalisierungen sowie auch für eine vermehrte Verschreibung von oralen Kortikosteroiden (OCS) auf.1 Ein übermäßiger SABA-Gebrauch ist laut dem Pulmologen zudem mit einem erhöhten Risiko für Mortalität2 und Exazerbationen sowie einer schlechteren Krankheitsprognose assoziiert. Es besteht nicht nur über alle Asthma-Schweregrade hinweg ein Risiko für akute Exazerbationen3–5, sondern diese können auch bei Patienten mit kontrolliertem Asthma eintreten.4 So erleben etwa 24 % der Asthma-Patienten, die gemäß der Global Initiative for Asthma (GINA) als kontrolliert gelten, einen akuten Asthmaanfall.4 Zur Prävention von Exazerbationen und zum Schutz der Lungenfunktion ist eine Therapie mit inhalativen Kortikosteroiden (ICS) notwendig, so Pohl. Betrachtet man den Zusammenhang zwischen der Mortalität und der Häufigkeit der ICS-Anwendung, zeigt sich, dass mit einer zunehmenden ICS-Verschreibung pro Jahr das relative Risiko für Tod durch Asthma sinkt; so geht die Anwendung von ≥ 6 ICS pro Jahr mit einer Senkung der Asthma-Mortalität um 50 % einher.6 Beachtlich ist laut Pohl der sofortige Wirkeintritt von ICS. Budesonid führt beispielsweise innerhalb von 6 Stunden zu einer Verminderung der Eosinophilen im Sputum, zu einer Verbesserung der bronchialen Hyperreagibilität (BHR) und auch zu einer Verbesserung der Lungenfunktion gemessen am FEV1.7 Zur besseren Adhärenz empfiehlt sich laut Pohl die Verschreibung eines ICS in Kombination mit einem β-Agonisten, wie beispielsweise Budesonid und Formoterol.
Diese und weitere Evidenzen führten dazu, dass die Global Initiative for Asthma (GINA) Empfehlungen, in der aktuellsten Version von 2019, SABAs nicht mehr als empfohlene Bedarfstherapie führen. (Ref GINA)
Das SMART-Konzept
Prim. Univ.-Prof. Mag. Dr. Thomas Frischer, Abteilung für Kinder- und Jugendheilkunde mit Ambulanz, Wilhelminenspital nahm die Rolle des SABA-Befürworters ein. Eine Aufgabe, die im Angesicht der neuesten GINA-Empfehlungen denkbar fordernd war. Er referierte über das Potenzial des sogenannten SMART-Konzepts (Single Inhaler Maintainace and Reliever Therapy). Hierbei handelt es sich um eine Fixkombination aus den beiden Wirkstoffen Budesonid und Formoterol in einem einzigen Inhalator. Dieses Kombinationsspray dient dem Patienten sowohl als Dauertherapie als auch als Bedarfsmedikation.
SMART-Rationale: Bei Asthma-Patienten beruht der Verlust der Asthmakontrolle auf einer unkontrollierten Inflammation. Durch eine Steigerung der inhalativen Therapie mittels des Kombinationsinhalators durch den Patienten selbst soll diese Inflammation kontrolliert und Symptome sollen reduziert werden. Zudem können mittels dieser Strategie nachweislich inhalative Steroide (verglichen zu einer fixen ICS-Dosis) eingespart werden, so Frischer.
Frage nach der Evidenz: Obgleich Prof. Dr. Fischer die Wirksamkeit des SMART-Konzeptes nicht in Frage stellt – zeigen sich in Studien doch im Vergleich zur Standardtherapie Vorteile bezüglich der Hospitalisierungsraten, des OCS-Bedarfs, der FEV1 und reduzierter Exazerbationsraten – zweifelt er die Rolle des Steroids in dem Konzept an.11 Die Frage, die sich laut Prim. Frischer stellt, ist, ob durch eine passagere Erhöhung der Steroiddosis die Inflammation evidenzbasiert reduziert werden kann und ob es dadurch zu einer tatsächlichen Reduktion der Symptome kommt. Anhand einer Vielzahl von Studien zu diesem Thema und auch evidenzbasierter Cochrane-Analysen – wie beispielsweise von Kew et al. an 1.669 pädiatrischen und erwachsenen Patienten9 – ist diese Frage mit „Nein“ zu beantworten, so der Experte. Begründet sei dies darin, dass ICS keine gute Dosis-Wirkung-Beziehung aufweisen. So zeigte etwa eine Metaanalyse von Masoli et al.10, dass eine Erhöhung der Fluticasonpropionat-Dosis über 200 µg /Tag keinen Benefit (z. B. hinsichtlich β-Agonist-Bedarf oder Exazerbationen) bringt. Eine weitere auf die Evidenz zu beziehende Frage ist, ob mittels SMART-Therapiekonzept verglichen zur Standardtherapie bessere Outcomes erzielt werden können; wenngleich der Effekt auch gering ist.11
Zielgruppe Kinder? Das SMART-Konzept ist für Jugendliche ab 12 Jahren zugelassen und wäre bei Kindern und Jugendlichen aufgrund des zumeist episodischen Asthmas und der erfahrungsgemäß schlechten Adhärenz in dieser Altersgruppe laut Frischer attraktiv, kann allerdings aufgrund unzureichender Daten nicht empfohlen werden. Prof. Frischer sieht bei sehr milden Patienten die Gefahr einer Übertherapierung. „Asthma ist ein Überbegriff für unterschiedliche Phänotypen, die individualisiert behandelt werden sollten.“ Daher wählt er die SMART-Therapie nur bei ausgewählten Patienten.
Real-Life-Daten aus Österreich
Laut Österreichischem Verschreibungsindex entfallen 14 % aller Asthmaverordnungen auf SABA, allerdings kann anhand dieser Daten nicht auf die Adhärenz geschlossen werden, so Prim. Assoc.-Prof. Dr. Sylvia Hartl, MBA, Vorständin der 2. Internen Lungenabteilung, Otto-Wagner-Spital. Laut einer Analyse von IQVIA werden in Österreich jährlich rund 1,4 Millionen Packungen SABA verkauft (Quelle: Aus IQVIA-Rezeptanalyse – R03 von 04/2018 bis 09/2018 – im Auftrag von AstraZeneca).
Global Initiative for Asthma-(GINA-)
Empfehlungen 2019
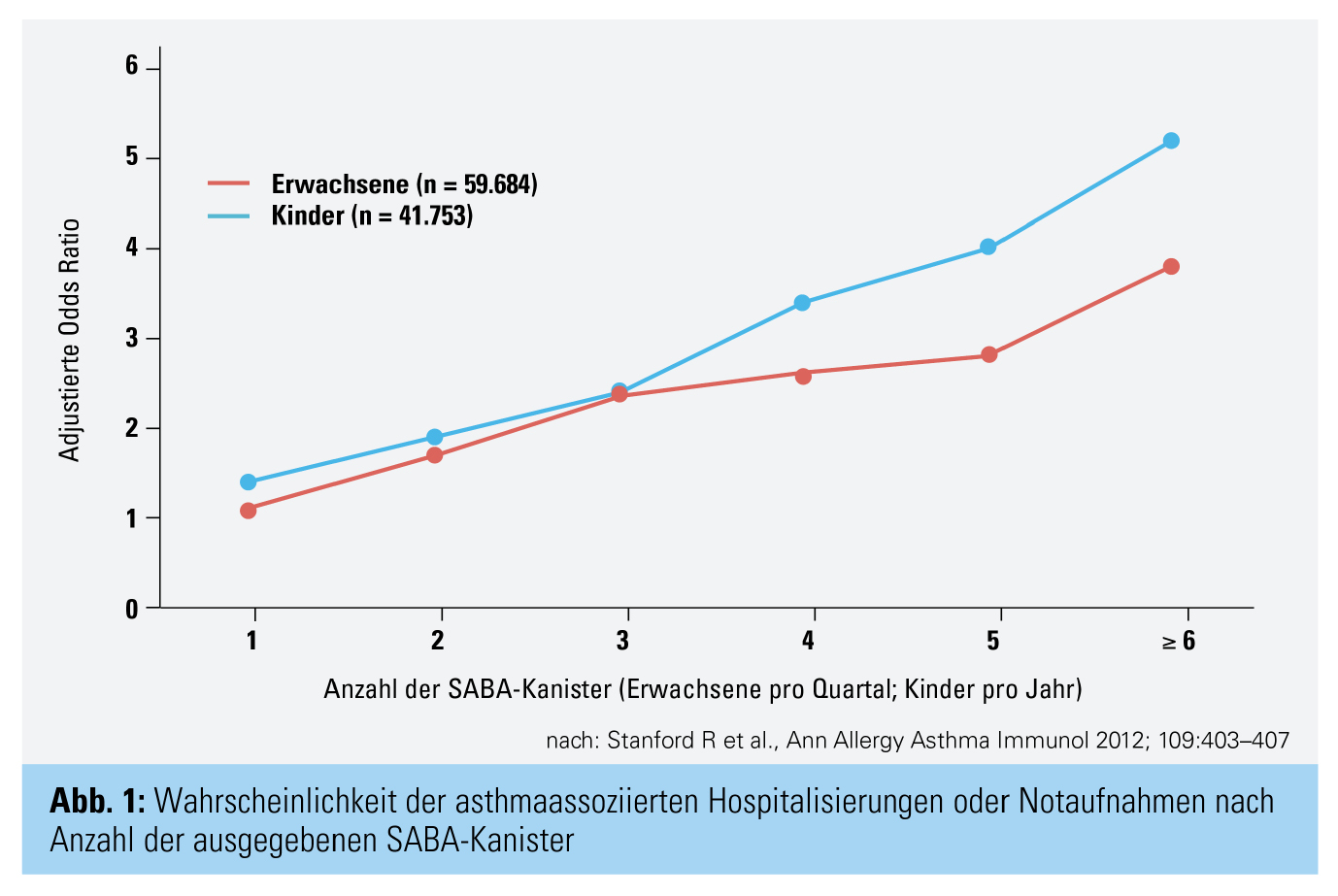
Prof. Lamprecht stellte in seinem Vortrag die wichtigsten Änderungen der GINA-Empfehlungen vor. Im Vorwort der Empfehlungen sprechen die Autoren von der wichtigsten Therapieänderung seit 30 Jahren. Aus Sicherheitsgründen und aufgrund der bereits oben von Prof. Pohl erwähnten Evidenzen empfiehlt GINA, niemals SABA als alleinige Medikation einzusetzen. Unter anderem wurde gezeigt, dass ≥ 3 SABA Kanister/Jahr das Risiko für Hostpialisierungen und Notaufnahmen signifikant erhöhen (Abb. 1). Stattdessen sollen alle Patienten inhalative Kortikosteroide einnehmen, entweder Symptomgetrieben oder als regelmäßige Erhaltungstherapie. Die bevorzugte Bedarfsmedikation ist niedrigdosiertes ICS-Formoterol; SABAs stellen nur die alternative Bedarfsmedikation darf.* Prof. Lamprecht begrüßt die Änderungen, da diese neuen Empfehlungen eine sehr praxisnahe, patientenfreundliche Therapie darstellen, welche auch im Sinne einer verbesserten Adherenz funktionieren sollte.
Schweres Asthma
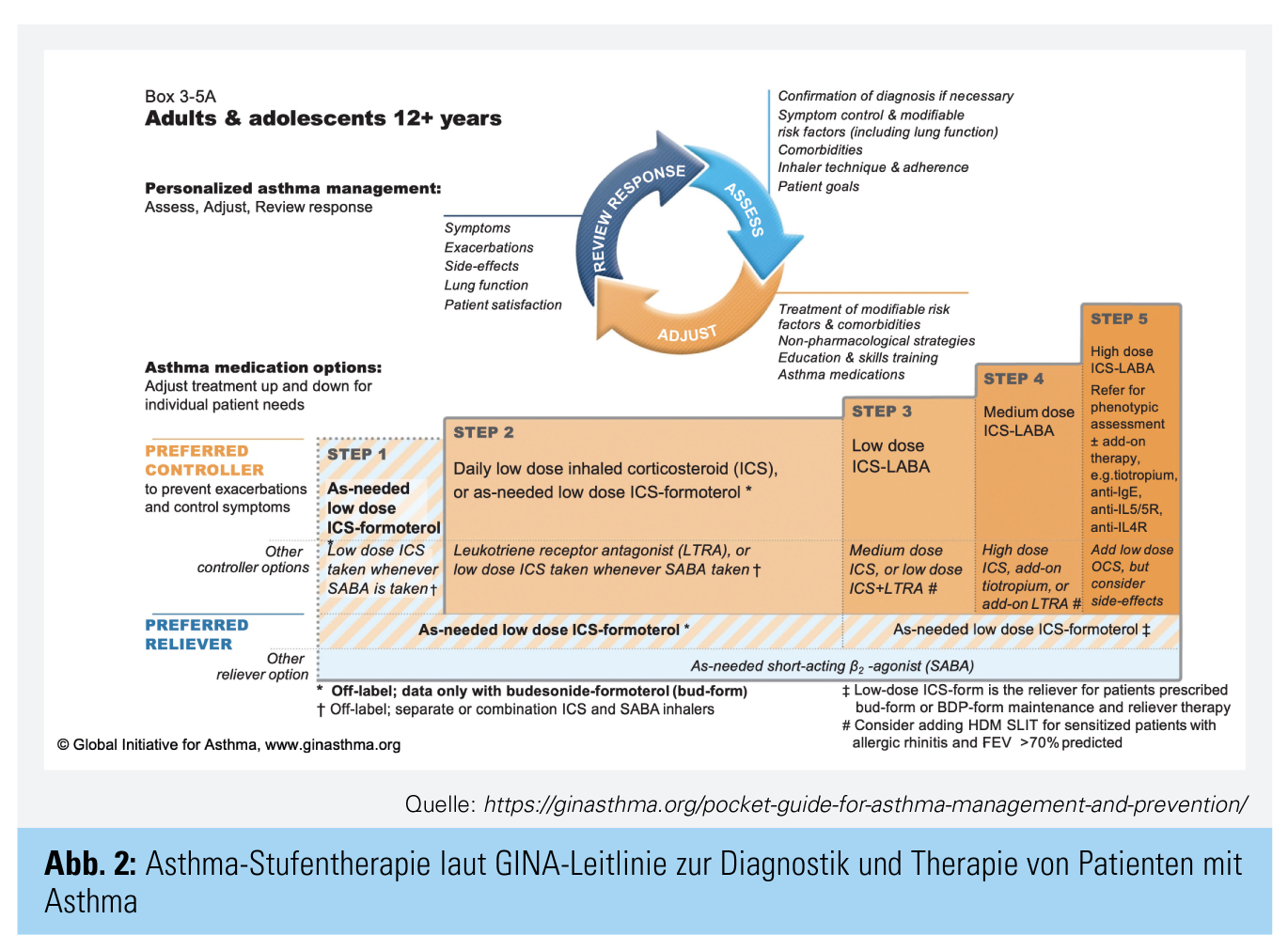
Univ.-Prof. Dr. Roland Buhl, III. Medizinische Klinik und Poliklinik (Hämatologie, Internistische Onkologie und Pneumologie), Universitätsmedizin der Johannes-Gutenberg-Universität, Mainz, fokussierte in seinem Vortrag die Themen Diagnose und Therapie bei schwerem Asthma. Betrachtet man die leitliniengetreue Asthma-Stufentherapie bei Erwachsenen (Abb. 2)12, gilt laut dem Experten bei den Stufen 1–4 die empirische Therapie ICS ± LA
BA ± LAMA als erste Wahl und wird es auch für die nächsten Jahre bleiben. „Spannend ist und bleibt allerdings die Stufe 5, schweres Asthma“, so der Experte.
Diagnose
„Schweres Asthma beginnt mit der richtigen Diagnose“, verdeutlichte Buhl. Mit Hilfe eines klar definierten Algorithmus lässt sich abklären, ob ein Patient an schwergradigem Asthma leidet. Der Experte betonte allerdings, dass die Diagnosestellung schwergradiges Asthma nicht bei der Erstkonsultation des Patienten gestellt werden kann, sondern sich die Diagnose zumindest über Wochen entwickelt und dann bestätigt. Die Abklärung erfolgt mittels Biomarker und Labordiagnostik (Eosinophile, spezifische IgE, fraktioniertes exhaliertes Stickstoffmonoxid [FeNO]) und Labordiagnostik (Blutbild mit Differenzialzellbild, Immunglobuline, Allergiediagnostik, Autoantikörper). Ergänzt wird dies durch klinische Parameter wie z. B. Allergieanamenese, Exazerbationshistorie, nasale Symptomatik etc.
Therapie
Nach der Diagnosestellung schweres Asthma wird mit einer inhalativen Therapie (ICS in Höchstdosis + LABA + LAMA) begonnen. Bevor zusätzlich oder alternativ OCS (schwerwiegende Nebenwirkungen) verabreicht werden, gilt laut Buhl unbedingt die Qualifizierung des Patienten für eine Biologika-Therapie zu klären.13 Bei der zielgerichteten Therapie mit Biologika ist dabei zwischen zwei Phänotypen zu unterscheiden: allergisches (Anti-IgE-AK: Omalizumab) vs. eosinophiles Asthma (Anti-IL-5-AK: Mepolizumab, Reslizumab; Anti-IL-5-Rezeptor-AK: Benralizumab).
Biologika-Therapie: In einer Phase-3-Studie für Benralizumab (ZONDA) konnte klar gezeigt werden, dass Benralizumab bei Patienten mit schwerem eosinophilem Asthma, die kontinuierlich orale Steroide einnehmen, gegenüber Placebo zu einer signifikanten Reduktion der OCS-Dosis (mediane Reduktion 75 % vs. 25 % nach 28 Wochen, p < 0,001) führt. Zudem reduziert sich unter Benralizumab gegenüber Placebo die jährliche Exazerbationsrate signifikant.14 Auch Mepolizumab konnte bei Patienten mit schwerem eosinophilen Asthma im Vergleich zu Placebo eine signifikante Reduktion der oralen Glukokortikoiddosis sowie der Exazerbationsrate bewirken.15 Dass der Benefit einer zielgerichteten Anti-IL-5-Therapie mit zunehmender Eosinophilenzahl im Blut steigt und somit vor allem Patienten mit ausgeprägter Bluteosinophilie von einer Anti-IL-5-Therapie profitieren, zeigte sich in einer von Corren et al. konzipierten Phase-III-Studie. In dieser Studie führte Reslizumab bei Patienten mit ≥ 400 Eosinophilen/µl Blut vs. Patienten mit < 400 Zellen/µl zu einer signifikanten Verbesserung der Lungenfunktion (FEV1).16
„Allerdings stellen weder anti-IgE noch anti-IL5 eine die Erkrankung modulierende Therapie dar; nach Behandlungsstopp lässt der Effekt innerhalb weniger Wochen nach“, betonte Buhl. Die rezenten Daten der Phase-III-Extensionsstudie BORA (insgesamt 108 Wochen)17 bestätigten nun die Langzeitsicherheit und -wirksamkeit von Benralizumab bei Patienten mit schwerem, unkontrolliertem eosinophilem Asthma, die zuvor in die Studien SIROCCO (Studiendauer 48 Wochen) oder CALIMA (Studiendauer 56 Wochen) eingeschlossen waren. Patienten der Verum-Gruppe, die diese Studien erfolgreich beendet hatten, erhielten in BORA weiterhin subkutan Benralizumab Q4W oder Q8W**; Patienten der Placebogruppe wurden 1 : 1 in den Erhalt von Benralizumab Q4W oder Q8W** randomisiert. Die Ergebnisse: 74 % der Patienten mit einem Ausgangswert von ≥ 300 Eosinophilen/µl Blut blieben im zweiten Jahr unter Benralizumab Q8W** frei von Exazerbationen, es traten zudem keine neuen Sicherheitssignale auf.*** Die vorbehandelten Patienten wiesen zudem eine nahezu vollständige Depletion der Eosinophilen im Blut auf; auch bei Patienten unter erstmaliger Benralizumab-Therapie zeigte sich eine Reduktion der Anzahl an Eosinophilen.17
Therapieansprechen und Monitoring: Das Therapieansprechen auf Biologika sollte nach 4–6 Monaten beurteilt werden, danach jährlich. Es gäbe noch keine allgemein gültige Definition des Therapieansprechens, ein Responder sollte nach folgenden Parametern beurteil werden: Symptomkontrolle, Bedarfsmedikation, systemische Glukokortikoide, Lungenfunktion, Zahl und Schwere der Exazerbationen, Nebenwirkungen, Patientenzufriedenheit. Die Therapie sollte bei Non-Respondern beendet und bei Intermediate-Respondern bis zu einem Jahr weitergeführt werden, um das Ansprechen besser beurteilen zu können.18