UIM 06|2018
Chronische Rhinosinusitis und Asthma – Phänotypen, Endotypen und neue Therapien
Die chronische Entzündung der Nase und der Nasennebenhöhlen ist eine heterogene Erkrankung, die in Europa etwa 11 % der Bevölkerung betrifft.1 Durch den langwierigen Verlauf entstehen signifikante Auswirkungen auf die gesundheitsbezogene Lebensqualität, die Folge ist eine erhebliche Kostenbelastung für das Gesundheitssystem. Daher ist es dringend notwendig, die personalisierte Versorgung, Vorsorge und Vorhersage der Behandlungserfolge zu verbessern.
Chronische Rhinosinusitis (CRS)
Unter chronischer Rhinosinusitis (CRS) werden entzündliche Prozesse mit einer Dauer von über 12 Wochen definiert. Die Symptome dauern meist jedoch mehrere Jahre bis Jahrzehnte an und verschlechtern sich oft zusehends. Klinisch wird die Diagnose durch das Auftreten von Schleimhautschwellungen und Polypen in der Nase und in den Nasennebenhöhlen gestellt, wodurch Symptome wie Nasenatmungsbehinderung, Riechminderung, Sekretion, Druckgefühl und Schmerzen entstehen. Radiologisch wird die Ausdehnung meist mittels Computertomografie bestimmt.
Die Ausprägung, der klinische Verlauf sowie der Behandlungserfolg der CRS sind äußerst unterschiedlich. Eine grobe klinische Einteilung kann durch das Vorhandensein von Nasenpolypen getroffen werden, so wird klinisch zwischen chronischer Rhinosinusitis ohne Polyposis (CRSsNP) und chronischer Rhinosinusitis mit Polyposis (CRSwNP) unterschieden. Der Krankheitsverlauf und der Therapieerfolg sind meist deutlich schlechter, wenn nasale Polypen vorhanden sind.
Endotypen der CRS
Noch unterschiedlicher als die Phänotypen sind die Endotypen der CRS. Im Fokus steht derzeit die Aufarbeitung der Pathomechanismen und deren Korrelation mit den klinischen Befunden, um dadurch personalisierte pharmakologische und chirurgische Therapien zu ermöglichen.
Die CRSsNP ist eine Entzündungsreaktion, die vorrangig durch neutrophile Granulozyten, erhöhte Typ-1-Zytokine und TH1-Zellen bestimmt wird.2 TH2-Zellen scheinen eine untergeordnete Rolle zu spielen. Bei Patienten mit nasaler Polyposis scheinen sich die Pathomechanismen jedoch deutlich zu unterscheiden. Darüber hinaus gibt es bei der CRSwNP weltweit große regionale Unterschiede im zugrunde liegenden Entzündungsprofil. Der in Europa und in den USA am häufigsten vorkommende Endotyp ist eine von Typ-2-Zytokinen wie IL-4, IL-5 und IL-13 sowie von eosinophilen und basophilen Granulozyten und TH2-Zellen dominierte Entzündungsreaktion.2 In einer rezenten Studie zur Endotypisierung der CRS wurde eine Clusteranalyse von Biomarkern im Gewebe durchgeführt, um die Expressionsmuster mit relevanten klinischen Befunden zu korrelieren. Es konnte gezeigt werden, dass die Expression von Typ-2-Zytokinen mit dem Auftreten nasaler Polyposis korreliert und darüber hinaus nicht nur die Wahrscheinlichkeit für Rezidive, sondern auch das Risiko einer Asthmaerkrankung beeinflusst.2, 3
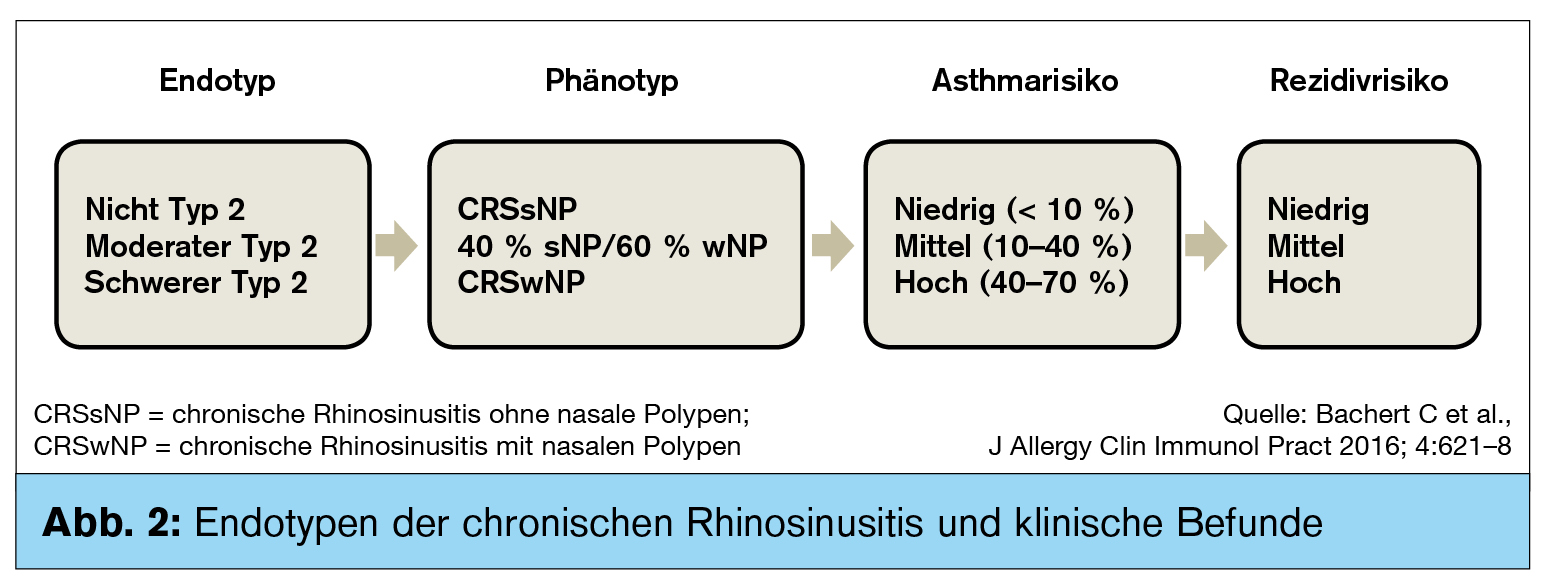
Die Autoren definierten 3 Endotypen, basierend auf der signifikanten Hochregulation von Typ-2-Zytokinen wie IL-4, IL-5, IL-13 und IgE in Patientenkollektiven mit schwerer und mittelschwerer Erkrankung im Vergleich zu gesunden Probanden. Es konnten 3 Gruppen definiert werden:
- Nicht Typ 2,
- moderater Typ 2 und
- schwere Immunreaktionen vom Typ 2 (Abb. 1).
Während die Nicht-Typ-2-Gruppe überwiegend aus Patienten mit CRSsNP mit geringer Asthmakomorbidität bestand, korrelierte das moderate Typ-2-Entzündungsmuster häufiger mit CRSwNP sowie einer erhöhten Asthmaprävalenz. Schwere Typ-2-Entzündungen waren in fast allen Fällen mit CRSwNP und bis zu 70 % mit Asthmakomorbidität assoziiert.
Insbesondere IL-5 scheint eine wichtige Rolle in der CRSwNP-Pathophysiologie zu spielen. So konnte gezeigt werden, dass Patienten mit hohen IL-5-Werten die höchste Prävalenz von nasaler Polyposis und Asthma haben. Im Gegensatz dazu bestehen Patientengruppen mit niedrigem IL-5 in erster Linie aus CRSsNP-Patienten.4
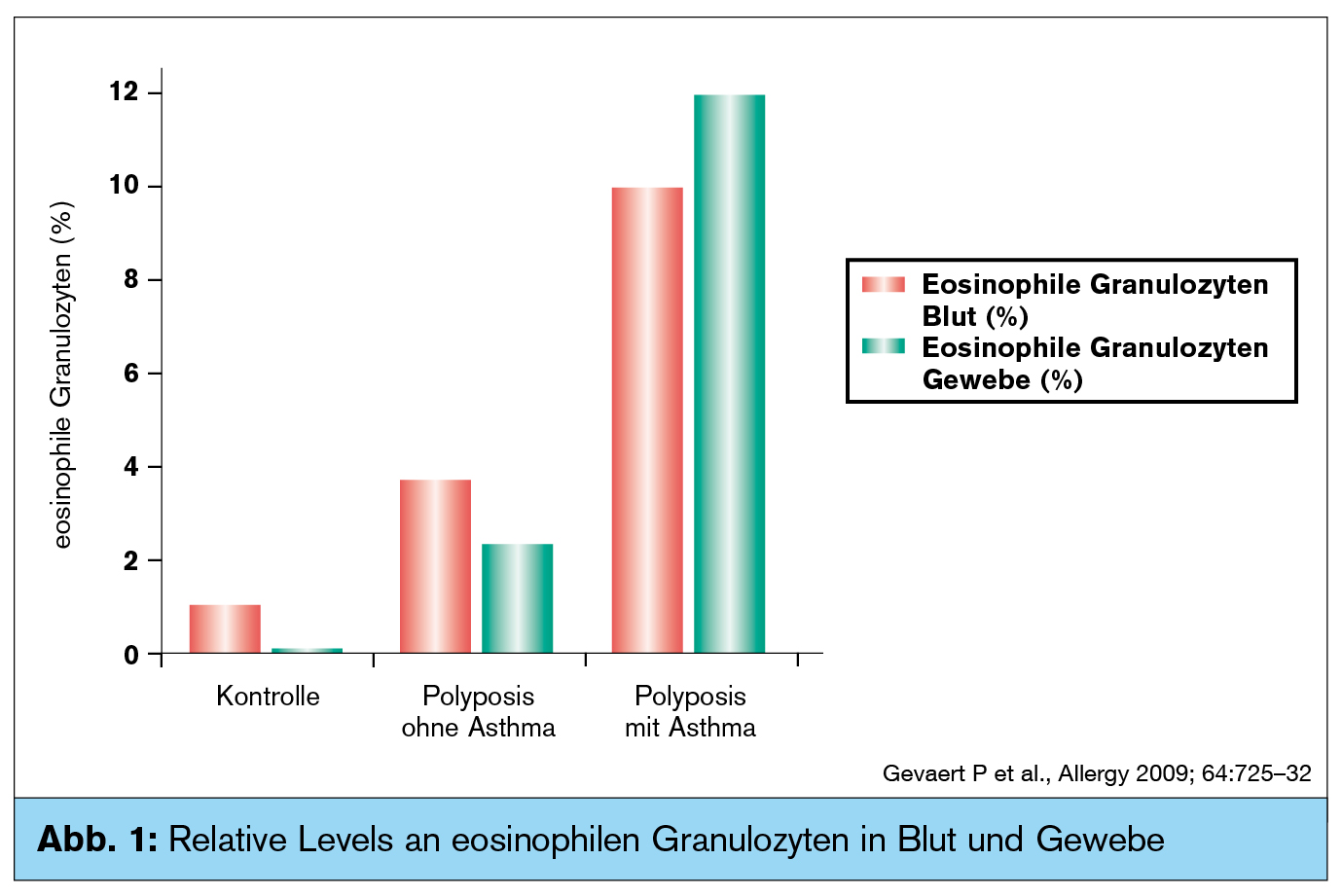
Eosinophile Granulozyten, die durch IL-5 stimuliert werden, finden sich vor allem im Serum und Gewebe von Patienten mit nasaler Polyposis und Asthma (Abb. 2).5
Eine besondere Herausforderung mit bisher sehr limitierten Therapieerfolgen stellt der sogenannte Morbus Widal, auch Samter-Trias oder AERD (Aspirin-exacerbated Respiratory Disease) genannt, dar. Die Prävalenz von M. Widal wird auf 0,3–0,9 % der Bevölkerung geschätzt, jedoch steigt die Prävalenz auf 3–20 % der Asthmatiker und bis zu 30–40 % bei Asthmatikern mit nasaler Polyposis.6 Bei dieser speziellen Patientengruppe besteht, neben der Unverträglichkeit von ASS und anderen Schmerzmitteln, die in den Arachidonsäurezyklus eingreifen, oftmals eine massive nasale Polyposis und schweres Asthma. Der Pathomechanismus ist noch nicht vollständig geklärt, jedoch dürfte eine abnormale Metabolisierung von Arachidonsäure zu einer Verminderung der Prostaglandinsynthese und Erhöhung von Leukotrienen führen, wodurch eine eosinophile Chemotaxis und Gewebeschädigung entsteht. Das Zytokinprofil zeigt eine TH-2-Erkrankung mit erhöhten Werten von IL-4, IL-5 und eosinophilen Granulozyten.7
Therapie der CRS
Die Therapie der CRS richtet sich derzeit nach der klinischen Präsentation der Patienten und umfasst in erster Linie die Behandlung mit intranasalen Kortikosteroiden, Nasenspülungen und kurzzeitigen, systemischen Kortikosteroidtherapien. Falls eine medikamentöse Therapie nicht zur Heilung oder Linderung der Symptome führt, ist eine chirurgische Sanierungen indiziert. Dieser bisher sehr einheitliche Therapieansatz führt jedoch nicht bei allen Patienten zu einer erfolgreichen Behandlung. Besonders für schwere Fälle und Patienten mit rezidivierenden Problemen sind individuelle, dem Pathomechanismus entsprechende Ansätze dringend nötig.
Die Behandlung von nasaler Polyposis mit neuen, zielgerichteten Biologicals wird intensiv erforscht. Die Therapiestrategien haben ihren Ursprung in der Behandlung von schwerem Asthma und sind gegen Typ-2-Zytokine wie IL-4, IL-5, IL-13 und IgE gerichtet. Die starke Assoziation zwischen IL-5 und CRSwNP hat IL-5 zu einem vielversprechenden therapeutischen Ziel für biologische Therapien werden lassen. In Phase-I- und -II-Studien konnten bereits vielversprechende Ergebnisse präsentiert werden, Phase-III-Studien werden derzeit durchgeführt.
Eine randomisierte placebokontrollierte Studie konnte zeigen, dass Mepolizumab, ein monoklonaler Antikörper gegen IL-5, signifikante Verbesserungen bei Patienten mit CRSwNP bewirken kann. So konnte die Ausprägung der nasalen Polyposis und die Notwendigkeit einer Operation verringert werden, wobei die krankheitsbezogene Lebensqualität stieg.8
Dupilumab, ein humaner monoklonaler Antikörper, der die IL-4Rα-Untereinheit blockiert, ist für die Behandlung von Patienten mit mittelschwerer bis schwerer atopischer Dermatitis in der Europäischen Union und in den USA zugelassen. Bei Patienten mit unkontrolliertem persistierendem Asthma trotz inhalativen Kortikosteroiden und β2-Agonisten konnte gezeigt werden, dass es die Lungenfunktion erhöht und schwere Exazerbationen reduziert werden.
Auch bei Patienten mit CRSwNP, die auf topische Kortikosteroide nicht ansprachen, konnte eine positive Wirkung von Dupilumab auf die nasale Polyposis sowie die krankheitsspezifische Lebensqualität und den Geruchssinn gezeigt werden.9
Omalizumab ist ein humanisierter, monoklonaler IgE-Antikörper, der für die Therapie von schwerem allergischem Asthma zugelassen wurde. Bei der Behandlung von CRSwNP-Patienten mit Asthma konnte eine Verbesserung der Lebensqualität sowie Reduktion der nasalen Polyposis festgestellt werden.10
Benralizumab ist ein monoklonaler, gegen den IL-5-Rezeptor gerichteter Antikörper, der zu einer fast vollständigen Depletion der eosinophilen und basophilen Granulozyten führt. Der Antikörper wurde bereits für die Behandlung von schwerem, eosinophilem Asthma zugelassen und zeigt ein Nebenwirkungsprofil vergleichbar mit Placebo. Derzeit wird eine klinische Phase-III-Studie durchgeführt, um den Effekt auf Patienten mit CRSwNP mit ausgeprägter und rezidivierender Polyposis nasi zu untersuchen.
Zusammenfassung
Mit dem raschen Wissenszuwachs über Immunpathomechanismen von CRS und der Erwartung, dass neue Biologicals für die Behandlung von Nasenpolypen in näherer Zukunft verfügbar werden, besteht die dringende Notwendigkeit zur Endotypisierung und weiteren Entwicklung von personalisierten Therapiestrategien. Bei der CRS können zumindest Typ-2- von Nicht-Typ-2-Immunreaktionen unterscheiden werden, wobei eine eindeutige Assoziation der Typ-2-Erkrankung mit schwerer Krankheitsausprägung, Rezidivhäufigkeit und Asthmakomorbidität besteht. Biologicals, die gegen Typ-2-Entzündungen bei schwerem Asthma eingesetzt werden, sind vermutlich auch die therapeutische Zukunft für die Behandlung von Patienten mit CRSwNP.