UIM 08|2021
Neue Konzepte zur Behandlung von Nasenpolypen bei Asthma
Die chronischen entzündlichen Atemwegserkrankungen Asthma und chronische Rhinosinusitis mit nasaler Polyposis treten häufig gemeinsam auf. Diesen Erkrankungen liegen ähnliche Pathomechanismen und Entzündungsmuster zugrunde, die als „United Airway Disease“ beschrieben werden. Hierbei handelt es sich um eine durch spezifische Interleukine, IgE und eosinophile Granulozyten definierte Typ-II-Inflammation. Derzeit sind die Biologika Dupilumab und Omalizumab für beide Indikationen zugelassen und bieten effektive therapeutische Möglichkeiten für beide Erkrankungen. Um dieses Feld weiterzuerforschen, ist eine enge Zusammenarbeit zwischen Pulmologen und HNO-Ärzten dringend erforderlich.
Asthma
Asthma ist eine heterogene Erkrankung, die durch eine chronische Entzündung der unteren Atemwege, bronchiale Hyperreagiblität und bronchiale Obstruktion charakterisiert ist. Die Symptome der Erkrankung wie Atemnot, Husten und Engegefühl in der Brust sind im Verlauf unterschiedlich ausgeprägt. Im Jahr 2019 waren nach Angaben der WHO ca. 262 Millionen Menschen von Asthma betroffen.1 Ein schweres Asthma liegt vor, wenn nach Optimierung aller mitwirkenden Faktoren (Komorbiditäten, Compliance) ein hohes Therapieniveau oder ein mittleres Therapieniveau mit unzureichender Symptomkontrolle besteht.2 Ungefähr 3–10 % aller Patienten haben schweres Asthma. Bei einem Teil dieser Patienten können, nach Typisierung sowie ausführlicher Begutachtung der Komorbiditäten und Differenzialdiagnosen, Biologika zum Einsatz kommen. Bei Patienten mit allergischem Asthma und perennialem Allergen kommt eine Behandlung mit dem Immunoglobulin-(Ig-)E-Antikörper Omalizumab in Frage.
Chronische Rhinosinusitis
Die chronische Rhinosinusitis (CRS) ist eine andauernde entzündliche Veränderung der Schleimhaut der Nase sowie der Nasennebenhöhlen. Definitionsgemäß müssen zwei Symptome wie nasale Obstruktion, Riechminderung, Druckgefühl oder Schmerzen im Gesicht, purulente Sekretion oder nasale Polypen über eine Dauer von mindestens drei Monaten bestehen, um die Diagnose zu stellen.3
Die Symptome sind jedoch nicht nur auf die Nase und Nebenhöhlen beschränkt. So kann die CRS auch zu erheblichen Störungen des Schlafes, des emotionalen Empfindens und der Konzentrationsfähigkeit führen. Etwa 6–11 % der Bevölkerung leiden unter chronischen Nebenhöhlenbeschwerden.4, 5 Der Begriff der CRS umfasst jedoch sehr unterschiedliche Ausprägungen der Erkrankung. Es lassen sich verschiedene Präsentationen beschreiben, wobei klinisch zwischen CRS mit Polyposis in der Nasenhaupthöhle (CRSwNP) sowie ohne Polyposis (CRSsNP) unterschieden wird. Internationale Prävalenzangaben zur CRSwNP reichen von 2 bis 4 %. In einer rezenten Studie in einer großen österreichischen Population wird die Prävalenz der CRSwNP mit 1,95 % angegeben.6 Diese Formen der CRS unterscheiden sich deutlich im zugrundeliegenden Pathomechanismus. Im Gegensatz zur CRSsNP, die durch ein Typ-1-Inflammationsmuster bedingt ist, steht bei der CRSwNP zumeist eine moderate bis schwere Typ-2-Entzündungsreaktion im Vordergrund.3 Diese kann durch verschiedene Reize ausgelöst werden, wobei die genauen Ursachen noch nicht vollständig geklärt und vermutlich multifaktoriell sind. Dadurch erfolgt eine Reaktion am Epithel, die spezifische Entzündungsmediatoren wie TSLP, IL-25 und IL-33 freisetzt. Im Weiteren werden die Zytokine IL-5, IL-4, IL-13 sowie IgE ausgeschüttet und eosinophile Granulozyten aktiviert, was dieses spezifische Entzündungsprofil definiert. Hierdurch kommt es unter anderem zu einer Hyperplasie der Becherzellen mit gesteigerter Sekretproduktion, zur weiteren Störung der Barrierefunktion des Epithels und zum Umbau des Gewebes mit der Ausbildung von nasalen Polypen.
Asthma und CRSwNP
Das Konzept der „United Airway Disease“ ist vielfach belegt und beschreibt ausgeprägte Ähnlichkeiten in der Pathophysiologie und den Inflammationsmustern der Typ-2-Erkrankungen Asthma und CRSwNP. Es konnte gezeigt werden, dass Entzündungsmuster mit spezifischen Phänotypen korrelieren. In einer Studie mit 173 Patienten mit CRS wurde eine Clusteranalyse der Inflammationsprofile durchgeführt.6 Bei Patienten mit Typ-1-dominiertem Profil bestand meist kein Asthma und eine CRS ohne nasale Polyposis. Im Gegensatz dazu bestand bei Patienten mit einer ausgeprägten Typ-2-Entzündung die durch IL-5, IgE sowie Staphylococcus-aureus-Enterotoxin-IgE eine CRSwNP und zumeist die Diagnose Asthma.7 Diese Erkrankungen treten häufig gemeinsam auf, so besteht bei etwa 48–56 % der Patienten mit CRSwNP die Diagnose Asthma.8 Auch der klinische Verlauf wird durch Komorbiditäten verschlechtert. Nach einer chirurgischen Sanierung der CRSwNP beträgt das Rezidivrisiko etwa 40 %; falls ein komorbides Asthma besteht, erhöht sich die 5-Jahres-Wahrscheinlichkeit auf 60 %.9 Bei bestehender Asthmaerkrankung wird die Prävalenz der CRSwNP zwischen 7 und 26 % angegeben.10, 11 Asthmatiker, die zusätzlich an CRSwNP erkrankt sind, präsentieren sich meist mit schlecht kontrollierten Symptomen, häufigeren Exazerbationen sowie deutlich reduzierter Lebensqualität.12
N-ERD
Ein spezielles Krankheitsbild stellt die „Non-steroidal anti-inflammatory drug-Exacerbated Respiratory Disease“ (N-ERD) dar. Hierbei bestehen eine CRSwNP, Asthma sowie eine Verschlechterung der jeweiligen Symptome nach Einnahme von NSAR. Diese Erkrankung ist auch unter den Namen Morbus Widal, Samters’ triad, aspirinsensitives Asthma oder AERD bekannt. Etwa 10 % der Patienten mit CRSwNP leiden zusätzlich an N-ERD.13 Diese Erkrankung wird im klinischen Alltag unter verschiedenen Blickwinkeln betrachtet. Für den Allergologen ist sie eine spezifische Hypersensitivität auf NSAR, für den Pulmologen präsentiert sie sich als schwierig zu behandelndes Asthma und für den HNO-Arzt besteht das Behandlungsproblem in ausgeprägter und rasch rezidivierender chronischer Rhinosinusitis mit nasalen Polypen. Die 5-Jahres-Rezidivrate nach chirurgischer Sanierung liegt bei etwa 90 %.
Therapieoptionen
Bisher wurde die Erkrankung durch die jeweiligen Fachdisziplinen behandelt, wobei das andere Krankheitsbild oftmals durch die jeweiligen Therapien ebenso verbessert werden konnte.
Die Therapie der CRSwNP erfolgt zunächst durch die Behandlung mit intranasalen topischen Steroiden (INCS) und salinen nasalen Spülungen. Falls dies nicht zu einer ausreichenden Symptomkontrolle führt, wird zunächst die INCS-Dosierung erhöht und kann im Weiteren durch kurzzeitige systemische Steroidgaben ergänzt werden. Jedoch führt auch dieses therapeutische Vorgehen oft nicht zu einer anhaltenden Verbesserung. Eine chirurgische Sanierung der Nasennebenhöhlen ist dann indiziert.
Behandlung mit Biologika
Die engen Zusammenhänge zwischen den beiden Erkrankungen legen nahe, einen gemeinsamen therapeutischen Plan zu entwickeln. Biologika sind eine vielversprechende Therapiemöglichkeit für Patienten mit Typ-2-Erkrankungen. Bisher sind bereits zwei monoklonale Antikörper für beide Indikationen Asthma und CRSwNP zugelassen, und in Zukunft wird vermutlich ein breites Spektrum zur Verfügung stehen.
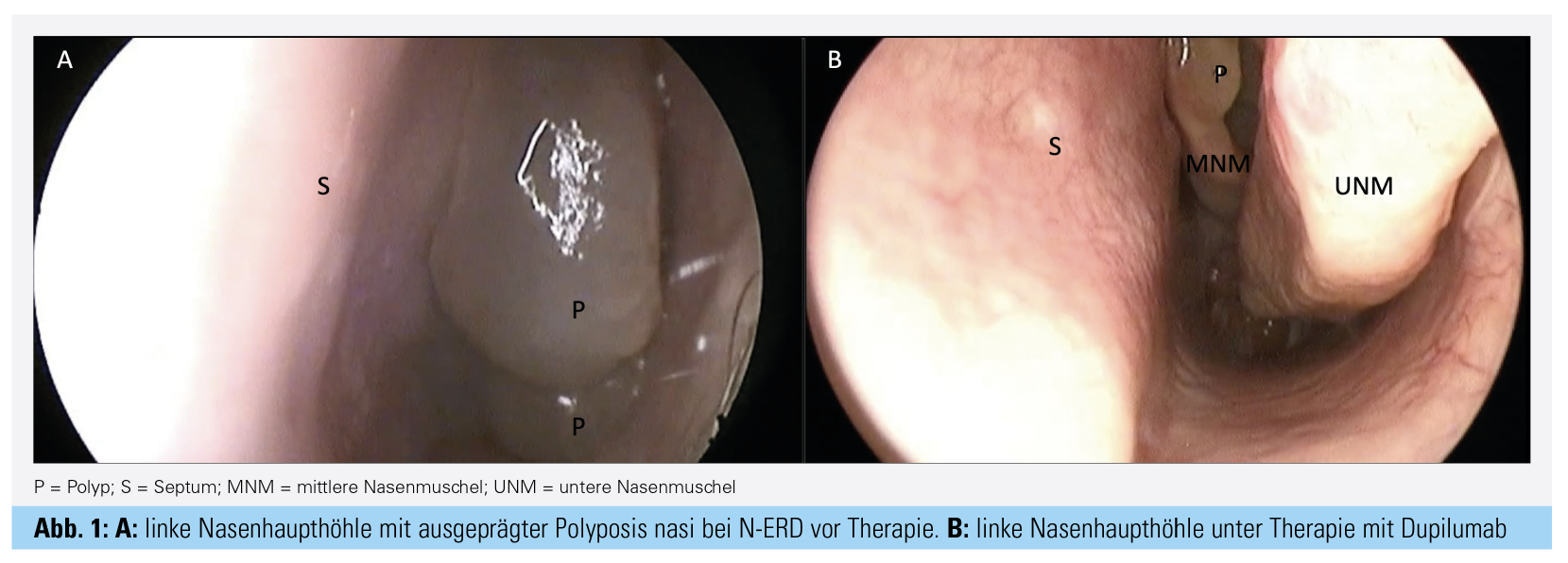
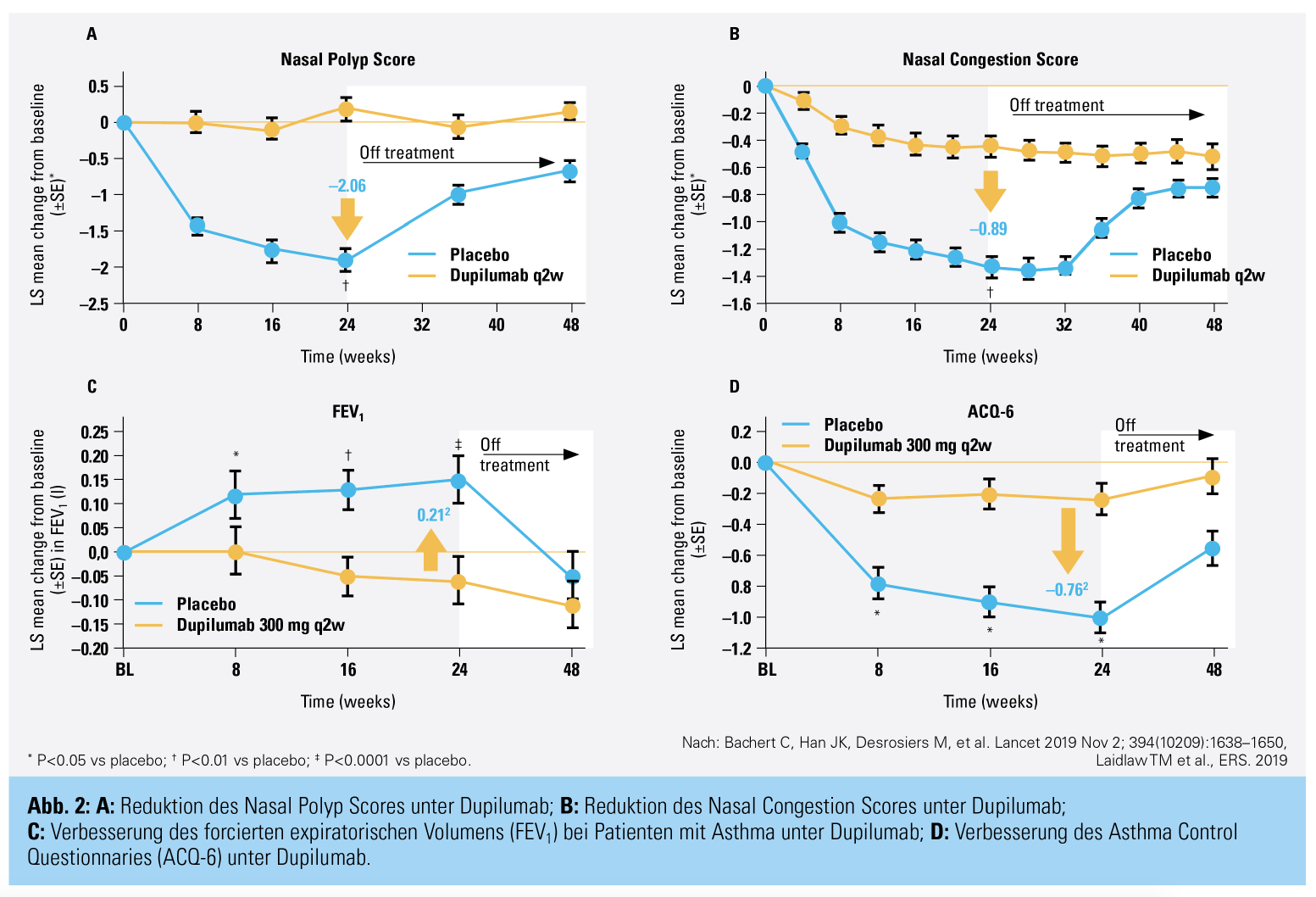
Dupilumab (Dupixent®) ist ein humaner Antikörper, der an den IL4a-Rezeptor bindet und so die Signalweiterleitung von IL-4 und IL-13 hemmt. Als erster Antikörper zur Behandlung der CRSwNP wurde er 2019 zugelassen. Die Wirksamkeit bei Patienten mit CRSwNP wurde in den Studien LIBERTY NP SINUS 24 und LIBERTY NP SINUS 52 evaluiert. Es konnte gezeigt werden, dass die Ausdehnung der nasalen Polypen, gemessen mit dem Nasal Polyp Score (NPS, 0 [keine Polypen] bis 8 [vollständige Obstruktion beider Nasenhaupthöhlen]) signifikant und klinisch relevant um über 2 Punkte reduziert werden konnte (Abb. 1 und 2). Analog dazu verbesserte sich die mit dem NCS (Nasal Congestion Score 0 [keine Obstruktion] bis 3 [maximale Obstruktion]) gemessene subjektive Verstopfung der Nase (Abb. 2) sowie die krankheitsspezifische Lebensqualität und das Riechvermögen. Bei Patienten mit komorbidem Asthma konnte analog zur Verbesserung der nasalen Symptome das FEV1 sowie die Asthmasymptomatik gemessen mit dem ACQ-6 signifikant verbessert werden (Abb. 2). Vergleichbare Ergebnisse konnten bei Patienten mit N-ERD erreicht werden.14 Dupilumab ist für die Behandlung des schweren Asthmas ab dem 12. Lebensjahr zugelassen. Weiters besteht eine Zulassung für die Behandlung der CRSwNP als Zusatztherapie zu intranasalen Kortikosteroiden bei Erwachsenen mit schwerer rezidivierender CRSwNP nach chirurgischer Behandlung und Versagen, Unverträglichkeit oder Kontraindikation systemischer Kortikosteroide.
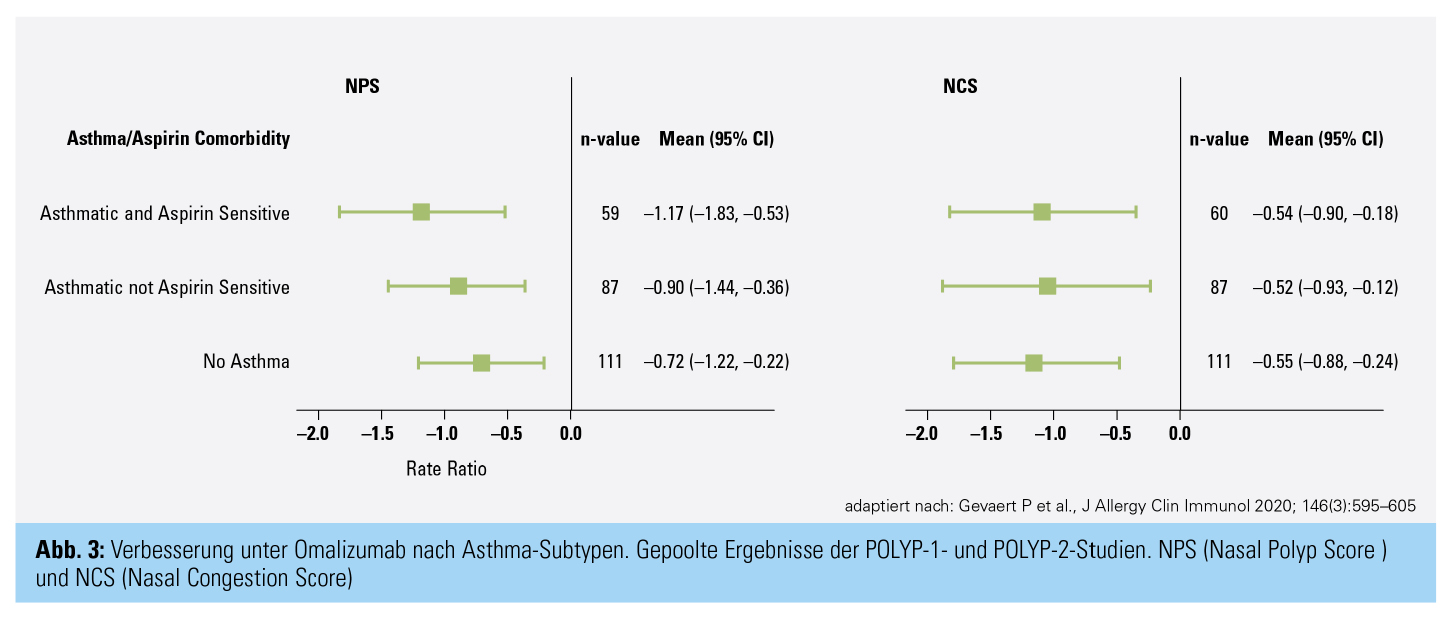
Omalizumab (Xolair®) ist ein humanisierter Antikörper, der freies IgE bindet und dadurch die Fortleitung der Entzündungskaskade an Mastzellen und basophile Granulozyten blockiert. Die Wirkung von Omalizumab auf CRSwNP wurde in zwei identen Studien, der POLYP 1 und POLYP 2, untersucht. Es konnte eine signifikante und klinisch relevante Reduktion der Polypengröße sowie, analog dazu, eine signifikante Verbesserung der subjektiven nasalen Obstruktion und des Riechvermögens festgestellt werden.15 In der Subgruppenanalyse der Patienten mit komorbidem Asthma bzw. N-ERD zeigten sich größere Reduktionen der Polypenausdehnung als bei Nichtasthmatikern (Abb. 3). Omalizumab wurde 2020 für die Behandlung der CRSwNP für Patienten zugelassen, deren Symptome mittels topischer und systemischer Steroide nicht ausreichend kontrolliert werden können. Eine allergische Anamnese ist für eine Verordnung nicht nötig. Die Dosierung orientiert sich dabei an der Asthmatherapie und wird nach Körpergewicht und IgE-Wert bestimmt. In der Asthmatherapie ist der Antikörper bereits seit 2001 zugelassen und etabliert und für Patienten mit ganzjähriger Allergien geeignet.
Mepolizumab (Nucala®) ist ein gegen IL-5 gerichteter monoklonaler Antikörper der für die Behandlung von schwerem eosinophilem Asthma zugelassen ist. In der SYNAPSE-Studie wurden 2021 die Effekte bei der Behandlung der CRSwNP evaluiert. Es konnte eine Verbesserung der subjektiven Nasenatmung sowie eine signifikante Reduktion der Polypengröße um 0,73 Punkte im NPS festgestellt werden. Die Reduktion bei den Patienten mit komorbidem Asthma bzw. N-ERD Patienten waren mit jeweils etwa 1 Punkt im NPS im Vergleich dazu ausgeprägter.16 Eine Zulassung zur Behandlung der CRSwNP gibt es derzeit noch nicht.
Reslizumab ist ein IL-5 bindender humanisierter monoklonaler Antikörper, der seit 2016 für die Behandlung vom schweren eosinophilen Asthma zugelassen ist. Derzeit ist die Datenlage für Reslizumab beim Patienten mit CRwNP begrenzt.
Benralizumab (Fasenra®) ist zur Behandlung von schwerem eosinophilen Asthma zugelassen. Es handelt sich um einen IL-5-Rezeptor-Blocker, der zu einer vollständigen Depletion der eosinophilen Granulozyten führt. Die randomisierte kontrollierte Phase-III-Studie zur Evaluierung der Auswirkung von Benralizumab auf CRSwNP wurde bereits abgeschlossen, die Daten wurden allerdings noch nicht publiziert. Eine Real-World-Studie, die den Effekt auf CRSwNP bei Asthmapatienten beschrieben hat, konnte eine Verbesserung der Symptome beschreiben.17
Tezepelumab: Die Entzündungsreaktion, die zu den klassischen Merkmalen von Exazerbationen führt, wird durch die Freisetzung von „Alarminen“ thymic stromal Lymphopoietin (TSLP), IL-33 und IL-25 aus dem Atemwegsepithel als Reaktion auf verschiedene Reize ausgelöst. Diese Alarmine lösen Entzündungsreaktionen über zahlreiche Signalwege, einschließlich Typ 2 (IL-4, IL-13 und IL-5) und andere wie Th1- oder Th17- (IL-17) aus.18 Aus diesem Grund wurden TSLP-Antikörper als therapeutische Option sowohl für Typ-2-high- als auch Typ-2-low-Asthma untersucht. In der Phase-III-Studie NAVIGATOR hat eine Therapie mit Tezepelumab zu einer relevanten Reduktion der Exazerbationen um 56 % in einem Zeitraum vom 52 Wochen im Vergleich zu Placebo bei Erwachsenen und Jugendlichen mit schwerem unkontrollierten Asthma mit und ohne Nasenpolypen geführt.19 Diese Studie hat gezeigt, dass Tezepelumab zu einem Rückgang der Exazerbationen um 86 % bei Patienten mit schwerem Asthma und komorbiden Nasenpolypen führt.20 Eine laufende randomisierte, placebokontrollierte Phase-III-Studie (WAYPOINT) untersucht die Wirksamkeit und die Sicherheit von Tezepelumab bei Patienten mit CRSwNP mit und ohne Asthma.
Ausblick: Der Einsatz von Biologika hat die therapeutischen Möglichkeiten von bisher schwierig zu behandelnden Patienten mit CRSwNP deutlich erweitert und verbessert. In der Pulmologie sind therapeutische Algorithmen, bei denen Biologika eingesetzt werden, seit Längerem fest etabliert. Eine enge interdisziplinäre Zusammenarbeit ist nötig, um in Zukunft bei Patienten alle Erkrankungen zu diagnostizieren und gemeinsam die Symptome bestmöglich zu behandeln.
- GBD 2019 Diseases and Injuries Collaborators, Lancet 2020; 396(10258):1204–22
- Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2021. available at: http://www.ginasthma.org.
- Fokkens WJ et al., Rhinology 2020; 58 (Suppl. S29):1–464
- Dietz de Loos D et al., J Allergy Clin Immunol 2019; 143(3):1207
- Hastan D et al., Allergy 2011; 66:1216–23
- Campion NJ et al., J Allergy Clin Immunol Pract 2021; S2213-2198(21)00768-6
- Tomassen P et al., J Allergy Clin Immunol 2016; 137(5):1449–1456.e4
- Khan A et al., Rhinology 2019; 57(1):32–42
- Bassiouni A et al., Laryngoscope 2013; 123(1):36–41
- Ponikau JU et al., J Allergy Clin Immunol 2003; 112(5):877–82
- Hedman J et al., Int J Epidemiol 1999; 28(4):717–22
- Lehrer E et al., Curr Allergy Asthma Rep 2014; 14(6):440
- Rajan JP et al., J Allergy Clin Immunol 2015; 135:676–681.e67
- Bachert C et al., Lancet 2019; 394(10209):1638–50 ; Erratum in: Lancet 2019; 394(10209):1618
- Gevaert P et al., J Allergy Clin Immunol 2020; 146(3):595–605
- Han JK et al., Lancet Respir Med 2021; S2213-2600(21)00097-7
- Nolasco S et al., J Allergy Clin Immunol Pract 2021; S2213-2198(21)00903-X
- Porsbjerg CM et al., Eur Respir J 2020; 56:2000260
- Menzies-Gow A et al., N Engl J Med 2021; 384:1800–09
- Menzies-Gow A et al., ERS International Congress 2021; poster number: PA876