Digitalisierung im Tumorzentrum Oberösterreich
Tumorzentren sind definiert als regionale, abgestufte Flächenversorgungsmodelle, in denen Patienten mit Krebserkrankung eine qualitätsgesicherte onkologische Behandlung erhalten. Um diesem Auftrag gerecht zu werden, braucht es heutzutage nicht nur die korrekte Erfassung der Krebsfälle in einer Tumordatenbank und eine valide medizinische Outcomemessung, sondern auch eine möglichst optimale Einbindung der digitalen Unterstützungsmöglichkeiten in der Routine-Patientenversorgung.
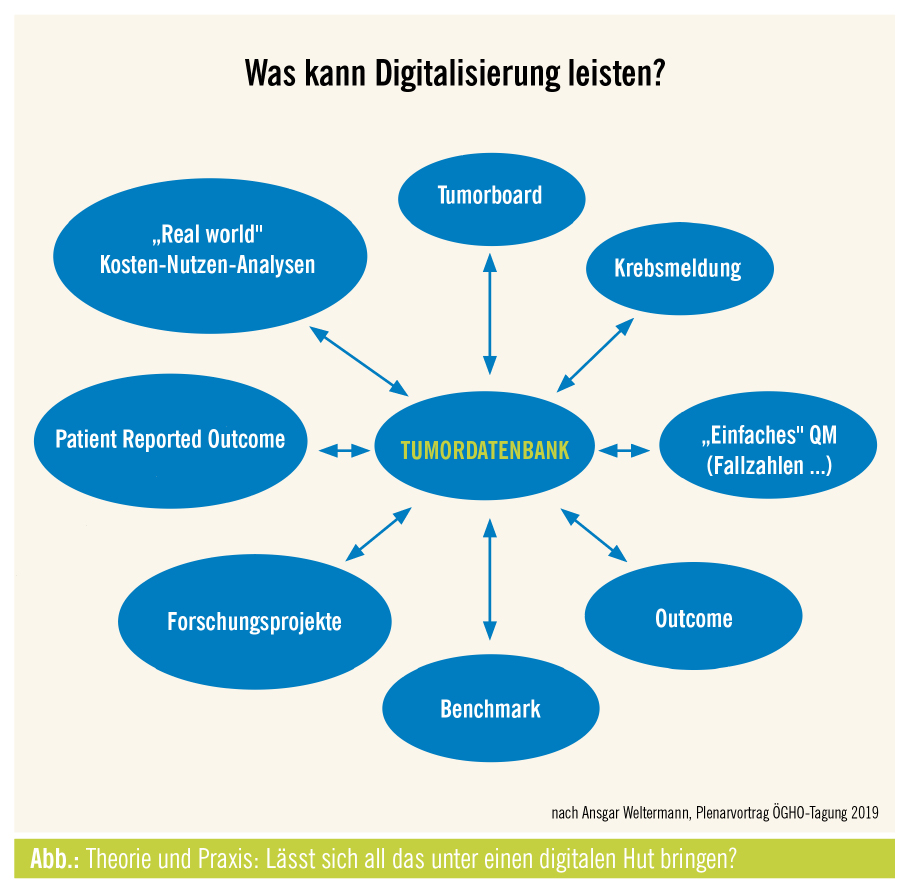
Wichtig ist, wie Univ.-Doz. Dr. Ansgar Weltermann, Leiter des Tumorzentrums Oberösterreich, berichtet, die Organisation des Tumorzentrums so zu gestalten, dass unabhängig von der Versorgungsstufe des Spitals eine Akzeptanz der in der Versorgung stehenden Mitarbeiter und der Spitalsführung gegeben ist. Eine praxistaugliche Digitalisierung, die einen entsprechenden Mehrwert sichtbar macht, ist eine notwendige Voraussetzung zur Zielerreichung. Es gibt, wie Doz. Weltermann berichtet, jedoch keine Software, die alle Anforderungen der onkologischen Versorgung (Abb.) erfüllt und sich problemlos in den klinischen Alltag integrieren lässt. Im Tumorzentrum OÖ wurde an dieser Stelle nicht mehr gefragt, welche Software gekauft werden soll, sondern welche verschiedenen Aspekte der Versorgung durch entsprechende Softwaresysteme unterstützt werden können. Begonnen wurde mit der Etablierung einer digitalen Tumordokumentation (Software celsius37 CancerCenter), die eine simultane Anbindung verschiedener Krankenhausinformationssyteme (KIS) sowie die Abwicklung spitalsübergreifender Tumorboards ermöglicht.
Univ.-Doz. Dr. Ansgar Weltermann: Was wir mit der Datenerfassung generieren, sind Small Data, also Daten, die mit unserem Vorstellungsvermögen und klassischen Auswertemethoden noch zu verarbeiten sind. Tumordokumentation ist ein strukturiertes Erfassen von Werten, aus denen wir relevante Kennzahlen ableiten. Wenn wir das Diagnose- und das Sterbedatum wissen, können wir das Gesamtüberleben bestimmen. Das heißt, wir erheben Werte mit dem Ziel zu wissen, wie es um unsere Behandlungsqualität steht. In Wirklichkeit sind es handverlesene Datensätze, die exakt erhoben werden müssen, damit man sehr valide Aussagen treffen kann. Es bleibt bei allem Wunsch nach einem automatisierten System immer noch viel Handarbeit in der Datenerfassung. Der Grund ist, dass Informationen nie so strukturiert aufbereitet sind, dass man sie eins zu eins übernehmen kann. Beispielsweise erfordert die Zuordnung eines strukturiert erfassten Pathologiebefundes immer noch die manuelle Zuordnung zu einem Tumor, da der Patient ja nicht nur einen Tumor aufweisen könnte. Die Datenerfassung ist ohne Hausverstand nicht möglich. Die Digitalisierung ermöglicht, dass Informationen häuserübergreifend erfasst werden und abrufbar sind. Der digitale Patientenakt kann mit seinen Tumorverlaufsdaten von einem Spital ins andere mitgehen und dort weiter dokumentiert werden. Selbst wenn der Patient in mehreren Spitälern behandelt wurde, kann man im Tumorboard auf den gesamten Behandlungsverlauf digital zugreifen.
Pro Jahr kommen derzeit etwa 5.500 neue Fälle dazu. Diese Fallzahlen ermöglichen uns, über eine große Population einer Region aussagekräfte Ergebnisse zur Behandlungsqualität zu erhalten. Mit der Möglichkeit, diese Daten erfassen und auswerten zu können, taucht gleichzeitig die Frage auf, wer Zugriff auf diese Daten hat. Unerlässlich ist ein Berechtigungskonzept, wer aus der Datenbank Analysen vornehmen darf bzw. diese freigeben kann –zum Beispiel für wissenschaftliche Projekte. Dabei geht es nicht nur um Patientenschutz, sondern auch um Mitarbeiterschutz. Bei der Erstellung des Datenberechtigungskonzeptes haben wir daher auch Betriebsräte und Juristen einbezogen (siehe www.tumorzentrum.at).
Für die Erfassung von PRO werden wir eine eigene Software verwenden. Auch hier besteht die große Herausforderung, wie wir die Expertensysteme vernetzen, damit wir Daten nicht doppelt erheben. Wir haben begonnen, im Bereich der Psychoonkologie den Schweregrad der Belastungsreaktion des Patienten zu erfassen, den die Experten beim Patienten erheben. Das ist allerdings noch eine externe Einschätzung, die nicht vom Patienten selbst kommt. Die Daten werden über ein Data-Warehouse mit den klinischen Daten aus der Tumordokumentationssoftware verknüpft. Unsere Erfahrung zeigt auch hier: eine Software anzuschaffen ist leicht. Leicht ist es auch, eine Software so zu gestalten, dass man Daten strukturiert erfassen kann. Schwieriger ist es, diese Software in den Alltag zu integrieren. Man muss Ärzte und Patienten, die alle unterschiedliche Voraussetzungen mitbringen, davon überzeugen, die Software zu verwenden. Dass ein Patient z. B. seine Symptome eingibt, kann gut, weniger gut oder gar nicht gemacht werden. Beispielsweise ist zu klären, wer im Alltag die Schulung der Patienten durchführt. In Studien lässt sich so etwas leichter durchführen als in der Routine. Aber natürlich: Eine systematische Erfassung der Lebensqualität des Patienten inklusive Medikamentennebenwirkungen, welche dem Arzt digital zur Verfügung gestellt wird, wäre phantastisch, nicht nur in Zeiten von Corona.
Versorgungskonzepte in Regionen mit 1–2 Mio Einwohnern sind sinnvoll und seitens der Prozessorganisation umsetzbar. Entsprechende regionale Einteilungen wurden ja bereits mit dem ÖSG vorgenommen. Die verschiedenen regionalen Versorgungsstrukturen (Tumorzentren) sollten sich verstärkt untereinander austauschen, nicht zuletzt um eine Vergleichbarkeit der Daten zu gewährleisten. Andererseits muss klar sein, dass eine Vergleichbarkeit von Patienten in verschiedenen Einzugsbereichen nicht immer gegeben ist. Ich halte wenig von Aussagen im Sinne eines Rankings, dass im Bundesland X Patienten mit einer bestimmten Krebserkrankung länger leben. Die Behandlungsmöglichkeiten hängen beispielsweise von der Grundkonstitution der Menschen ab, die in einer Region leben. Für einen korrekten Vergleich von Outcomedaten ist es zudem erforderlich, dass wir Daten in analoger Weise erheben, damit die Datenqualität und -validität vergleichbar sind. Wir haben im Tumorzentrum OÖ eine Stelle für Data Clearing geschaffen, um den Tumordokumentaren in den Spitälern Rückmeldung über die Datenqualität zu geben, z. B. wenn Eingaben nicht vollständig oder nicht plausibel sind. Es können nur Daten verglichen werden, die qualitativ gleichwertig sind.
Wir haben derzeit das Problem, dass Medikationen je nach Applikationsart (oral oder parenteral) in unterschiedlichen Softwaresystemen erfasst werden. Beispielsweise gibt es keine etablierten Standardschnittstellen zwischen onkologischer Medikation im KIS-System und Softwareprodukten zurChemotherapieherstellung oder Tumordokumentationssoftware. Wir entwickeln gerade ein Konzept, wie die verschiedenen Expertensysteme untereinander kommunizieren können und die Medikationsdaten an das Klinische Krebsregister semiautomatisch weitergegeben werden können. Dabei sind Auflagen wie Datenschutz und Medizinproduktegesetz zu beachten. Wir haben das System ELGA-konform aufzusetzen, damit auch das, was im Spital verschrieben wird, in einem Arztbrief entsprechend abgebildet werden kann. Eine stabile Vernetzung der verschiedenen IT-Systemen ist sehr komplex. Wir stecken diesbezüglich in den Kinderschuhen. Schön wäre, wenn wir auf absehbare Zeit beispielsweise die Dosisdichte medikamentöser Therapien ohne zusätzlichen Aufwand erfassen können.
Ich finde es gut, wenn man als Arzt in einem Aufklärungsgespräch die eigenen Behandlungsergebnisse konkret mit Zahlen zeigen kann. Das schafft auf Arzt- und Patientenseite großes Vertrauen. Ob man deshalb detaillierte Ergebnisse der Behandlungsqualität öffentlich macht, ist sehr gut zu überlegen. Bspw. hat das Klinische Krebsregister in Bayern vor Jahren Kaplan-Meier-Kurven auf seiner Website präsentiert. Sie haben diese Information wieder heruntergenommen, weil die Ergebnisse ohne entsprechende fachliche Interpretation, wie es beispielsweise bei einer Publikation erfolgt, zur Verunsicherung geführt haben. Statt Transparenz schafft man einen Erklärungsnotstand. Unterschiede im Outcome beruhen ja oft in einer fehlenden Vergleichbarkeit von Real World Data und Phase III Studienergebnissen. Wir stellen den Fachexperten, die die Medizinischen Leitlinien erstellen, die eigenen Outcome-Daten zur Diskussion im Qualitätszirkel zur Verfügung. Spannend war auch die Diskussion mit dem international besetzten Auditorenteam bei der EUSOMA-Zertifizierung unseres Brust-gesundheitszentrums: der Fokus lag nicht nur auf der Erfüllung standardisierter Kennzahlen, sondern in der Bewertung, welche Verbesserungen die Fachexperten des Tumorzentrums aus den eigenen Behandlungsergebnissenfür die klinische Routine abgeleitet haben. Das war extrem lehrreich und spannend.
Es hängt von der Entität ab: wir besprechen über 95 % der Brustkrebspatientinnen im Tumorboard, und zwar vor Einleitung einer Therapie. Beim Melanom liegt man automatisch niedriger, da nur die fortgeschrittenen Tumoren im Tumorboard besprochen werden. Bei hämatologischen Erkrankungen wie bei einer akuten Leukämie muss der Arzt sofort handeln und kann nicht auf das nächste Tumorboard warten. In Bereichen mit Zertifizierung ist die Einbringung von Patienten ins Tumorboard sehr hoch, in anderen Bereichen bedeutet es viel Prozessarbeit, um die Rate sukzessive zu heben. Es werden inzwischen in allen Fachbereichen mindestens 50 % Patienten mit Erstdiagnose oder Rezidiv in ein interdisziplinäres Board eingebracht. Wir unterscheiden dabei Nennfälle von Besprechungsfällen: Bei Ersteren ist der Therapiealgorithmus so klar, dass wir den Fall nicht besprechen müssen und so mehr Zeit für die Fälle bleiben, bei denen die Diskussion notwendig ist, um den optimalen Behandlungspfad festzulegen. Tumorboards finden in manchen Fachbereichen spitalsübergreifend statt, Brustkrebs zählt dazu. Sinn macht es v. a. bei seltenen Entitäten wie etwa beim Sarkom. In erster Linie ist es die Kommunikation zwischen den Experten und nicht die Technik, die ein spitalsübergreifendes Tumorboard gelingen lässt. Der fachliche Mehrwert muss im Verhältnis zum Mehraufwand stehen. Wir sind so etwas in Österreich nicht wirklich gewohnt. Es braucht ein Commitment für diese Art des Miteinanders. Wir sensibilisieren bspw. die ärztlichen Kollegen, welche Aufgaben mit der Leitung des Tumorboards verbunden sind, z. B., dass alle Beteiligten gehört werden und eine interdisziplinäre Empfehlung erarbeitet wird.
Wir entwickeln mit dem Hersteller unser Tumordokumentation gerade ein Konzept, wie wir NGS-Daten im Krebsregister und im Tumorboard abbilden können. Unser Hersteller arbeitet auch in Deutschland und in Irland, wo ähnliche Anforderungen bestehen. Das Projekt erfolgt gemeinsam mit Herrn Dr. Gerald Webersinke aus dem Labor für Molekulargenetische Diagnostik und mit Herrn Dozent Holger Rumpold, Leiter des Viszeralonkologischen Zentrums im Ordensklinikum. Bei den molekularen Befunden verhält es sich nicht wie bei einem Laborwert: Es geht einerseits um eine fachliche Einschätzung durch den Molekularbiologen, welche biologische Relevanz man dem Ergebnis beimisst, oder ob es vielleicht nur ein Zufallsbefund ist. Mit der ESCAT-Klassifikation wird die klinische Relevanz beurteilt. Am Ende bleiben oft nur wenige genetische Veränderungen (core gene mutations) übrig, die in der Tumordokumentation abgebildet und in einem molekularen Tumorboard bewertet werden müssen. Für die Auswertung des NGS-Panels gibt es zwar Softwareprogramme, trotzdem ist derzeit eine zeitintensive Bewertung der Ergebnisse durch einen Molekularbiologen notwendig. Unterm Strich sind es nur einige Veränderungen, die für Patienten eine Bedeutung haben.
Es ist sicher einer der Vorteile unser Tumordokumentation, dass wir sehr schnell und sehr sicher sagen können, wie viele Patienten wir in der Region mit einer Erkrankung haben, die wir potentiell in eine Studie mit den vorgegebenen Selektionskriterien einbringen können. Zudem können auf dem Boden einer validen Tumordokumentation auch eigene wissenschaftliche Projekte erfolgen. Hier steigen die Möglichkeiten mit Ausweitung der Tumorbiobank. Ein zusätzlicher Punkt ist die Möglichkeit eines Horizon Scannings: wenn sich in einer Indikation die Behandlung durch ein neues Medikament ändert, können wir gut abschätzen, wie viele Patienten wir in dieser Indikation pro Jahr behandeln und mit welchen Kosten die Spitalsträger im Folgejahr zu rechnen haben. Bei der Vergabe von klinischen Studien bleiben wir durch das Netzwerk der Spitäler international kompetitiv, was die Fallzahlen betrifft. Hierzu sind internationale Vergleiche interessant. In Italien hat das durchschnittliche Brustgesundheitszentrum 800 Neudiagnosen pro Jahr. Das erreicht kein einziges Zentrum in Österreich. In OÖ sind wir mit dem Ordensklinikum Linz, dem Krankenhaus Ried und den Regionalkliniken der Gesundheitsholding OÖ aktuell bei 600 Brustkrebs-Neudiagnosen im Jahr. Dann hat man auch eine Größe, die international kompetitiv ist.
In Oberösterreich wurden mehrere Personen angestellt, die sich um die Vernetzung und Systementwicklung kümmern. So etwas geht nur voran, wenn man in den Spitälern des Tumorzentrums Ärzte findet, die sich die Zeit nehmen, sich mit der Weiterentwicklung des Tumorzentrums zu beschäftigen. Wir haben vor sechs Jahren begonnen und vieles ist gut auf Schiene. Es gibt bereits sehr valide Daten zuoperativen Ergebnissen (R0-Resektionsrate) und zum Stadien- und Tumorentität-bezogenen Überleben von Patienten. Wir sehen auch, dass in der Behandlungsqualität durch die Einführung von Qualitätszirkeln einiges besser geworden ist. Eine Steigerung der Behandlungsqualität kann man nur in Bereichen belegen, in denen wir seit einigen Jahren Daten wirklich systematisch erfasst haben.