Focus Blase: Das Harnblasenkarzinom
Risikofaktor Tabakrauch
Blasenkrebserkrankungen sind in Österreich mit 4,6% aller Tumordiagnosen die häufigsten malignen Tumoren des Harntrakts, die zweithäufigste Tumorentität des Urogenitalsystems nach dem Prostatakarzinom. Etwa ein Drittel aller Fälle wird durch Tabakrauch verursacht.
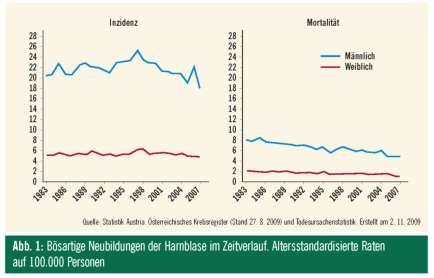
Das Krebsregister listet das Blasenkarzinom bei Männern an der 4. und bei Frauen an der 8. Stelle, bei den Todesursachen ist es die zehnt- und elfthäufigste Ursache. Männer haben ein etwa dreimal höheres Erkrankungsrisiko (Abb. 1). Das Durchschnittsalter bei Diagnose ist bei Männern 70, bei Frauen 73 Jahre. Weniger als 5% der Neuerkrankungen werden vor dem 30. Lebensjahr diagnostiziert. Inzidenz und Mortalität nahmen im letzten Jahrzehnt ab, die Fünfjahresüberlebenszeit aller Tumorstadien beträgt beim Mann 78% und bei der Frau 72%.
Ätiologie und Risikofaktoren
Das Blasenkarzinom wird sowohl durch exogene als auch endogene Karzinogene ausgelöst, ist also meist multifaktorieller Ursache. Etwa ein Drittel aller Fälle wird durch Tabakrauch verursacht: Chronischer Konsum erhöht das Risiko um den Faktor 2-8, abhängig von der Zahl der insgesamt gerauchten Zigaretten, der Intensität des Rauchens, den Inhaltsstoffen (Teergehalt etc.) und der Gesamtzeit. Die Latenzzeit liegt zwischen 10 und 30 Jahren. Weitere exogene krebserregende Stoffe sind industrielle Karzinogene, vor allem die aromatischen Amine (Textilfarben- und Gummiindustrie, Chemikalienherstellung, Glas- und Kunststoffindustrie), Phenacetinmetaboliten und Zytostatika. Bilharziose (Infektion mit Schistosoma haematobium) ist mit dem selteneren Plattenepithelkarzinom der Harnblase assoziiert (v. a. Mittlerer Osten/Afrika und dort die häufigere Tumorart). Chronische Entzündungen der Blasenmukosa sowie Bestrahlung des kleinen Beckens stellen ebenfalls potenziell neoplasieinduzierende Prozesse dar.
Klassifikation der Blasenkarzinome
Über 90% der Harnblasenkarzinome gehen vom Urothel aus, wesentlich seltener sind Plattenepithelkarzinome, Adenokarzinome (inklusive Urachuskarzinom) und sekundär infiltrierend wachsende Tumoren aus den benachbarten Organstrukturen sowie Metastasen anderer Primärtumoren (Magen-, Mamma-, Bronchuskarzinom oder Melanom). TNM-Klassifizierung der UICC (Union Internationale Contre le Cancer) 2002 siehe Tab.
|
Tab.: TNM-Klassifizierung der UICC |
|
|---|---|
|
Ta |
Nichtinvasives papilläres Karzinom des Urothels |
|
Tcis |
Nichtinvasives Carcinoma in situ |
|
T1 |
Einwachsen unter die Schleimhaut in das submuköse Bindegewebe (Unterformen: T1a: oberhalb der Schleimhautmuskelschicht; T1b: unterhalb der Schleimhautmuskelschicht) |
|
T2 |
Einwachsen in die Muskelschicht der Harnblase (Unterformen: T2a: innere Hälfte, T2b: bis in die äußere Hälfte) |
|
T3 |
Hinauswachsen über die Muskelschicht der Harnblase (Unterformen: T3a: nur mikroskopisch erkennbar, T3b: mit dem bloßen Augen sichtbar |
|
T4 |
Einwachsen in Nachbarorgane (Unterformen: T4a: Prostata, Gebärmutter, Scheide T4b: Becken- oder Bauchwand) |
|
N0 |
Keine lokalen Lymphknoten befallen |
|
N1 |
Einzelner befallener Lymphknoten kleiner als 2 cm |
|
N2 |
einzelner Lymphknoten von 2-5 cm Durchmesser, oder mehrere befallene Lymphknoten < 5 cm |
|
N3 |
Lymphknoten über 5 cm |
|
M0 |
Keine Fernmetastasen nachgewiesen |
|
M1 |
Fernmetastasen nachgewiesen |
|
Ta, Tcis und T1 sind nichtmuskelinvasive Tumoren, Stadium > T1 entspricht muskelinvasivem Tumorwachstum |
|
Grading nach WHO 2004 (G1-G3 WHO 1973):
-
urotheliales Papillom
-
papilläre Neoplasie von niedrigmalignem Potenzial (PUNLMP)
-
Low Grade: entspricht Gl: gut differenziert und G2: mäßig differenziert
-
High Grade: entspricht G3: schlecht bis undifferenziert
Die Leitlinien der European Association of Urology empfehlen grundsätzlich die Anwendung der WHO-Klassifikation 2004. Die aktuellen Guidelines basieren bei den nichtmuskelinvasiven Blasentumoren auf der Klassifikation von 1973 und bei den muskelinvasiven Tumoren auf beiden Einteilungen, die häufig parallel verwendet werden.
Klinik und Diagnose
Typisches Erstsymptom ist in über 70% der Fälle die schmerzlose Makrohämaturie. Dysurische Beschwerden im Sinne einer irritativen Symptomatik sind in etwa 30% beschrieben. Ostiennahe Tumoren oder größere Tumormassen können eine Hydronephrose verursachen. Schmerzen, Abnahme der Blasenkapazität und typische Begleitsymptomatik einer Malignomerkrankung werden als so genannte Spätsymptome beschrieben. Basis jeder Abklärung eines fraglichen Blasentumors ist die Zystoskopie, die bei jeder Hämaturie des Mannes, rezidivierenden schmerzlosen Hämaturien der Frau und persistierenden dysurischen Beschwerden oder auffälliger Sonographie erfolgen muss. Die zytologische Untersuchung des Harns hat bei Low-Grade-Karzinomen zwar nur eine Sensitivität von unter 40%, aber 75-95% bei High-Grade-Karzinomen G2/3 und 95% bei CIS mit einer Spezifität von 95%. Tumormarker gibt es in der Routinebefundung noch nicht. Die Bildgebung umfasst die Sonographie bei voller Blase, Nieren und Prostata sowie ein CT-Urogramm beim muskelinvasiven Blasentumor. Ein Lungenröntgen erfolgt routinemäßig bei Diagnose und in der Nachsorge von infiltrativ wachsenden Tumoren. 60-70% aller Blasenkarzinome wachsen multifokal, die häufigsten Lokalisationen sind die Seitenwände, die Hinterwand sowie das Trigonum.
Nichtmuskelinvasives Blasenkarzinom (pTa, pTCis, pT1)
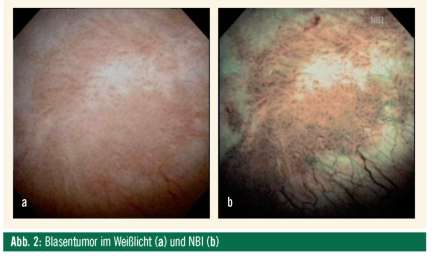
Therapie: Die transurethrale Resektion, idealerweise bipolar, hat diagnostische und kurative Zielsetzung. Bei einer Tumorgröße von > 1 cm erfolgt eine fraktionierte Resektion des Gewebes bis in die Blasenwandmuskulatur inklusive Randbiopsien. Eine Biopsie der prostatischen Harnröhre wird bei Tumoren am Blasenhals oder CIS zusätzlich gefordert. Eine verbesserte Sichtbarkeit der Veränderungen kann durch den Einsatz der photodynamischen Diagnostik (PDD) durch präoperative Installation eines Photosensitizers sowie des “Narrow-Band-Imaging” (NBI) erzielt werden (Abb. 2).
Postoperativ wird für alle Stadien eine einmalige adjuvante intravesikale Chemoinstallationstherapie innerhalb von 6 Stunden empfohlen. Epirubicin und Mitomycin C wurden dazu in großen Studien getestet. Tumoren mit einem hohen Risiko für eine Progression im Verlauf (pTaT1G3 +/- begleitendes CIS sowie CIS alleine) müssen jedenfalls einer Re-TURB nach zwei bis sechs Wochen zugeführt werden. Im Anschluss muss eine Installationsserie mit BCG (Bacillus Calmette et Guerin) und Maintenance für mindestens ein Jahr durchgeführt werden. Multiple Tumoren und pTaT1G2-Tumoren erhalten eine adjuvante Instillations-serie eines Chemotherapeutikums. BCG wirkt auch bei dieser Gruppe im Vergleich besser, allerdings mit größerer Toxizität.
Nachsorge: Rezidiv- und Progresswahrscheinlichkeit kann mit Hilfe des “Blad-der-Risk-Calculator” abgeschätzt werden (http://www. eortc.be/tools/bladdercalculator/).
Das Ergebnis der Zystoskopie 3 Monate postoperativ ist ein wichtiger prognostischer Faktor. Bei negativem Befund kann die nächste Blasenspiegelung 9 Monate postoperativ und dann jährlich einmal für 5 Jahre erfolgen. Hohes Rezidiv- und Progressionsrisiko bedarf alle 3 Monate einer zystoskopischen Kontrolle für 2 Jahre, alle 4 Monate im 3. Jahr und alle 6 im 4. und 5. Jahr, anschließend einmal jährlich. Zusätzlich wird jährlich eine Kontrolle des oberen Harntraktes empfohlen. Mittelgradiges Progressionsrisiko sollte sich individuell zwischen den oben angeführten Nachsorgeschemata orientieren.
Muskelinvasives Blasenkarzinom
Die radikale Zystektomie ist die Therapie der Wahl. Obligat ist die Lymphadenektomie, deren Ausmaß aber nicht definiert ist. Fakultativ kann eine Zystektomie bereits bei pT1G3-Tumoren und bei therapierefraktären CIS erfolgen. Die Harnableitung erfolgt je nach Eignung der Patienten über eine kontinente orthotope Ersatzblase, über die Zwischenschaltung eines Darmsegmentes mit kontinuierlicher Ableitung über ein Stoma (Ileum-Conduit) oder – heute selten – in den intakten Dickdarm (Sigma-Blase).
Neoadjuvante cisplatinhältige Chemotherapie verbessert das 5-Jahres-Überleben um 5-7%, adjuvante Chemotherapie sollte weiterhin nur in Studien angewendet werden.
Metastasiertes Blasenkarzinom
Die Metastasierung erfolgt vor allem in die regionären Lymphknoten des kleinen Beckens, aber auch in Leber, Lunge und Skelett. Je niedriger der Differenzierungsgrad und je tiefer die Blasenwandinfiltration, desto höher die Metastasierungswahrscheinlichkeit. Im Vergleich beträgt die Absiedelungsrate beim Stadium pTa < 1% und bei pT2/3 bereits 30-60%. Urothelkarzinome sind chemosensitiv. Guter Performance-Status und viszerale Metastasen sind unabhängige Prognosefaktoren. Mit cisplatinhältigen Kombinationen kann eine mittlere Überlebenszeit aller Stadien von 14 Monaten erreicht werden.
Prim. Priv.-Doz. Dr. Walter Albrecht
Urologische Abteilung Landesklinikum Weinviertel Mistelbach
Ass. Dr. Clemens Heßler
Urologische Abteilung Landesklinikum Weinviertel Mistelbach
Literatur:
– Babjuk M et al., Eur Urol 2008; 54:303-14
– Stenzl A et al., Eur Urol 2009; 55:815-25
Weitere Literatur bei den Verfassern