Merkelzellkarzinom (MCC) – Merkelzell-Polyomavirus: Kein Einfluss auf klinischen Verlauf
Das Merkelzellkarzinom (MCC) war bis vor Kurzem eine Tumorentität, die selbst unter Dermatologen kaum beachtet wurde. Dabei ist das MCC der aggressivste Hauttumor mit einer krankheitsbedingten Sterberate von mehr als 33 %. Die Inzidenz ist trotz einer Verdreifachung in den letzten 25 Jahren mit 0,18–0,41 pro 100.000 immer noch sehr niedrig (BECKER, et al. 2009). Die Wahrnehmung des MCC änderte sich 2008 schlagartig, als ein neues Polyomavirus, das Merkelzell-Polyomavirus (MCV), in den meisten MCC identifiziert wurde (FENG, et al. 2008).
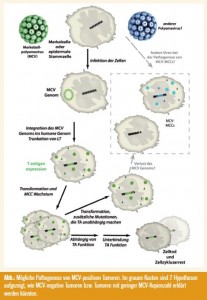
Virale Pathogenese? Für eine Rolle des MCV bei der MCC-Ätiologie spricht die klonale Integration in den meisten MCC, also bereits vor der klonalen Expansion und Metastasierung der Tumorzellen. Ein weiterer Beleg für eine virale Pathogenese ist die Abhängigkeit von MCV-positiven MCC-Zellen von der Expression der MCV-kodierten T-Antigene (HOUBEN, et al. 2010). Nachdem sich das MCV in nur ca. 85 % der MCC nachweisen lässt, stellt sich jedoch die Frage, ob das MCC unterschiedliche Pathogenesen haben kann und inwieweit sich MCV-negative und MCV-positive MCC-Tumoren unterscheiden.
Studie: Unterschiede zwischen MCVnegativen und MCV-positiven Tumoren
Letzteres untersuchten wir in einer der größten Studien zum MCC mit 234 Tumoren bei 174 MCC-Patienten, inklusive 38 australischen Patienten (SCHRAMA, et al. 2011b). Diese wurden eingeschlossen, weil für diese Patientengruppe eine relativ geringe MCV-Positivität beschrieben ist. In beiden Patientengruppen, also Europäer und Australier, konnten wir das MCV in ca. 85 % der Fälle nachweisen. Patienten mit mehreren Tumoren wiesen für alle ihre Tumoren den gleichen MCV-Status auf.
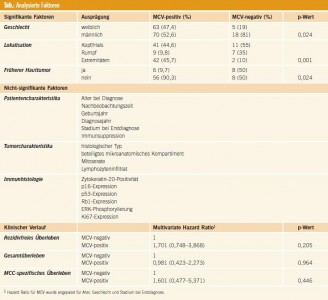
Beim Vergleich der MCV-positiven und MCV-negativen Tumoren zeigte sich, dass Frauen häufiger MCV-positive Tumoren haben als Männer (p = 0,024) – eine Tendenz, die sich auch in der Gesamtschau aller bisher veröffentlichten Studien findet. Des Weiteren unterscheidet sich die Lokalisation der Primärtumoren signifikant (p = 0,001); MCV-positive Tumoren finden sich seltener am Rumpf, sondern häufiger an sonnenlichtexponierten Stellen wie Kopf und Extremitäten. Ein dritter signifikanter Unterschied war, dass Patienten mit MCV-negativen Tumoren häufiger bereits an einem Hauttumor erkrankt waren (p = 0,024). Alle anderen analysierten Faktoren (siehe Tab.) unterschieden sich jedoch nicht signifikant. Ebenso konnte kein Unterschied für rezidivfreies Überleben, Gesamtüberleben und Merkelzell-spezifisches Überleben weder bei Kaplan-Meier-Analysen, noch bei uni- und multivariaten Cox-Regressionsanalysen aufgedeckt werden.
Resümee
In unserer Studie konnten wir keine klinisch relevanten Unterschiede bezüglich Tumorcharakteristika und klinischem Verlauf feststellen. Dies deckt sich zum Teil mit anderen Publikationen, jedoch wurden aber auch Unterschiede in der Prognose für MCV-positive und MCV-negative MCC berichtet. Dabei weisen die Patienten mit MCV-positiven Tumoren bzw. dem höheren Virus Load eine bessere Prognose auf (BHATIA, et al. 2010; SIHTO, et al. 2009). Es werden wohl noch mehrere Studien sowie eine anschließende Metaanalyse nötig sein, um für diesen seltenen Tumor eine endgültige Aussage treffen zu können. Ferner wird man auch der Frage nachgehen müssen, ob es sich um zwei unterschiedliche Pathogenesen handelt. Denkbar ist zum Beispiel, dass MCV bei der Initiierung benötigt wird, aber später verloren gehen kann. In der Tat konnten wir in einer von 8 MCV-positiven MCCZellen beobachten, dass diese nicht mehr von der Expression der T-Antigene abhängig war (HOUBEN, et al. 2011). Eine weitere Möglichkeit stellt die Infektion mit anderen Viren dar (Abb.). Zumindest aber die neu identifizierten HPyV6 und -7 können wir diesbezüglich ausschließen (SCHRAMA, et al. 2011a).
Literatur:
1 Becker JC, Schrama D, Houben R. Merkel cell carcinoma. Cell Mol Life Sci 2009; 66(1): 1-8
2 Bhatia K, Goedert JJ, Modali R, Preiss L, Ayers LW. Merkel cell carcinoma subgroups by Merkel cell polyomavirus DNA-relative abundance and oncogene expression. Int J Cancer 2010; 126(9): 2240-6
3 Feng H, Shuda M, Chang Y, Moore PS. Clonal integration of a polyomavirus in human Merkel cell carcinoma. Science 2008; 319(5866): 1096-100
4 Houben R, Grimm J, Willmes C, Weinkam R, Becker JC, Schrama D. Merkel cell carcinoma and Merkel cell polyomavirus: Evidence for hit-and-run oncogenesis. J Invest Dermatol 2011 5 Houben R, Shuda M, Weinkam R, Schrama D, Feng H, Chang Y, Moore PS, Becker JC. Merkel cell polyomavirus-infected Merkel cell carcinoma cells require expression of viral T-antigens. J Virol 2010; 84(14): 7064-72
6 Schrama D, Buck CB, Houben R, Becker JC. No evidence for association of HPyV6 or HPyV7 with different skin cancers. J Invest Dermatol 2011a
7 Schrama D, Peitsch WK, Zapatka M, Kneitz H, Houben R, Eib S, Haferkamp S, Moore PS, Shuda M, Thompson JF, Trefzer U, Pfohler C, Scolyer RA, Be – cker JC. Merkel cell polyomavirus status is not associated with clinical course of Merkel cell carcinoma. J Invest Dermatol 2011b; 131(8): 1631-8
8 Sihto H, Kukko H, Koljonen V, Sankila R, Bohling T, Joensuu H. Clinical factors associated with Merkel cell polyomavirus infection in Merkel cell carcinoma. J Natl Cancer Inst 2009; 101(13): 938-45