Wnt1 blockiert die Lymphangiogenese im Melanom
Die Gefährlichkeit des Melanoms besteht darin, dass es frühzeitig Metastasen über die Lymph- und Blutbahn bildet. Die ersten Metastasen finden sich in den Lymphknoten, die dem Melanom am nächsten sind. Daher ist es wichtig, nach Proteinen zu forschen, welche die Lymphangiogenese hemmen.
In einer kürzlich publizierten Arbeit (Niederleithner et al. 2012) wurde Wnt1 als ein solcher antilymphatischer Faktor im Melanom gefunden. Es wirkt, indem es die melanomabhängige VEGF-C-Expression hemmt. VEGF-C (Vascular endothelial growth factor-C) ist der beste Regulator der Lymphangiogenese (Rinderknecht und Detmar 2008), und es besteht eine positive Korrelation zwischen VEGF-C-Expression, Lymphangiogenese und Metastasierung.
Wnt1 ist eines von 19 sezernierenden Wnt-Proteinen, das durch Bindung an Rezeptoren verschiedene Signalwege aktivieren kann (Staal 2008):
- den kanonischen Wnt-Signalweg, bei dem es zu einer Lef/Tcf-abhängigen Transkription kommt (Abb. 1).
- den nichtkanonischen AP-1-Signalweg, bei dem es zu einer Jun-abhängigen Transkription kommt.
- den nichtkanonischen NFAT-Signalweg, bei dem es zu einer NFAT-abhängigen Transkription kommt.
Der Wnt-Signalweg ist essenziell in der normalen Embryonalentwicklung, aber er wird auch in einigen Tumoren aktiviert, die meistens eine schlechte Prognose haben. Das bekannteste Beispiel ist das Tumorsuppresorgen APC („adenomatous polyposis coli protein“), das im Wnt-Signalweg zu einer nukleären Lokalisation von b-Catenin führt und mit einem hohen Risiko für Darmkrebs verbunden ist.
Welche Rolle Wnt1 in der Angiogenese spielt, ist noch nicht genau erforscht. Bekannt ist, dass viele kanonische Wnt-Target-Gene proangiogene Regulatoren sind, wie z. B. Ephrine, FGF-2, FGF-18, uPar, MMP7 und MMP3. Weiters ist publiziert, dass Wnt1 die Angiogenese in vitro induzieren kann und dass Mutationen in Wnt- und Fzd-Genen zu einer veränderten Gefäßbildung führen. Unklar ist hingegen, ob Wnt1 auch eine Rolle in der Lymphangiogenese spielt. Daher war das Ziel dieser Studie, zu analysieren, welchen Effekt Wnt1 auf Melanomzellen hat, um Blut- und Lymphgefäße zu rekrutieren.
Methoden und Ergebnisse
Als erster Schritt wurde untersucht, ob Melanomzellen mit aktiviertem Wnt-Pathway ein anderes Profil an angiogenen Faktoren ausschütten als die, die Wnt1-negativ sind. Dafür wurde Wnt1 stabil in 2 Wnt1-negativen Melanomzelllinien (A375 und M24met) überexprimiert. Mittels eines „spheroid sprouting assays“ wurden lymphatische Endothelzellen (genannt LEC) mit Überständen (ÜS) von Wnt1-negativen Melanomzellen (Kontrollzellen) und von Wnt1-positiven Melanomzellen stimuliert. Überraschenderweise konnten ÜS von Wnt1-überexprimierenden Melanomzellen kein „LEC-sprouting“ induzieren. Mischt man hingegen Überstände von Wnt1- und VEGF-C-überexprimierenden Zellen oder von Wnt1-negativen und Wnt1-positiven Zellen, so führt dies wiederum zu „sprouting“.
Melanomzellen produzieren in der Regel hohe Mengen an VEGF-C. Wir konnten zeigen, dass eine Überexpression von Wnt1 in manchen Melanomzellen zu reduzierter VEGF-C-Expression führt. Daher wurde im nächsten Schritt untersucht, durch welchen Signalweg Wnt1 die VEGF-C-Expression hemmt. Durch spezifische Inhibitoren (rDNTcf und DKK-1) konnte der kanonische Signalweg ausgeschlossen werden. Auch der nichtkanonische AP-1-Weg ist nicht für das Inhibieren von VEGF-C verantwortlich. Hingegen ist der nichtkanonische Calcineurin/NFAT-Weg daran beteiligt, denn durch die Teilnahme des Calcineurininhibitors Cyclosporin-A (CsA) wurde die VEGF-C-Expression in Wnt1-negativen Melanomzellen wieder erhöht. Dies konnte sowohl in vitro als auch in vivo gezeigt werden.
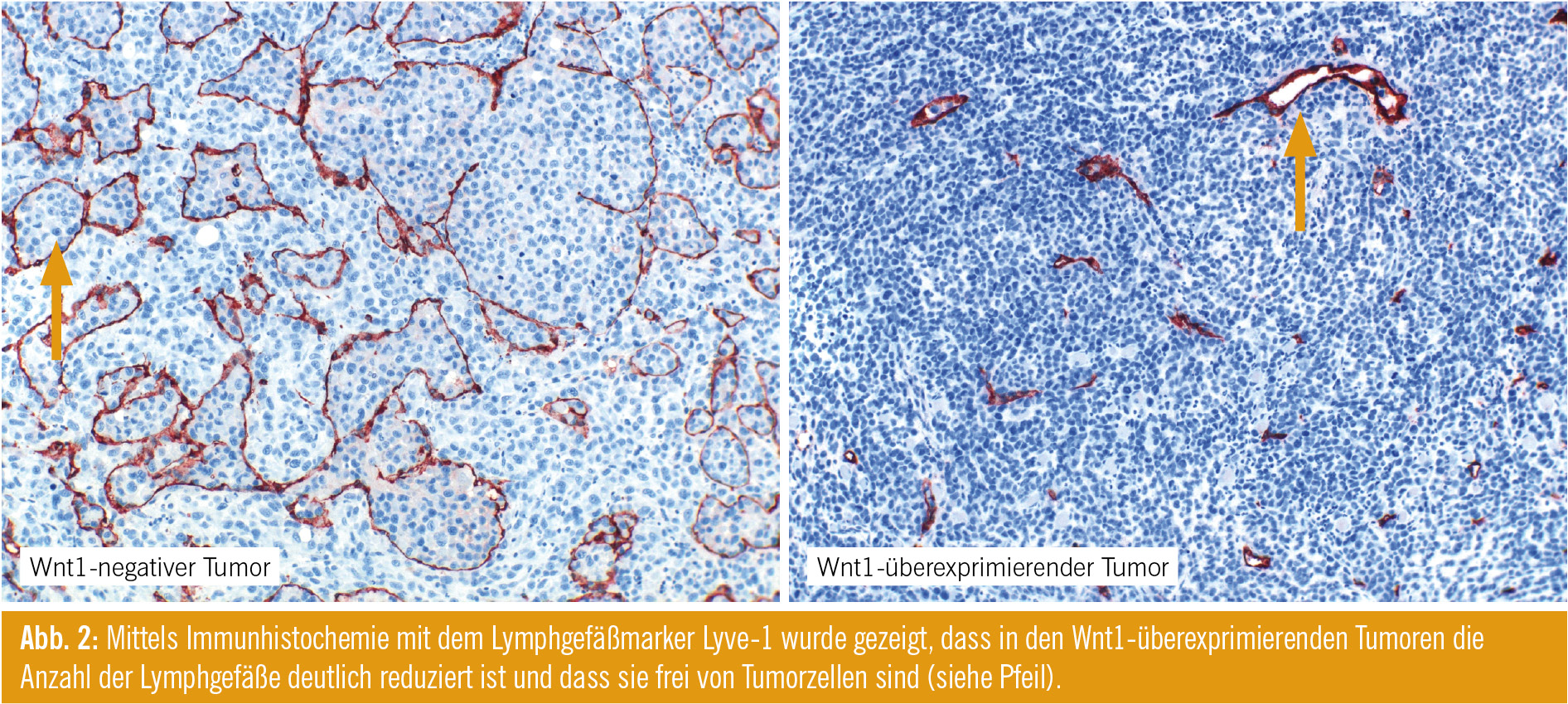
Als Nächstes untersuchten wir, ob Wnt1 auch eine Wirkung auf die Lymphangiogenese und Metastasierung in vivo hat. Dafür verwendeten wir ein spontan metastasierendes Mausmodell und injizierten Wnt1-negative und Wnt1-positive Melanomzellen in SCID-Mäuse. Im primären Tumorwachstum waren keine Unterschiede zwischen Wnt1-negativen und Wnt1-positiven Tumoren sichtbar. Hingegen war in Wnt1-überexprimierenden Melanomzellen nach einem Zeitraum von 60 Tagen der Wächterlymphknoten immer noch frei von Tumorzellen, während Kontrolltumoren bereits metastasierten.Weiters war die VEGF-C-Expression sowohl auf mRNA- als auch auf Proteinebene in Wnt1-postiven Tumoren erheblich niedriger als in Kontrolltumoren. Hingegen wies VEGF-A, ein wichtiger Aktivator der Angiogenese, keine Unterschiede innerhalb der Gruppen auf. Angiogenese und Lymphangiogenese wurden mittels Immunhistochemie analysiert. Lymphgefäße wurden mit dem Marker Lyve1 und Blutgefäße mit CD34 identifiziert. Wir konnten zeigen, dass in den Wnt1-positiven Tumoren viel weniger Lymphgefäße vorhanden waren, die auch viel kleiner und teilweise frei von Tumorzellen waren (Abb. 2). Auch auf mRNA-Ebene war Lyve-1 in den Wnt1-Tumoren erheblich reduziert. Unterschiede in der Angiogenese waren keine erkennbar.
Resümee
Zusammenfassend konnten wir zeigen, dass Wnt1 die melanomabhängige VEGF-C-Expression und die damit verbundene Lymphangiogenese und Metastasierung in einem Melanom-Mausmodell verringert hat. Dadurch öffnet sich ein neuer Ansatz, Wnt1 als antilymphatische Behandlung im Melanom anwenden zu können.