Akute und chronische PAVK der unteren Extremitäten
Akute Ischämie
Eine akute kritische Ischämie einer Extremität tritt bei schlagartiger oder sich rasch entwickelnder kompletter Strombahnverlegung eines arteriellen Transportgefäßes auf. Je nach Lokalisation und Kollateralisation reicht das klinische Bild vom stumm verlaufenden Arterienverschluss bis zum akuten kompletten Ischämiesyndrom. Die Prognose der Extremität wird bei kompletter Ischämie durch die Ischämie-Toleranzzeiten der Gewebe bestimmt: Haut 12 Stunden, Muskulatur 6–8 Stunden, Nerven 2–4 Stunden.
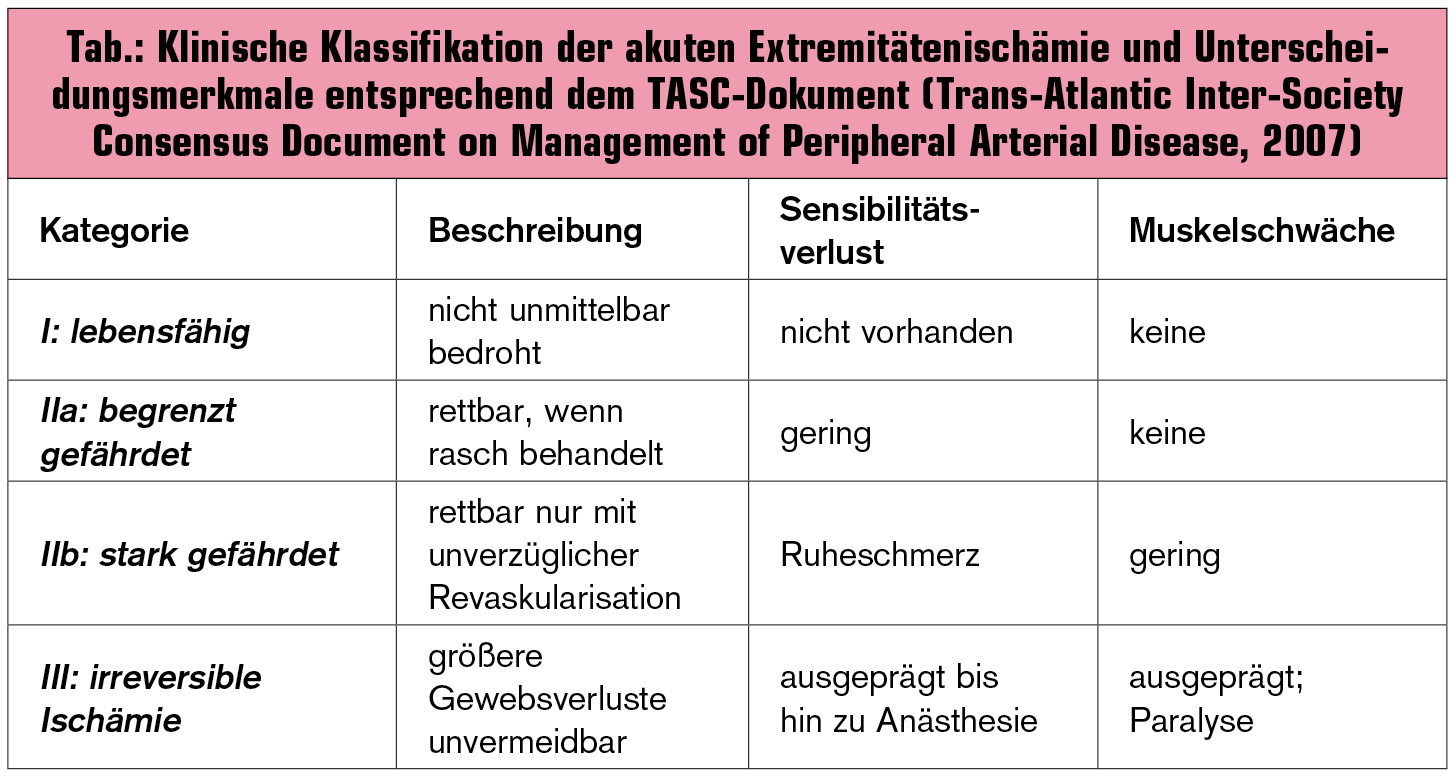
Ursächlich für eine akute kritische Ischämie kommen in erster Linie embolische oder thrombotische Gefäßverschlüsse in Betracht. Embolien sind insbesondere für die Mehrzahl der kompletten Ischämiesyndrome verantwortlich (angiografisches Beispiel siehe Abb. 1).
Der akute embolische Gefäßverschluss (v. a. durch kardiogene Ischämien bei Vorhofflimmern) führt bei einem zuvor gesunden Gefäß wegen des weitgehenden Fehlens von stärkeren Kollateralen zum klinischen Bild der kompletten Ischämie. Embolisches Material bleibt vorzugsweise an Gefäßaufzweigungen hängen, besonders im Beckenbereich sowie an der Unterschenkeltrifurkation. Lokale Thrombosen führen vor allem im Rahmen einer obliterierenden Atherosklerose oder bei aneurysmatischen Erkrankungen – vor allem der Arteria poplitea – zur akuten Ischämie.
Diagnose: Im Vordergrund steht die Anamnese. Neben der Frage nach dem Beginn der Symptomatik und nach einer allfälligen multilokulären Symptomatik erlaubt die Anamnese oft schon eine Differenzierung der Ursache der Ischämie. Dabei sollte nach kardialen Erkrankungen (z. B. bekanntes Vorhofflimmern, Vitien), nach einer bereits bekannten PAVK oder früheren Revaskularisation (Bypass oder endovaskulär), nach einem bereits bekannten Aneurysma, nach Risikofaktoren der Atherosklerose sowie nach Traumen gefragt und eine Medikamentenanamnese erhoben werden. Bei älteren Patienten besteht allerdings häufig eine präexistente Atherosklerose und eine potenzielle kardiale Emboliequelle, sodass dann das Auftreten einer akuten Ischämie sowohl durch eine Embolie als auch durch einen akuten thrombotischen Verschluss verursacht sein kann.
Bei der klinischen Untersuchung geht es um die Unterscheidung einer kompletten und einer inkompletten Ischämie.
Die Symptomatik der kompletten Ischämie ist durch die „6P nach Pratt“ charakterisiert:
- Schmerz – „Pain“: die Symptomatik beginnt mit einem plötzlichen Schmerzereignis distal des Verschlusses oder mit einem rasch progredienten, akral beginnendem Dauerschmerz.
- Pulslosigkeit – „Pulselessness“: Diese ist ein obligates klinisches Zeichen distal der Verschlusslokalisation.
- Blässe – „Pallor“: Blasse oder bläulich marmorierte Haut mit Abkühlung der Extremität ist pathognomonisch. Die Grenze der Blässe und Abkühlung sind jedoch nicht hinweisgebend auf die Verschlusshöhe, sondern beginnen meistens weiter distal. Eine sichtbare Füllung der oberflächlichen Venen fehlt im Fall der kompletten Ischämie. Bei Ausbildung von Thromben im Kapillarstrombett kommt es zur zyanotischen Verfärbung der betroffenen Extremität.
- Missempfindungen – „Paresthesia“: Neben Schmerz kommen Parästhesie, Hyperästhesie und schließlich Hypo- und Anästhesie vor. Der Übergang von Hyperästhesie und Schmerz in Hypo- und Anästhesie darf nicht als nachlassender Schmerz durch Verbesserung der Perfusion fehlgedeutet werden.
- Lähmung – „Paralysis“: Beim akuten Arterienverschluss handelt es sich initial nicht um eine neuropathische Lähmung, sondern um eine erhöhte Muskelrigidität durch fehlendes Substrat für die Energiegewinnung bei Fehlen von ATP. In der Folge entwickelt sich jedoch auch eine neuropathische Parese sowie eine gestörte oder aufgehobene Oberflächen- und Tiefensensibilität.
- Schock – „Prostration: Ein Kreislaufschock mit systemischer Vasoplegie im engeren Sinn ist selten.
Wenn die komplette Ischämie länger als 6 Stunden dauert, droht ein Tourniquet-Syndrom, welches durch Myoglobinämie und -urie, metabolische Azidose mit Hyperkaliämie sowie ein Nierenversagen charakterisiert ist. In diesem Fall muss bei kritischer Abwägung der vorbestehenden Organschäden und des Ausmaßes der ischämischen Muskelschädigung auch eine primäre Amputation der Extremität erwogen werden.
Beim inkompletten Ischämiesyndrom kann aufgrund einer noch vorhandenen Minimalperfusion die Symptomatik erheblich abgemildert sein. Ischämische Ruheschmerzen, Pulslosigkeit und Blässe sind die Kardinalsymptome der inkompletten Ischämie, Parästhesien sind möglich, ebenso eine Muskelschwäche. Generell gilt, dass sich arteriell bedingte Ruheschmerzen bei Tieflagerung der betroffenen Extremität bessern. Besonders wichtig zur Beurteilung ist auch die Vergleichsuntersuchung mit der kontralateralen Extremität.
Klinische Klassifikation der akuten Extremitätenischämie (Tab. 1): Die wichtigste Frage, welche durch die Anamnese und die klinische Untersuchung rasch und eindeutig geklärt werden muss, ist jene nach der Schwere der akuten Ischämie. Dieser Faktor ist naturgemäß der wichtigste bei der Entscheidung über die Dringlichkeit und Art der weiteren Therapiemaßnahmen. Dabei müssen folgende Fragen letztlich klinisch – was natürlich auch eine gewisse Erfahrung des Klinikers voraussetzt – geklärt werden:
- Ist die Extremität lebensfähig (ohne weitere Zunahme der Ischämie)?
- Ist die Extremität vital gefährdet (wenn die Perfusion nicht rasch wiederhergestellt wird)?
- Sind bereits irreversible Schäden vorhanden, welche eine Rettung des Beines unmöglich machen?
Apparative Diagnostik: Meist reichen die Anamnese und klinische Untersuchung für die Diagnose der akuten peripheren Ischämie aus. Bei klinischem Verdacht auf komplette Ischämie muss umgehend eine Revaskularisation angestrebt werden. Apparative Untersuchungen spielen daher in dieser Situation nur eine untergeordnete Rolle. Um keine Zeit zu verlieren, muss vor allem auf aufwändige Untersuchungsmaßnahmen wie eine angiografische Diagnostik verzichtet werden. Eine gewisse Bedeutung kommt hier der rasch verfügbaren Duplexsonografie zu, mit deren Hilfe der klinische Befund bestätigt und insbesondere relevante Informationen zur Lokalisation und Thrombusausdehnung erhalten werden können; zusätzlich eignet sie sich sehr gut zur Darstellung thrombosierter Aneurysmen.
Apparative diagnostische Maßnahmen sind insbesondere bei der inkompletten Ischämie – wo meist kein kritischer Zeitdruck besteht – zur differenzialdiagnostischen Abklärung und auch zur Festlegung der weiteren Therapiestrategie sinnvoll. Ziele der Diagnostik sind hier einerseits die Lokalisationsdiagnostik des Verschlusses und andererseits die Abschätzung der Möglichkeit einer endovaskulären oder chirurgischen Revaskularisation.
Spätestens im Anschluss an die Revaskularisation sind diagnostische Maßnahmen zur definitiven Klärung der Verschlussursache erforderlich (z. B. Echokardiografie, 24-h-EKG etc.). Die Abb. 2 gibt einen Algorithmus zur Abklärung bei einer akuten kritischen Beinischämie. Wichtig ist – insbesondere auch in Hinblick auf die weitere Sekundärprophylaxe – eine Differenzierung zwischen thrombotischen versus embolischen Verschlüssen.
Therapie der kompletten Ischämie: Prinzipiell gilt, dass bei der kompletten Ischämie – meist auf Basis einer Embolie – die sofortige chirurgische Embolektomie das Verfahren der Wahl ist. Bei Beseitigung des Verschlusses innerhalb eines Zeitfensters von maximal 6 Stunden kann eine Amputation meistens vermieden werden. Lediglich bei Verschlüssen im Unterschenkelbereich
kann in erfahrenen Zentren eine endovaskuläre Behandlung mit Aspirationsembolektomie erwogen werden.
Die Amputation muss als Ultima Ratio gelten, falls Revaskularisationsmaßnahmen fehlschlagen und systemische Komplikationen durch die akute Ischämie drohen
Therapie der inkompletten Ischämie: In Hinblick auf das Vorliegen einer kritischen Extremitätenischämie muss auf alle Fälle eine rasche Revaskularisation angestrebt werden, wobei vielfach der endovaskulären Therapie der Vorzug gegeben wird. Insbesondere bei Patienten mit thrombotischem Gefäßverschluss auf Basis einer Atherosklerose handelt es sich häufig um Risikopatienten mit ausgeprägter Komorbidität, sodass eine chirurgische Revaskularisation nur mit einem oft deutlich erhöhten Operationsrisiko möglich ist. Zusätzlich sind die Operationsergebnisse nach Thrombektomie oder Bypass schlechter als nach Embolektomie, weil sich die akuten thrombotischen Verschlüsse im Bereiche einer mehr oder weniger vorgeschädigten Gefäßstrombahn ereignen.
Operation vs. endovaskuläre Therapie: Die Thrombolysetherapie (Katheterlyse) mit/ohne Aspiration hat sich als wertvolle Alternative oder Ergänzung zu chirurgischen Rekanalisationsmaßnahmen etabliert und stellt einen festen Bestandteil im therapeutischen Repertoire des interventionellen Gefäßmediziners dar. Die Domäne der endovaskulären Therapie ist die inkomplette Ischämie vor allem bei distalen Beinarterienverschlüssen sowie bei Patienten, die chirurgisch nicht oder nur mit hohem Risiko operiert werden können.
Gepoolte Analysen von Studien zum Vergleich Operation vs. endovaskuläre Therapie zur Initialtherapie der akuten Extremitätenischämie ergaben bezüglich Extremitätenerhalt und Überleben nach einem Jahr keinen eindeutigen Vorteil einer bestimmten Strategie.
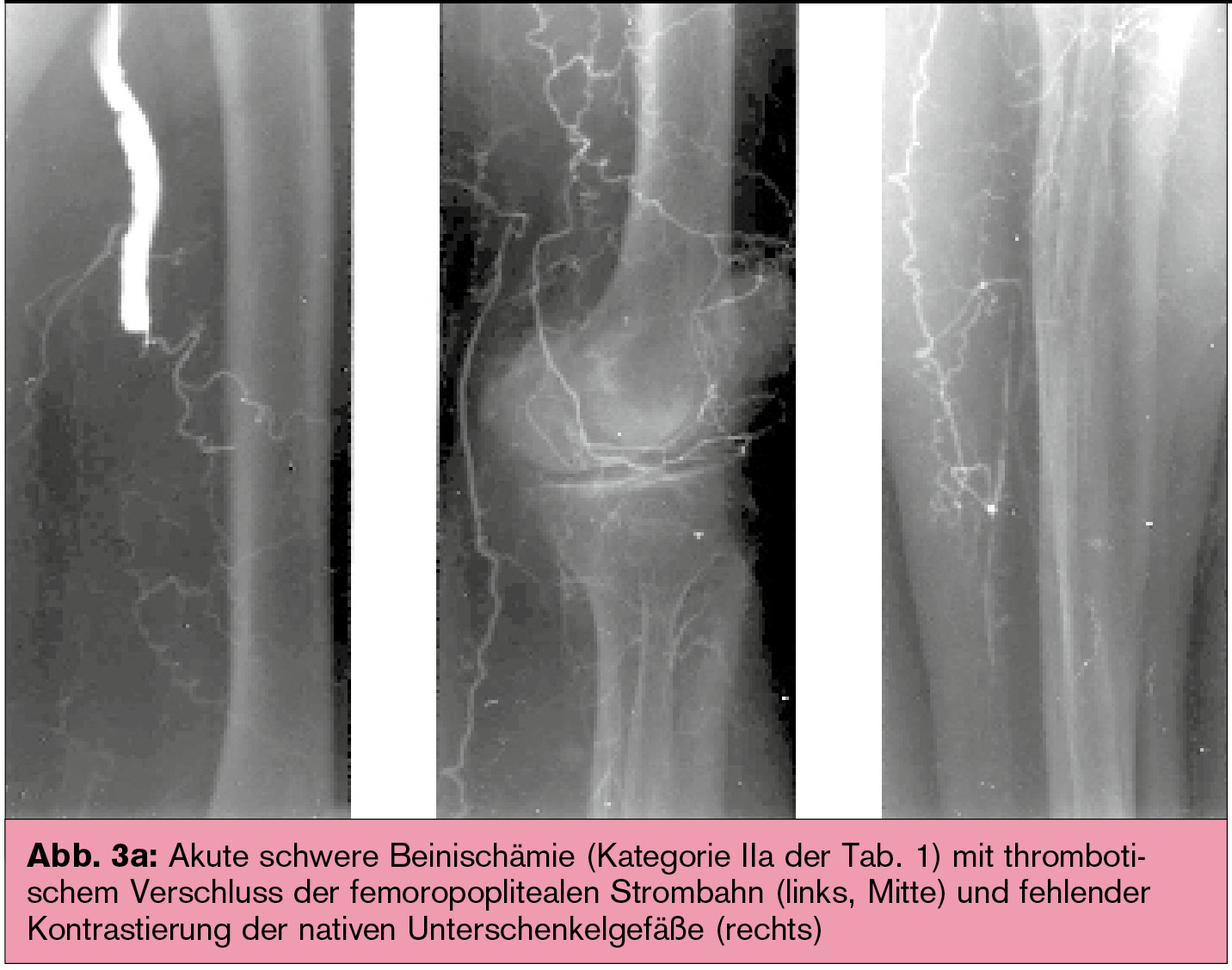
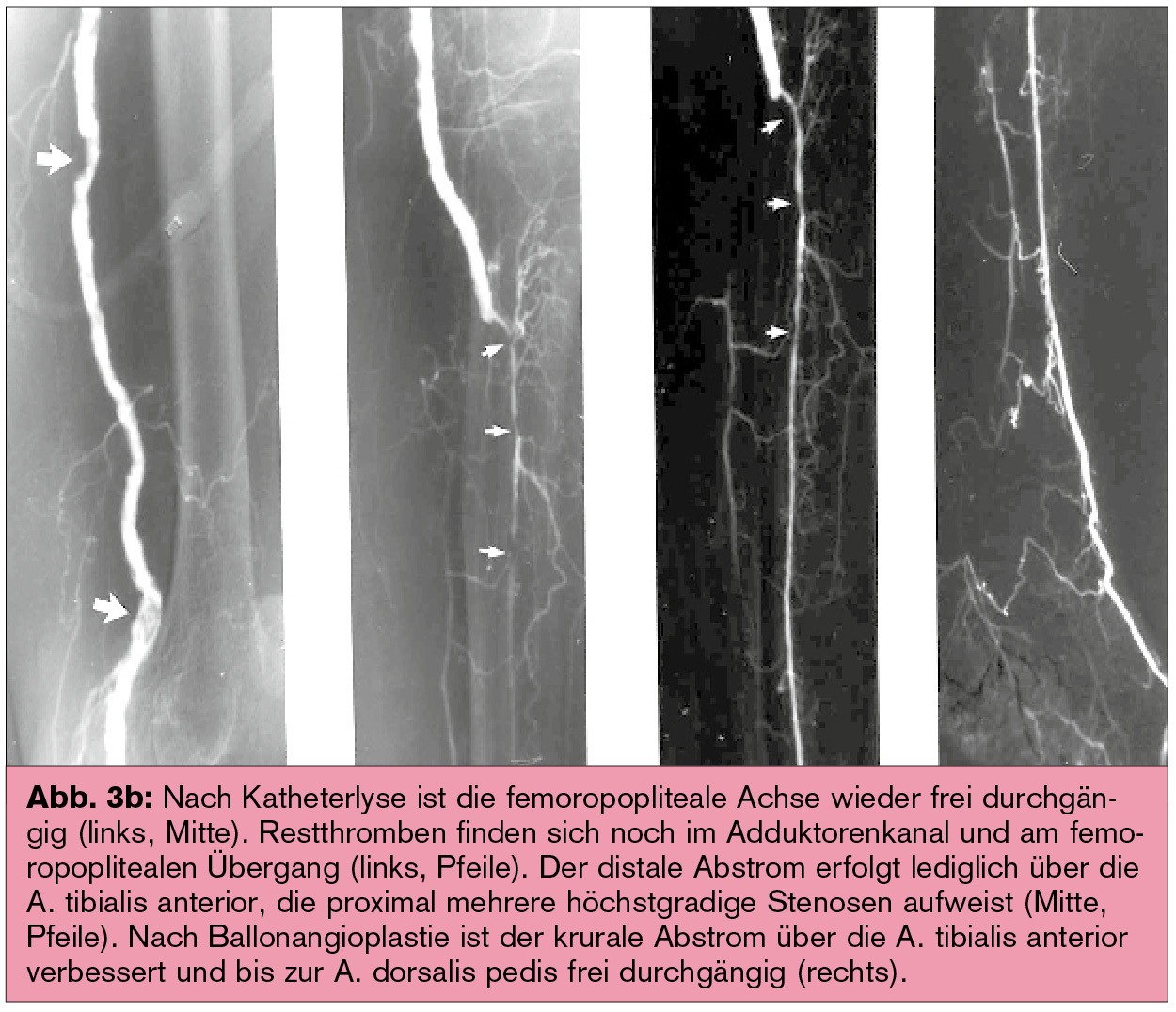
Nach einer lokalen Thrombolyse ist häufig eine interventionelle (Abb. 3) oder chirurgische Beseitigung der Verschlussursache erforderlich, z. B. Stenosen oder ein schlechter peripherer Abstrom als flusslimitierende Faktoren und damit Ursache eines (Bypass-)Verschlusses.
Technische Fortschritte bei den endovaskulären Therapieverfahren ermöglichen zunehmend eine raschere Rekanalisation des Verschlusses und eine Verkürzung der Eingriffsdauer, sodass diese endovaskulären Verfahren in den meisten Zentren zunehmend zum Einsatz kommen und die chirurgischen Verfahren verdrängen. Unter diesen Methoden haben insbesondere die perkutane Aspirationsthrombektomie und verschiedene mechanische Thrombektomie-Systeme Bedeutung erlangt, wobei sehr häufig eine Kombination der verschiedenen Verfahren zur Anwendung kommt.
Weitere Sekundärprophylaxe: Nach Behandlung der akuten Ischämie kommt der Sekundärprophylaxe eine entscheidende Bedeutung zu. Bei bekannter Grundkrankheit sollte diese behoben werden, z. B. sollten embolisierende Aneurysmen jeder Größe saniert werden. Bei Morbus embolicus mit kardialer Emboliequelle gilt die Langzeit-Antikoagulantientherapie als Therapie der Wahl. Bei arterioarteriellen Embolien ist die Datenlage weniger eindeutig: vor allem bei atherosklerotischer Grundkrankheit können hier Thrombozytenfunktionshemmer ebenso wie die orale Antikoagulation eingesetzt werden. Bei arteriellen Thrombosen sind Thrombozytenfunktionshemmer die Therapie der ersten Wahl.
Chronische PAVK
Es soll betont werden, dass die Diagnose der PAVK in erster Linie eine klinische Diagnose ist. Durch eine sorgfältige Anamnese und klinische Untersuchung (Inspektion; Pulspalpation und Gefäßauskultation in Ruhe und allenfalls auch nach Belastung) kann das Vorliegen einer PAVK sowie die Lokalisation und der Schweregrad meist mit ausreichender Sicherheit diagnostiziert werden.
Zusätzlich soll darauf hingewiesen werden, dass sich die klinische Untersuchung nicht nur auf die Untersuchung der Extremitäten beschränken soll, sondern die Untersuchung des gesamten Herz-Kreislauf-Systems mit der Frage nach weiteren Manifestationen der Grundkrankheit Atherosklerose sowie eine allgemeine körperliche Untersuchung mit der Frage nach nicht-vaskulären Begleiterkrankungen beinhalten muss. Diese Untersuchungsbefunde beeinflussen nämlich wesentlich das therapeutische Gesamtkonzept.
Die apparativ-diagnostischen Untersuchungen dienen in erster Linie zur Dokumentation und zur Präzisierung von Ausmaß und Schweregrad der PAVK. Zusätzlich kommen sie zur Abklärung der seltenen ätiologisch primär unklaren Fälle (z. B. entzündliche Gefäßerkrankung) zum Einsatz.
Die Erfassung vaskulärer Risikofaktoren und einer Koinzidenz atherosklerotischer Erkrankungen an anderen Lokalisationen gehören ebenfalls zum diagnostischen Standardprogramm bei der Untersuchung des PAVK-Patienten.
Apparative Diagnostik: Unter den funktionellen Methoden hat die dopplersonografische Messung des systolischen Knöchelarteriendruckes – in Ruhe und allenfalls nach Belastung – als in jeder Praxis einfach durchführbare Methode den größten Stellenwert. Im Normalfall ist der Knöchelarteriendruck zumindest genauso hoch wie der Druck im Bereich des Armes.
Zur objektiven Bestimmung der Gehstreckeneinschränkung, bei unklaren Angaben zur Gehstrecke oder bei Verdacht auf assoziierte Einschränkung der Belastbarkeit durch Begleiterkrankungen sollte ein Gehtest durchgeführt werden. Dieser ist allerdings in standardisierter Belastung auf einem Laufband nur selten im niedergelassenen Bereich möglich.
Unter den bildgebenden Verfahren hat die farbkodierte Duplexsonografie derzeit die größte Bedeutung und wird auch im niedergelassenen Bereich von Angiologen und Radiologen durchgeführt. Sie ist die Methode erster Wahl für die direkte Darstellung der Arterien und ermöglicht zusätzlich funktionelle Informationen. Neben der morphologischen Beurteilung von Plaques erlaubt sie eine exakte Quantifizierung von Engstellen, zusätzlich können Verschlüsse hinsichtlich Lokalisation und Ausdehnung genau erfasst werden.
In den letzten Jahren hat die nicht-invasive Magnetresonanz-Angiografie (MRA) wegen der zunehmenden Verfügbarkeit und verbesserten Bildqualität sehr rasch an Bedeutung gewonnen. Sie sollte allerdings nicht zur Primärdiagnostik einer PAVK eingesetzt werden, sondern nur vor geplanter lumeneröffnender Therapie. Ein wesentlicher Vorteil gegenüber der Duplexsonografie ist die Übersichtlichkeit der Darstellung des gesamten Gefäßsystems. Die Computertomografie-Angiografie (CTA) stellt ebenso wie die MRA eine nicht-invasive Methode dar, allerdings mit dem Nachteil einer Strahlenbelastung für den Patienten. Die Notwendigkeit aufwändiger Nachbearbeitungsverfahren schränkt derzeit die Verfügbarkeit dieser Methode noch stark ein.
Therapieziele: Die Behandlungsziele bei Vorliegen einer PAVK sind:
- in allen klinischen Stadien eine Risikoreduktion für alle vaskulären Komplikationen,
- im Stadium II ( Claudicatio) die Besserung der Gehleistung, der Mobilität und der Lebensqualität
- sowie im Stadium III (Ruheschmerz) und IV (zusätzlich Nekrosen) der Extremitätenerhalt, die Schmerzreduktion und ebenso die Verbesserung der Lebensqualität.
Bei allen Patienten muss eine Optimierung des Risikofaktorenprofils angestrebt werden (darauf soll hier nicht weiter eingegangen werden).
Sekundärprophylaxe mit Antithrombotika: Thrombozytenfunktionshemmer haben einen zentralen Stellenwert in der Sekundärprophylaxe atherosklerotischer Erkrankungen. In einer rezenten Metaanalyse von Studien zur Sekundärprophylaxe mit Acetylsalicylsäure bei Patienten mit symptomatischer PAVK fand sich eine 25-prozentige relative Risikoreduktion für kardiovaskuläre Ereignisse. Dies liegt etwa in der gleichen Größenordnung wie für Patienten mit kardio- oder zerebrovaskulären Erkrankungen. Allerdings waren die Ergebnisse – in erster Linie wegen der geringeren Patientenzahl – nicht signifikant.
In den aktuellen Richtlinien des American College of Chest Physicians (ACCP; Chest 2012) wird bei Patienten mit symptomatischer PAVK (inklusive Patienten nach peripherer Bypassoperation oder Angioplastie) eine Langzeittherapie entweder mit Acetylsalicylsäure (75 bis 100 mg/die) oder Clopidogrel (75 mg/die) empfohlen (mit dem höchsten Grad der Empfehlung: 1A). Für eine duale plättchenfunktionshemmende Therapie bzw. eine Kombinationstherapie von Acetylsalicylsäure mit Vitamin-K-Antagonisten gibt es keine Empfehlung.
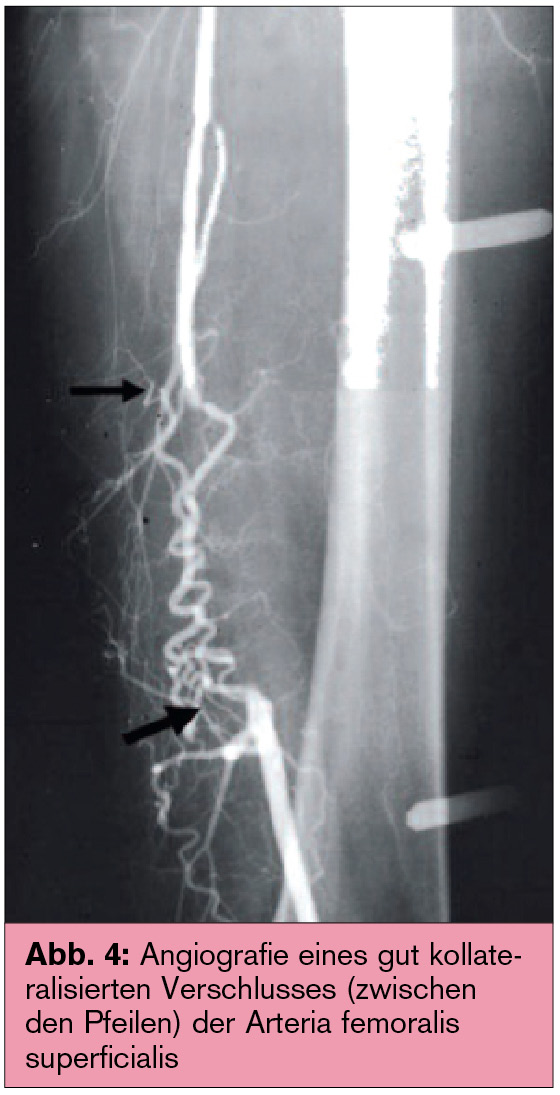
Verbesserung der Symptomatik der Durchblutungsstörung: Das strukturierte Gehtraining stellt im Stadium II die Basis der Therapie dar. Unter Trainingsanleitung (z. B. im Rahmen einer Gefäßsportgruppe) konnte in Studien eine signifikante Verlängerung der schmerzfreien und maximalen Gehstrecke dokumentiert werden. Die Hauptwirkung beruht in erster Linie auf einer verbesserten Kollateralisation (Abb. 4).
Vasoaktive Pharmaka: Mehrere kontrollierte randomisierte Studien konnten für einige vasoaktive Substanzen nachweisen, dass sie die schmerzfreie Gehstrecke von Patienten mit Claudicatio intermittens im Vergleich zu Placebo zwar signifikant verbessern können, allerdings war die Wirksamkeit oft limitiert und die klinische Relevanz muss daher für jeden Einzelfall hinterfragt werden. Für die schweren klinischen Stadien III und IV konnte bisher keine klinische Wirksamkeit gesichert werden. Lediglich für die Substanzgruppe der Prostanoide (Prostaglandin E1; Iloprost) ließ sich auch im klinischen Stadium III/IV eine klinische Wirksamkeit dokumentieren.
Lumeneröffnende Therapiemaßnahmen: Im Stadium der kritischen Extremitätenischämie (Critical Limb Ischemia = CLI) ist die Extremität des Patienten gefährdet und es sollte – sofern dies möglich ist – unbedingt eine lumeneröffnende Therapie angestrebt werden. Demgegenüber ist eine Revaskularisation im Stadium der Claudicatio nicht obligat und orientiert sich in erster Linie an den persönlichen Bedürfnissen (beruflich und privat) des Patienten.
Die Differenzialindikation zu einem primär chirurgischen bzw. nicht-chirurgischen Vorgehen (verschiedene Verfahren der Katheterrevaskularisation = endovaskuläre Therapie) sollte interdisziplinär – am besten in einem erfahrenen Gefäßzentrum in enger Kooperation zwischen interventionell tätigem Angiologen und Gefäßchirurgen – gestellt werden. Der entscheidende Parameter ist die zugrunde liegende anatomische Situation (Lokalisation bzw. Ausdehnung vorhandener Stenosen und Verschlüsse), welche die technische Durchführbarkeit und Erfolgschance der verschiedenen Verfahren bedingt. Zusätzlich sind die Langzeitergebnisse zu berücksichtigen. Das Auftreten einer Rezidivstenose gilt ja als Achillesferse der endovaskulären Therapie, allerdings konnten durch neue Therapiemodalitäten (z. B. Verwendung von Medikamenten-beschichteten Stents bzw. Ballons) die Langzeitergebnisse doch entscheidend verbessert werden. Bei der Planung des therapeutischen Procedere muss man immer berücksichtigen, dass es sich wegen der vorliegenden Polymorbidität meist um Hochrisikopatienten handelt. Wegen des geringeren Risikos wird in den meisten Zentren bei der Behandlung dieser Risikopatienten zunächst immer ein nicht-chirurgisches Vorgehen angestrebt. Für die primäre Durchführung einer endovaskulären Therapie spricht auch die Tatsache, dass bei einem allfälligen Misserfolg dieses Eingriffs eine dann erforderliche Gefäßoperation mit der gleichen Erfolgschance durchgeführt werden kann.
In den letzten Jahren wurden durch wesentliche Verbesserungen des Materials sowie durch zunehmende Erfahrung der interventionell tätigen Ärzte die Möglichkeiten der endovaskulären Therapie entscheidend verbessert. So werden auch Patienten mit ausgeprägter Makroangiopathie vom Unterschenkeltyp – wie man sie häufig bei Diabetikern findet – zunehmend endovaskulär erfolgreich behandelt. Die Implantation von Stents hat zuletzt auch in den peripheren Gefäßen zunehmend an Bedeutung gewonnen und diese haben die Behandlungsmöglichkeiten in allen Gefäßgebieten wesentlich verbessert.
Chronische PAVK
rksamkeit die klinische Relevanz für jeden Einzelfall hinterfragt werden.
- Klinisch unterscheidet man zwischen kompletter und inkompletter Ischämie. Die typische Symptomatik der kompletten Ischämie sind die „6 P“.
- Diese Unterscheidung bestimmt entscheidend weitere Diagnostik- und Therapiemaßnahmen.
- Eine komplette Ischämie wird meist durch einen embolischen Verschluss verursacht. Akut auftretende thrombotische Verschlüsse führen meist zu einer inkompletten Ischämie.
- Anamnese und klinische Untersuchung sind für die Diagnose der akuten peripheren Ischämie meist ausreichend. Die Abklärung der Ursache der Ischämie ist wegen der weiteren Sekundärprophylaxe wichtig.
- Bei der kompletten Ischämie muss nach klinischer Diagnose ohne Zeitverlust eine (meist chirurgische) Revaskularisation angestrebt werden.
- Bei der inkompletten Ischämie kann die Revaskularisation endovaskulär oder chirurgisch angestrebt werden.