Antibiotikadosierungen in extremen pharmakokinetischen Situationen
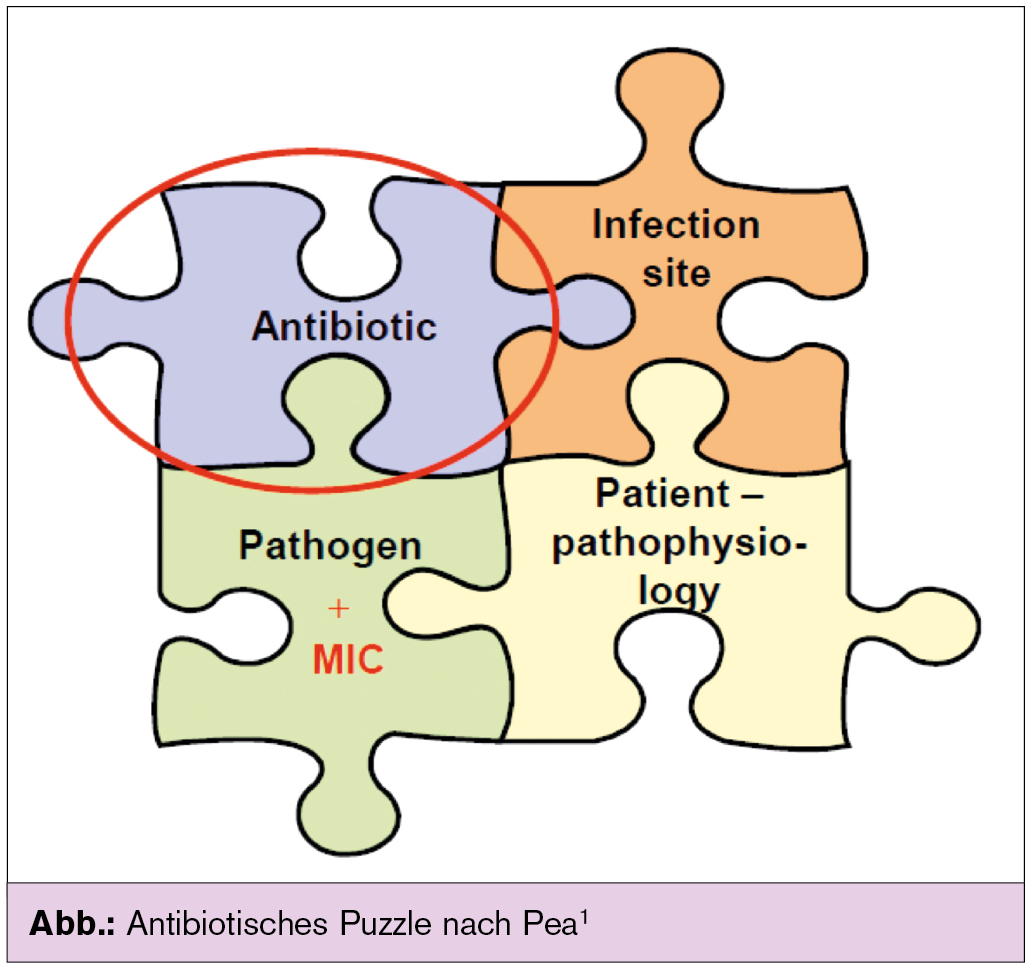
Das Antiinfektivum, das Pathogen mit seiner minimalen Hemmkonzentration & Pathogenität, der Infektionsort und die Pathophysiologie des Patienten bilden dabei ein variantenreiches Puzzle1, das das Outcome einer Infektionstherapie entscheidend beeinflusst und in dem im Wesentlichen nur das Antiinfektivum bezüglich Dosis, Dosisintervall, Dauer und Art/Frequenz der Applikation modulierbar ist.
Auf der Intensivstation
Gerade die Pathophysiologie des Intensivpatienten bietet einige pharmakokinetische Herausforderungen, die nach einer Anpassung der Antibiotikadosierung verlangen.2 Einerseits verursacht das Capillary-Leak-Syndrom, Aszites oder auch die Flüssigkeitstherapie eine Vergrößerung des Verteilungsvolumens des Patienten und damit eine „Verdünnung“ des Antibiotikums am Infektionsort. Andererseits bewirkt ein „Anheizen“ der renalen Clearance beispielsweise durch Hypoalbuminämie, Verbrennungen oder Leukämie eine vermehrte Ausscheidung des Antibiotikums. Hier ist eine Dosissteigerung gefordert. Eine renale Einschränkung verlangt oftmalig eine Dosisverminderung des Antibiotikums.
Ein Problemfeld im Bereich der antiinfektiven Intensivmedizin ist die häufig verringerte Gewebekonzentration einiger Antiinfektiva in den so genannten tieferen Kompartimenten wie Muskelgewebe oder Subkutis im Vergleich zum Serum. Joukhadar untersuchte Gewebekonzentrationen bei Patienten im septischen Schock mittels Mikrodialyse und erhielt eine um bis zu 10-fach verringerte Konzentration von Piperacillin im Skelettmuskelgewebe und subkutanen Fettgewebe als Ergebnis im Vergleich zur Konzentration im Serum.3 Roberts untersuchte septische Patienten mittels In-vivo-Mikrodialyse und fand ebenfalls eine signifikant verringerte Konzentration an Piperacillin im subkutanen Gewebe versus Plasma bei dieser Patientengruppe.4 Linezolid weist tendenziell überaus variable Serumspiegel bei Intensivpatienten auf5 – Messungen des Talspiegels wären hier oft eine wertvolle Hilfe. Fosfomycin zeigt im Gegensatz dazu keine verringerte Gewebekonzentration gegenüber dem Serum.6
Als Antwort auf die ungünstige Pharmakokinetik von Piperacillin bei Intensivpatienten empfehlen einige Autoren die so genannte verlängerte Infusion („extended infusion“) von Piperacillin. Lodise publizierte eine interessante Studie zu diesem Thema, in der gezeigt werden konnte, dass unter Anwendung einer 4-Stunden-Infusion von Piperacillin/Tazobactam alle 8 Stunden bei Intensivpatienten mit einem Apache -Score von > 17 die Mortalität signifikant geringer war als bei der Vergleichsgruppe mit einer herkömmlichen 30-Minuten-Infusion.7 Einige Nachfolgestudien bestätigen diesen Trend8, 9, wobei die große prospektive, randomisierte Studie noch ausständig ist.
Der übergewichtige Patient
Allgemein kann gesagt werden, dass zwei pharmakokinetische Parameter bei fettleibigen Patienten (BMI > 30 kg/m2) sich gegenüber normalgewichtigen Patienten stark verändern können: das Verteilungsvolumen und die Kreatinin-Clearance.10 Diese beiden Faktoren können einen essenziellen Einfluss auf die Halbwertszeit, damit auf die Zeit über der MHK speziell bei Betalaktamen und auf die Konzentration des Antibiotikums am Infektionsort haben. Beide Parameter sind bei übergewichtigen Patienten oftmalig qualitativ erhöht, allerdings gibt es nur wenige Studien, die quantitativ die Relation zwischen Übergewicht einerseits und Verteilungsvolumen und Clearance andererseits beschreiben.11 Zusätzlich dazu sind neben der Körperfettmasse auch die sog. Lean Body Mass (Körpermagermasse), der kardiale Blut-Output, das Blutvolumen sowie die hepatische Metabolisierungsrate bei fettleibigen Patienten erhöht.10
Dieser Mix an physiologischen Veränderungen bedingt, dass eine antibiotische Standarddosierung einen antibiotischen Therapieerfolg potenziell gefährden kann. Dennoch gibt es auch in dieser Patientengruppe kein Patentrezept für eine Dosisanpassung.
Betalaktame sind eher hydrophile, proteingebundene Substanzen, die sich nicht vorrangig im Fettgewebe einlagern und auch keine konzentrationsabhängige Tötungskinetik aufweisen. Dennoch sind Konzentrationen unter der MHK über eine signifikante Zeitspanne der Halbwertszeit gerade bei Pathogenen mit hohen MHK-Werten kontraproduktiv. Resorption und Verteilung von oralem Penicillin V scheint sich in fettleibigen und normalgewichtigen Patienten beispielsweise nicht unterschiedlich zu verhalten.12 Ampicillin hingegen zeigt ein größeres Verteilungsvolumen bei Übergewichtigen13, was eine Dosisanpassung nahelegen würde.
Viel diskutiert wird auch eine mögliche Dosisanpassung der perioperativen Prophylaxe bei Patienten mit einem Körpergewicht von deutlich über 100 kg. Eine aktuelle Arbeit kommt zu dem Schluss, dass bei Patienten mit einem BMI zwischen 40 und 50 eine einmalige Cefazolin-Dosis von 2 g und bei Patienten mit einem BMI über 50 ein Single Shot von 3 g einen ausreichenden Infektionsschutz bei operativen Eingriffen mit einer Dauer von bis zu 5 Stunden bieten kann.14 Cefazolin scheint in stark fettleibigen Patienten zwar ein höheres Verteilungsvolumen, aber nicht automatisch eine erhöhte Clearance zu haben – jüngeres Alter war in einer Untersuchung von schwer Übergewichtigen signifikant mit einer erhöhten renalen Clearance verbunden.15
Vancomycin ist nach aktuellem Körpergewicht zu dosieren.16 Problematisch bezüglich Literatur zur Dosierung von Vancomycin ist generell, dass sich mit der IDSA/ASHP/SIDP-Consensus-Leitlinie aus 2009 der therapeutisch wirksame Talspiegel von 2–8 mg/l auf 15–20 mg/l erhöht hat17, da speziell Methicillin-resistente Staphylokokken tendenziell höhere MHK-Werte aufweisen. Diese neuen Targets werden dann essenziell für einen Therapieerfolg, wenn das zu therapierende Pathogen MHK-Werte im höheren Bereich aufweist (> 1 mg/l beim MRSA). Das impliziert, dass sämtliche Dosierungsempfehlungen vor 2009 nur mit großem Vorbehalt auf unsere aktuelle klinische Situation anwendbar sind. Klinische Studien unter Berücksichtigung der neuen Parameter sind rar. Für übergewichtige Patienten mit normaler Nierenfunktion sollte die neue Dosierungsempfehlung von 15–20 mg/l gelten verbunden mit einem intensiven Monitoring der Talspiegel bez. Therapieziel und Nierentoxizität. Im Juni dieses Jahres wird zwar eine neue klinische Studie erscheinen, die ein Regime von 10 mg/kg alle 12 h im Vergleich zur neuen Dosierung bei übergewichtigen Patienten mit gutem Outcome untersucht hat, der Target-Talspiegel war allerdings mit 10–20 mg/l nicht gerade glücklich formuliert. Interessant war allerdings die Aussage, dass in beiden Dosierungsgruppen nur zwei Patienten eine Niereneinschränkung akquirierten. Eine endgültige Beurteilung dieser Ergebnisse wird erst mit Erscheinen der Volltext-Version erfolgen können.18
Chinolone unterliegen einer geringen Einlagerung in Fettgewebe. Sowohl bei Ciprofloxacin als auch bei Moxifloxacin scheinen Dosisanpassungen bei fettleibigen Patienten nicht notwendig zu sein.10, 19 Lediglich Levofloxacin zeigte eine verringerte renale Clearance in dieser Patientengruppe.20
Der untergewichtige Patient
Der untergewichtige Patient (BMI < 18,5 kg/m2) ist Repräsentant einer überaus heterogenen Patientengruppe. Tuberkulose, HIV-Infektionen, Malnutrition oder Ernährungsstörungen können in Zusammenhang mit Untergewicht die Physiologie beeinflussen und Dosisanpassungen im antiinfektiven Therapiebereich notwendig machen. Hauptaugenmerk ist hier auf Antibiotika mit geringer therapeutischer Breite, wie Vancomycin und Aminoglykoside zu legen. Manjunath und Mitarbeiter empfehlen, die Dosis von Aminoglykosiden an die Lean Body Mass anzupassen, in Kombination mit einem intensiven Drug Monitoring.21 Auch Vancomycin ist an ein deutlich nach unten abweichendes Körpergewicht im Allgemeinen anzupassen. Allerdings fehlen große klinische Studien zum Problem Untergewicht in Bezug auf eine amtimikrobielle Therapie.