Arterielle und venöse Thromboembolien bei Tumorpatienten
Einer von vier Todesfällen weltweit wird durch die Entstehung einer Thrombose verursacht, und eine aktive Krebserkrankung gilt als bedeutender Risikofaktor für das Auftreten arterieller (ATE) und venöser (VTE) thromboembolischer Ereignisse.1 Basierend auf früheren Studien an Tumorpatienten wird das ATE-Risiko auf das 2-Fache bzw. das VTE-Risiko auf das 4–7-Fache im Vergleich zur Allgemeinbevölkerung geschätzt.2–6 Bisher fehlten jedoch groß angelegte bevölkerungsbasierte Daten, die sowohl über das Thromboserisiko in der gesamten Krebspopulation als auch über das individuelle Risiko einzelner Tumortypen berichteten. Da sowohl kardiovaskuläre als auch maligne Erkrankungen in einer alternden Bevölkerung immer häufiger werden, wird aller Wahrscheinlichkeit nach auch der Anteil tumorassoziierter Thrombosen in Zukunft zunehmen.7–9 Eine Bestimmung der Größenordnung dieser Assoziation zwischen Tumor und Thrombose wird daher dringend benötigt, um die Koexistenz beider Erkrankungen besser zu verstehen und um potenzielle kardiovaskuläre Langzeiteffekte einer Krebserkrankung bzw. -therapie besser abschätzen zu können.
Daten aus Österreich
Im Rahmen einer landesweiten Analyse, welche an der Abteilung für Hämatologie und Hämostaseologie der Medizinischen Universität Wien durchgeführt wurde, konnte nun das relative Risiko der tumorassoziierten ATE und VTE im Vergleich zur Allgemeinbevölkerung erhoben werden (Grilz E et al., European Heart Journal 2021). Hierfür wurden ICD-10-Diagnosecodes aus der Datenbank des österreichischen Hauptverbandes der Sozialversicherungsträger extrahiert und analysiert:
Studienkohorte: Alle im Jahr 2006/2007 in Österreich sozialversicherten Menschen zwischen 0 und 90 Jahren wurden in die Analyse eingeschlossen. Die Studie umfasste somit 8.306.244 Versicherte. Das entsprach 99,998 % der österreichischen Bevölkerung. Insgesamt hatten 158.675 (1,91 %) Personen mindestens einen ICD-10-Diagnosecode für eine maligne Erkrankung. Diagnosecodes für eine ATE fanden sich bei 77.940 (0,94 %) Personen, 36.551 (0,44 %) Personen hatten einen oder mehrere VTE-Diagnosecodes.
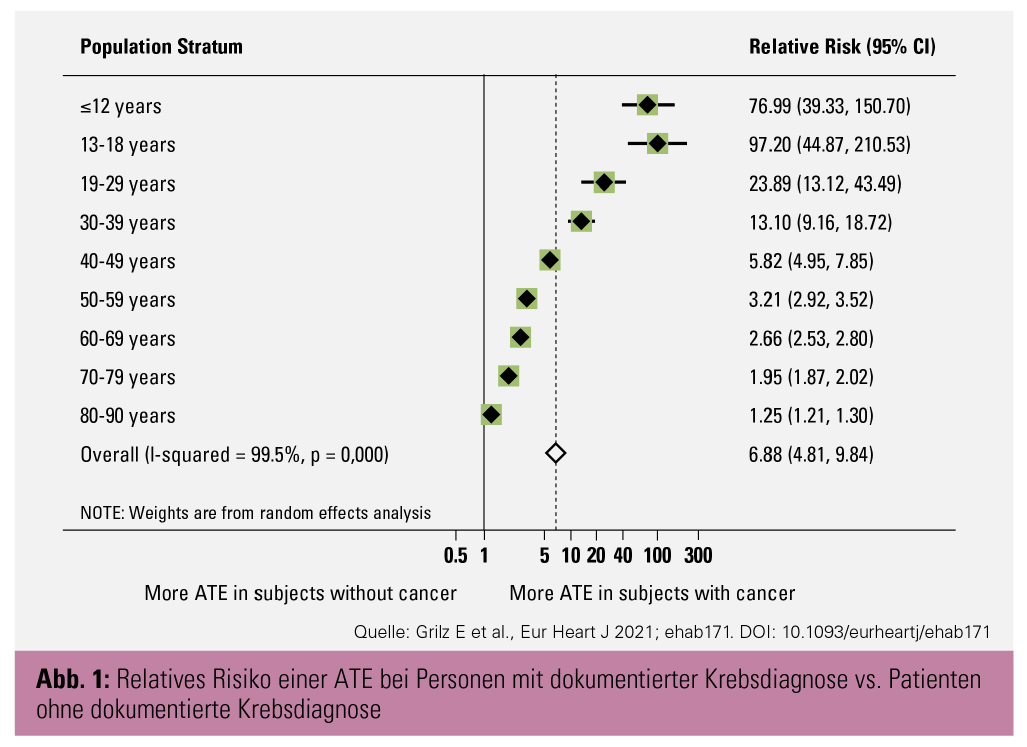
Relatives Risiko tumorassoziierter ATE: Von 158.675 Personen, die einen Diagnosecode für Krebs hatten, hatten 8.559 auch eine dokumentierte ATE-Diagnose (Risiko: 0,05; 95%-Konfidenzintervall [KI]: 0,05–0,06). Im Vergleich dazu hatten von 8.147.569 Personen ohne dokumentierte Krebsdiagnose 69.381 auch eine dokumentierte ATE-Diagnose (Risiko: 0,01; 95%-KI: 0,01–0,01). Das relative Risikoverhältnis (RR) einer ATE bei Personen mit dokumentierter Krebserkrankung im Vergleich zu Personen ohne dokumentierte Krebserkrankung betrug daher 6,88 (95%-KI: 4,81–9,84). Bei jüngeren Krebspatienten war dieses RR am größten (Abb. 1). In Bezug auf die verschiedenen Tumortypen zeigten Patienten mit bösartigen Neubildungen der Harnorgane das höchste relative Risiko für arterielle Thrombosen (RR: 7,16; 95%-KI: 6,74–7,61), während Patienten mit bösartigen Neubildungen der Schilddrüse und sonstigen endokrinen Drüsen das geringste relative Risiko (RR: 2,49; 95%-KI: 2,00–3,10) aufwiesen.
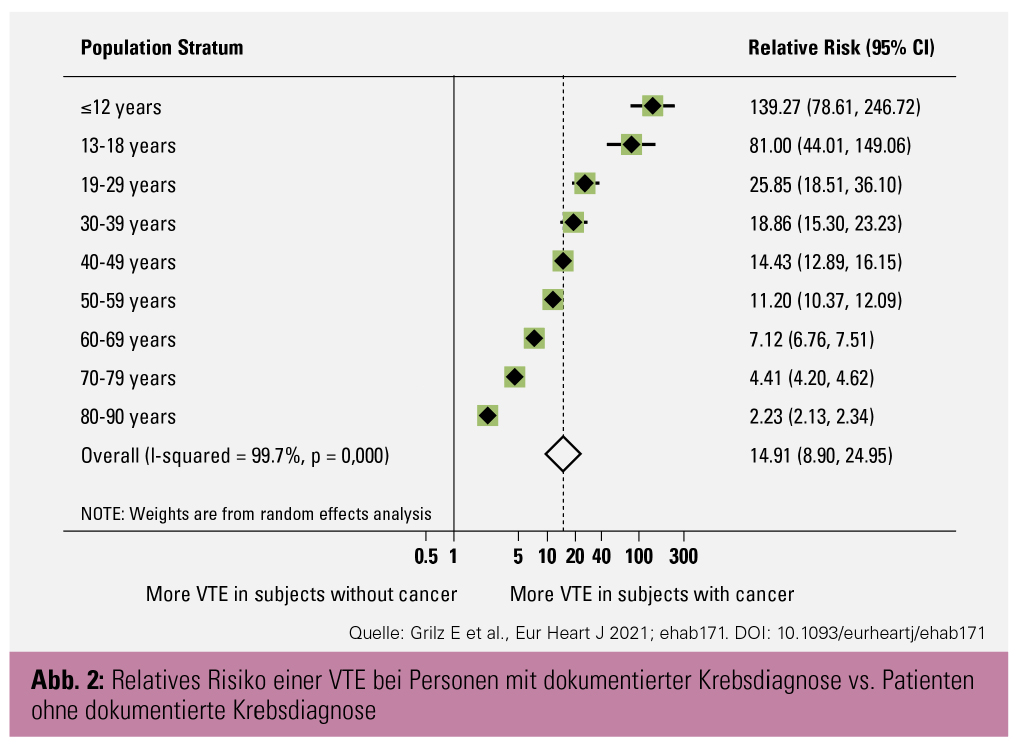
Relatives Risiko tumorassoziierter VTE: Insgesamt hatten 7.244 der 158.675 Personen mit dokumentierter Krebsdiagnose auch eine dokumentierte VTE-Diagnose (Risiko: 0,05; 95%-KI: 0,04–0,05). Im Vergleich dazu hatten von 8.147.569 Personen ohne dokumentierte Krebsdiagnose 29.307 eine dokumentierte VTE-Diagnose (Risiko: < 0,01; 95%-KI: 0,00–0,00). Das RR der VTE bei Personen mit dokumentierter Krebserkrankung im Vergleich zu Personen ohne dokumentierte Krebserkrankung betrug 14,91 (95%-KI: 8,90–24,95) und war bei jüngeren Krebspatienten am höchsten (Abb. 2). Die Analyse stratifiziert nach Tumortypen zeigte, dass Patienten mit bösartigen Neubildungen des mesothelialen und Weichteilgewebes das höchste (RR: 19,32; 95%-KI: 17,41–21,43) und Patienten mit bösartigen Neubildungen der Lippe, der Mundhöhle und des Pharynx das niedrigste relative Risiko für eine Thrombose hatten (RR: 6,62; 95%-KI: 5,61–7,81).
Anteil der Patienten mit Krebs an allen Patienten mit ATE/VTE-Diagnosecode: Insgesamt hatten 8.559 der 77.940 (10,98 %; 95%-KI: 10,76–11,20) Patienten mit einem ATE-Diagnosecode auch eine dokumentierte Krebsdiagnose. Innerhalb der Gruppe der Patienten mit ATE waren bösartige Neubildungen der Verdauungsorgane am häufigsten (2,81 %; 95%-KI: 2,69–2,93) und bösartige Neubildungen des Knochens und Gelenkknorpels am seltensten (0,06 %; 95%-KI: 0,04–0,08). Ein Krebsdiagnosecode war bei 7.244 der 36.551 Patienten mit einem VTE-Diagnosecode vorhanden. Somit betrug der Anteil der Patienten mit Krebs in der Gruppe aller Patienten mit VTE 19,82 % (95%-KI: 19,41–20,23). Innerhalb der Gruppe der Patienten mit VTE waren bösartige Neubildungen ungenau bezeichneter, sekundärer und nicht näher bezeichneter Lokalisationen die häufigste Tumorart (7,62 %; 95%-KI: 7,35–7,90) und bösartige Neubildungen des Knochens und des Gelenkknorpels die am wenigsten häufige Tumorart (0,15 %; 95%-KI: 0,11–0,19).
Resümee
Zusammenfassend lässt sich sagen, dass das relative Risiko für ATE und VTE in allen Altersgruppen bei Personen mit Krebs wesentlich höher war, wodurch das Konzept gemeinsamer Risikofaktoren und Pathophysiologie zwischen diesen Erkrankungen unterstützt wird. Unsere Metadaten auf Bevölkerungsebene beschreiben nicht nur die Belastung durch VTE bei Patienten mit Krebs, sondern unterstützen auch das Konzept, dass eine Krebsdiagnose mit einer ATE assoziiert ist. Weitere Forschung ist notwendig, um die Epidemiologie der tumorassoziierten Thrombose besser zu verstehen und mehr Erkenntnisse über Langzeitkomplikationen von Tumortherapien zu gewinnen. Schließlich ist es notwendig, das Bewusstsein medizinischer Fachkräfte für tumorassoziierte ATE und VTE zu schärfen, da diese in einer alternden Bevölkerung immer häufiger auftreten werden.
| Service: European Heart Journal |
|---|
| „Relative Risk of Arterial and Venous Thromboembolism in Persons with Cancer versus Persons without Cancer – A Nation-Wide Analysis” Ella Grilz, Florian Posch, Stephan Nopp, Oliver Königsbrügge, Irene M. Lang, Peter Klimek, Stefan Thurner, Ingrid Pabinger, Cihan Ay |