Asymptomatische Carotisstenose
ACST-2: Ein weiterer Schritt im Management der asymptomatischen Carotisstenose
|
Prim. Univ.-Doz. Dr. |
 |
|
Prim. Univ.-Doz. Dr. |
 |
Die abgangsnahe Stenose der Arteria carotis interna (ACI) ist in Hinblick auf Evidence-based Medicine (EBM) das bestuntersuchte Gefäß im Körper (außerhalb der Aorta). Schon vor dem Jahr 2000 wurde in mehreren randomisierten Studien ein Benefit der chirurgischen Carotis-Endarterektomie (CEA) in der Sanierung von symptomatischen Engstellen der ACI im Vergleich zur konservativen Therapie nachgewiesen (ECST1 und NASCET2). Begleitende Studien (ACAS3, 4 und ACST-15) wiesen nach, dass auch bei asymptomatischen Stenosen der ACI die CEA das Auftreten ipsilateraler Schlaganfälle im Vergleich zur konservativen Therapie signifikant reduziert. Die Basis für gute Erfolgsergebnisse im invasiven Arm waren immer geringe perioperative Komplikationsraten.
Danach folgte in randomisierten Studien (CREST6, ICSS7, SPACE8, EVA3S9) der Vergleich CEA zur endovaskulären Sanierung durch Stentimplantation (Carotid Artery Stenting, CAS). Eine rezente Metaanalyse zeigt nach CAS eine höhere Zahl an leichten (non-disabling) periprozeduralen Schlaganfällen in der Behandlung symptomatischer Carotisstenosen (vor allem bei Patient:innen älter als 70 Jahre). Im Langzeitverlauf ist CAS ebenso effektiv wie die CEA in der Verhinderung ipsilateraler Schlaganfälle. Die Kombination von periprozeduraler Sicherheit und Langzeitergebnissen favorisiert die CEA.
Die ASCT-2-Studie
Das ACST-2 Trial10 vergleicht randomisiert CAS und CEA in der Behandlung asymptomatischer Carotisstenosen im Langzeitverlauf und sollte zusammen mit CREST-2 letzte offene Fragen beantworten. In die Studie wurden insgesamt 3.625 Patient:innen zur Behandlung einer asymptomatischen Stenose der ACI zu CEA (n = 1.814)/CAS (n = 1.811) randomisiert. Die Einschlusskriterien waren behandlungsbedürftige (zumindest 60 %) durch Duplexultraschall dokumentierte Stenosen (aufgrund derer die behandelnden Ärztinnen und Ärzte eine Revaskularisation befürworteten). Patient:innen mit Schlaganfällen oder TIA in den vorangegangenen sechs Monaten blieben von der Teilnahme ausgeschlossen. Die Stenosen mussten für jede Behandlung (CEA/CAS) geeignet sein. Für die Stentimplantation waren duale Thrombozytenaggregation und CE-zertifizierte Stents die Vorgabe. 130 Zentren nahmen an der Studie teil. Verglichen wurden die prozedurale Sicherheit und die Langzeiteffektivität in Hinsicht auf Verhinderung ipsilateraler Schlaganfälle. Die Patientengruppe war zu 70 % männlich, 30 % waren Diabetiker:innen, das Durchschnittsalter lag bei 70 Jahren, das mittlere Follow-up betrug 5 Jahre. Die begleitende medikamentöse Therapie umfasste bei 80–90 % der Teilnehmer:innen Lipidsenker, antithrombotische und antihypertensive Medikation und entspricht damit gängigen Vorstellungen (gängiger Praxis).
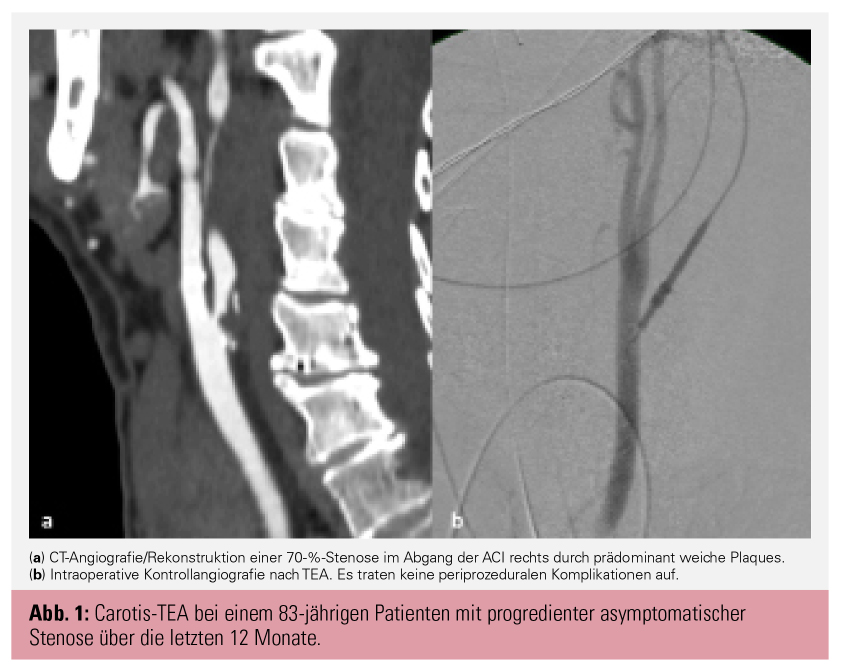
Hervorzuheben ist bei den Ergebnissen für beide Revaskularisationsmethoden die niedrige Rate prozeduraler Komplikationen (schwere Schlaganfälle = Modified Ranking Scale [mRS] 3–5 oder Tod innerhalb eines Monats nach dem Eingriff) bei lediglich 1 % (15 Ereignisse in der CAS-Gruppe, 18 in der TEA-Gruppe). Etwas höher war die Rate an leichten (non-disabling = mRS: 0–2) Schlaganfällen. Diese war in der CAS-Gruppe etwas höher als in der TEA-Gruppe (CAS: 48 Ereignisse, TEA: 29 Ereignisse, 2,7 % vs. 1,6 %, p = 0,03). Im Langzeitverlauf (Kaplan-Meier 5-Jahres-Werte) war die Rate aller schweren Schlaganfälle/Todesfälle (inkl. periprozeduraler Schlaganfälle) mit 3,5 % (CEA) und 3,4 % (CAS) für beide Behandlungsgruppen sehr niedrig (Long-Term-Stroke-Ratio schwerer Schlaganfälle von 0,98 für CEA versus CAS). Ohne prozedurale Schlaganfälle betrugen die Raten an schweren Schlaganfällen/Tod 2,5 % für jede Behandlungsgruppe. Bei allen Schlaganfällen (disabling und non-disabling) hatte die CEA mit 4,5 % im Vergleich zu CAS mit 5,3 % Vorteile, allerdings nicht signifikant (Rate Ratio [RR] 1,16, 95%-KI 0,86–1,57; p = 0,33). Bei allen Schlaganfällen mit mRS > 1 (das bedeutet leichte bis schwere Einschränkungen im täglichen Leben) lagen CAS und CEA mit jeweils 77 Events gleichauf. Schlaganfälle mit nur geringen Einschränkungen (mRS 0–1) waren bei der CEA geringer (n = 49) als bei CAS (n = 77), d. h., es fand sich ein Excess Risk von 1–2 % für CAS. Alison Halliday als Principal Investigator von ACST-2 präsentierte auch am LINC 2022 eine Metaanalyse aller Trials mit asymptomatischen Carotisstenosen (ACST-2, CREST, SPACE-211, ACT-112), welche die Studienergebnisse von ACST-2 diesbezüglich bestätigte.
Fazit
Von den großen randomisierten Studien ist lediglich CREST-213, 14 noch offen, mit den dort erzielten Ergebnissen wird eine bessere Evaluation der Wertigkeit der konservativ medikamentösen Behandlung besser abzuschätzen sein, da diese als Behandlungsarm inkludiert war. Eine der wenigen Limitationen der ACST-2-Studie (und eigentlich vieler Carotisstudien) ist das Fehlen einer Vergleichsgruppe mit maximaler verfügbarer medikamentöser Therapie, mit dem Hinweis, dass die gerade verfügbare konservative Therapie optimaler ist als die, die zum Zeitpunkt des Studienbeginns vorlag.
Was spricht für die Chirurgie?
|
Dr.in Magdalena Forstner |
 |
 |
Nach der koronaren Herzerkrankung und nach Karzinomen stellt der Schlaganfall die dritthäufigste Todesursache weltweit dar. In Österreich erleiden jährlich bis zu 25.000 Menschen einen Schlaganfall – europaweit sind es 1,4 Millionen Schlaganfälle jährlich! Atherosklerotische Veränderungen der Arteria carotis interna oder der Arteria cerebri media sind für 25 % der ischämischen Schlaganfälle ursächlich, und bis zu 15 % der thromboembolischen Insulte können auf eine Carotisstenose von über 50 % zurückgeführt werden. Zu den weiteren Ursachen zählen eine intrakranielle Small Vessel Disease (25 %), kardiale Embolien (25 %) und andere spezifische seltene Ursachen (5 %). In 20 % der Fälle bleibt die Emboliequelle trotz umfangreicher Abklärung unklar.1 Hinsichtlich der Behandlung einer Carotisstenose ist das Ziel jeder medizinischen Intervention die Vermeidung eines Schlaganfalles. Es ist wichtig, daran zu erinnern, dass jede symptomatische Carotisstenose bis zum ersten thromboembolischen Ereignis asymptomatisch war und damit ein potenzielles Risiko für betroffene Patient:innen darstellt.

Konservative Therapieoptionen
Wie allen Patient:innen mit atherosklerotischen Veränderungen der Arterien ist auch jenen mit Carotisstenosen eine Modifikation des Lebensstils zu empfehlen. Hier stehen insbesondere eine Gewichtsreduktion, konsequente Nikotinkarenz und ausreichende Bewegung im Vordergrund. Rauchen verdreifacht das Risiko, eine hochgradige Carotisstenose zu entwickeln, und verdoppelt die Prävalenz des ischämischen Schlaganfalls. Im Gegensatz dazu verringert regelmäßige mittel- bis höhergradige körperliche Belastung das Schlaganfallrisiko um 25 %. Weiters ist auf eine optimale medikamentöse Therapie (best medical therapy, BMT) zu achten.
Thrombozytenaggregationshemmer: Es gibt bisher keine klare Evidenz dafür, dass bei Personen mit asymptomatischen Carotisstenosen die Verabreichung von Aggregationshemmern eine Stenoseprogression oder das Insultrisiko senken würde, die Einnahme wird allerdings zur Modifizierung des kardiovaskulären Gesamtrisikos empfohlen. Im Gegensatz dazu ist eine Kombinationstherapie aus Acetylsalicylsäure und Clopidogrel bei Patient:innen mit symptomatischen Carotisstenosen essenziell.2
Lipidsenker: Die Verabreichung von Statinen wirkt sich bei symptomatischen und asymptomatischen Patient:innen sowohl auf das Schlaganfallrisiko wie auch auf die kardiovaskuläre Ereignisrate positiv aus. In Anlehnung an die Empfehlungen der American Heart Association ist bei symptomatischen Patient:innen eine Senkung des Gesamtcholesterins auf unter 3,5 mmol/l (< 135 mg/dl) sowie von LDL-C auf unter 1,8 mmol/l (< 70 mg/dl) bzw. auf 50 % vom Ausgangswert anzustreben. Die Verabreichung von PCSK9-Inhibitoren kann bei Patient:innen mit einer Statinunverträglichkeit oder bei Nichterreichen der Zielwerte erwogen werden.2
Invasive Behandlungsformen
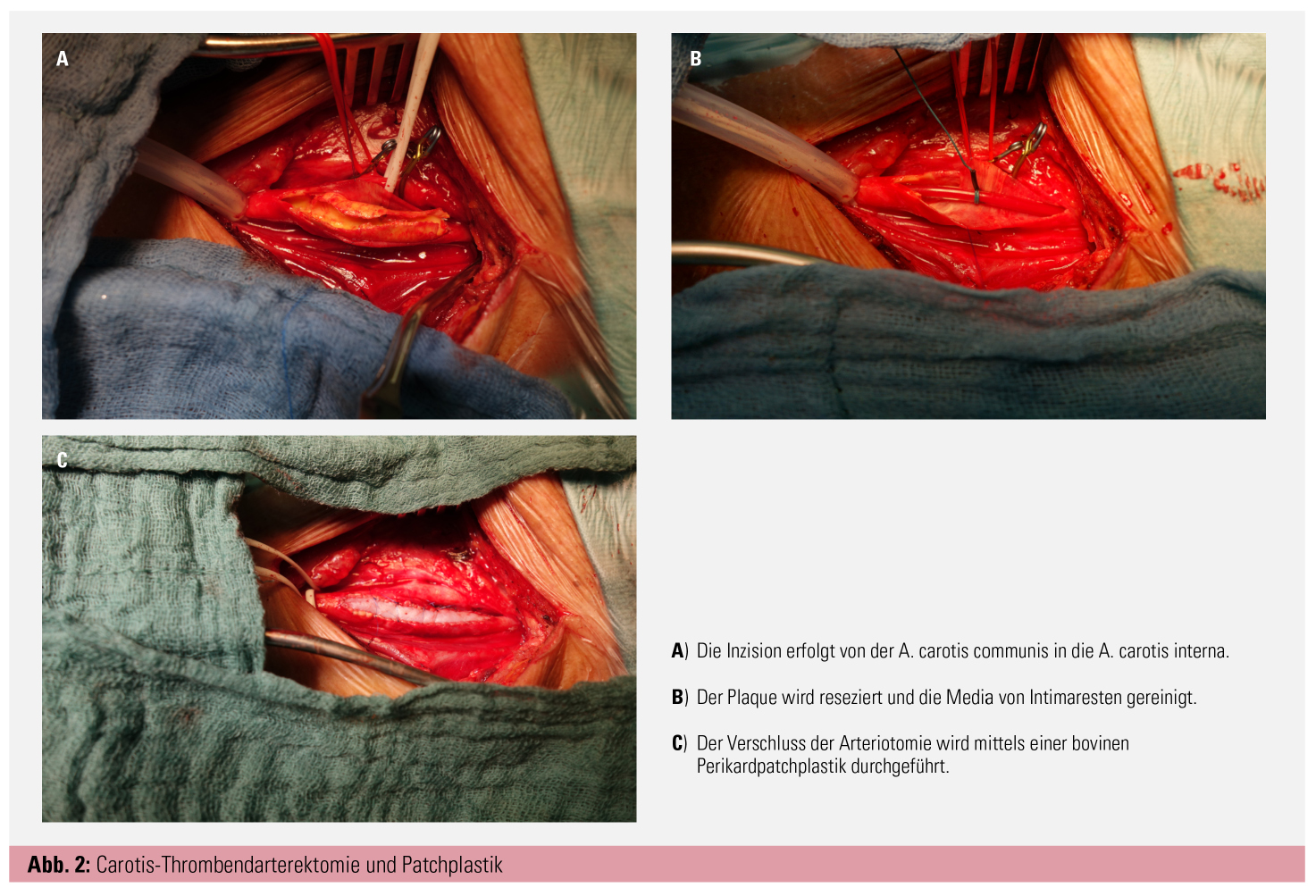
Die offen-chirurgische Carotisoperation (Carotid Endarterectomy, CEA) kann sowohl in Narkose als auch in Lokal- beziehungsweise Regionalanästhesie durchgeführt werden (Abb. 2). Die Halsschlagader wird geklemmt und die stenosierende Plaque chirurgisch entfernt. Das Klemmen selbst und die vorübergehend verminderte Durchblutung des Gehirns gehen mit einem geringen Schlaganfallrisiko während des Eingriffes einher, sehr selten sind andere Komplikationen wie Herzinfarkte oder Narkosezwischenfälle. Das Risiko schwerer Komplikationen wird von den meisten Kliniken mit 1–1,5 % angegeben, laut den geltenden Richtlinien muss das Gesamtrisiko schwerer Komplikationen (Schlaganfall oder Tod) unter 3 % liegen.2 Weniger gravierende Komplikationen wie Verletzungen der Kopfnerven, was mit einer zumeist vorübergehenden Heiserkeit, einer Sprech- oder Schluckstörung einhergehen kann, oder Nachblutungen und Wundinfektionen treten etwas häufiger auf.
Die endovaskuläre Stentimplantation (Carotid Artery Stenting, CAS) wird im Allgemeinen in Lokalanästhesie über einen perkutanen Zugang in der Leiste durchgeführt. Die Stenose muss zuerst mit einem Draht passiert werden, um dann einen Stent im Bereich der Verengung platzieren zu können. Die atherosklerotische Plaque wird nicht entfernt, sondern durch den Stent an die Wand gedrückt. Die Passage mit dem Führungsdraht und auch die Freisetzung des Stents können zur Mobilisierung von atherothrombotischem Material aus der Plaque und damit zu einem embolischen Schlaganfall führen. Die Entwicklung von verschiedenen Protektionssystemen sowie von Stents mit einem besonders engen Maschengitter haben geholfen, das periinterventionelle Schlaganfallrisiko in den letzten Jahren zu reduzieren. Als Zugangskomplikationen im Bereich der Leiste werden Nachblutungen häufiger beobachtet als Infektionen.
Indikation zur chirurgischen Intervention
Für die weitere Therapiewahl ist es wichtig, grundsätzlich zwischen asymptomatischen und symptomatischen Stenosen zu unterscheiden. Eine Verengung der Arteria carotis, die im Verlauf der vorangegangenen sechs Monate neurologische Symptome verursacht hat, wird als „symptomatisch“ definiert. Was das Vorgehen bei Patient:innen mit symptomatischen Carotisstenosen betrifft, besteht weitgehende Einigkeit: Bei einem Stenosegrad unter 50 % wird – bis zum Auftreten neuerlicher Symptome – ein konservatives Vorgehen sowie eine Optimierung der medikamentösen Therapie empfohlen. Im Gegensatz dazu profitieren Patient:innen ab 50%igen symptomatischen Carotisstenosen in der Regel von einer invasiven Therapie, wobei der Behandlungsvorteil mit dem Stenosegrad ansteigt. Aufgrund des hohen Risikos von rezidivierenden Schlaganfällen von 10–25 % nach dem Erstereignis ist eine frühzeitige Revaskularisation der Arteria carotis anzustreben.3
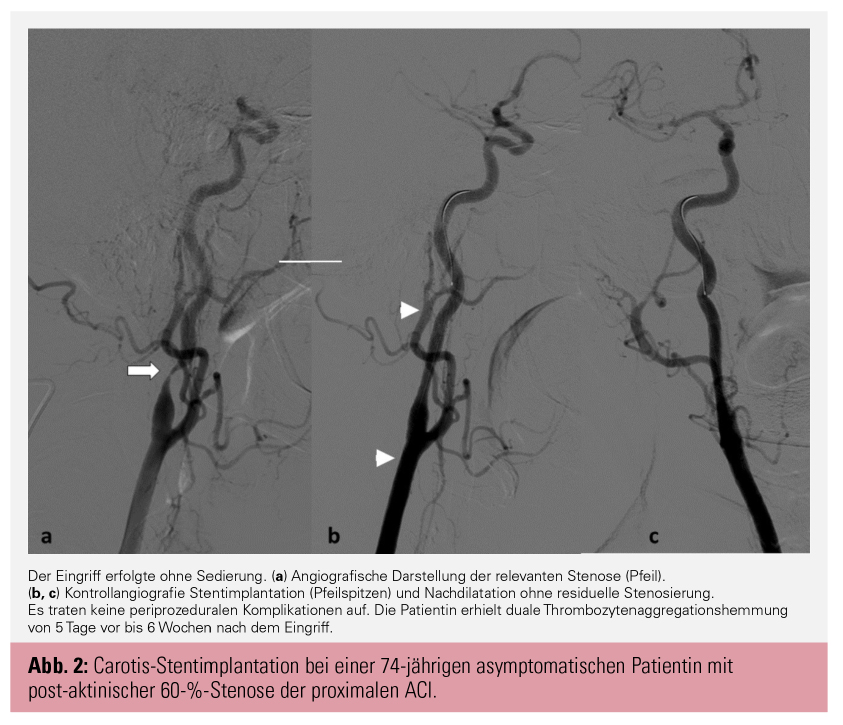
Für Patient:innen mit asymptomatischen Carotisstenosen > 60 % konnten ebenfalls mehrere Studien nachweisen, dass die Carotis-Endarterektomie einem BMT alleine überlegen ist: die grundlegenden Studien zum natürlichen Verlauf der asymptomatischen Carotisstenose sind die randomisiert kontrollierten Untersuchungen Veteran’s Affairs Co-operative Study (VACS)4, ACAS5 und ACST-16. Es zeigten sich bei VACS und ACAS ipsilaterale Insulte bei BMT allein mit einer Häufigkeit von 2 % pro Jahr, bei der rezenteren ACST-1 reduzierte sich die Insultrate auf 1 % pro Jahr, was von mehreren Autor:innen auf die zwischenzeitlich deutlich verbesserte BMT zurückgeführt wurde, vor allem auf den breiten Einsatz von Statinen und Thrombozytenaggregationshemmern.7, 8 Im Falle der ACST-1-Studie konnte im 10-Jahres-Follow-up eine Halbierung des Insultrisikos durch die CEA im Vergleich zu einer alleinigen medikamentösen Therapie gezeigt werden.9
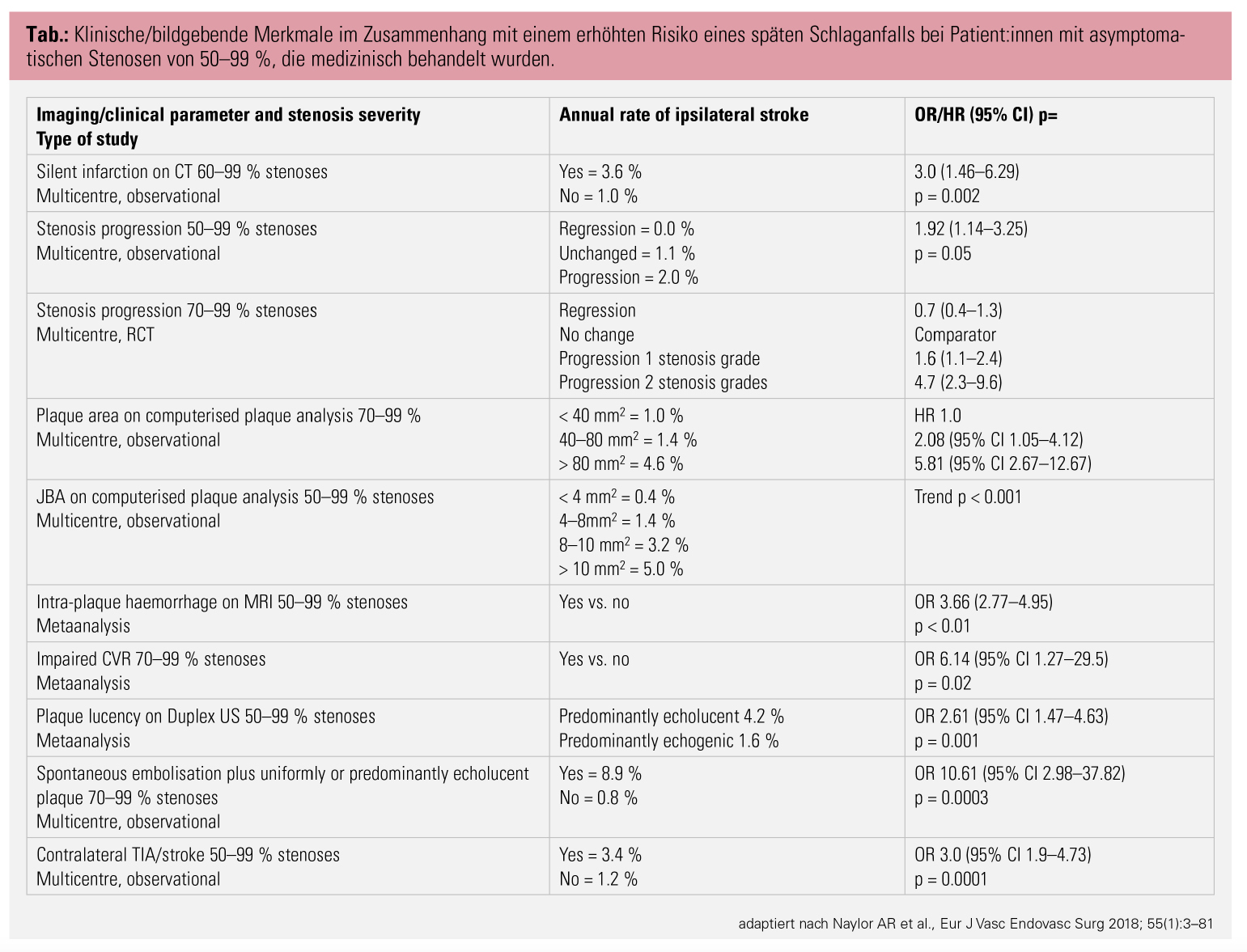
Weitere Risikofaktoren: Eine Behandlungsindikation ergibt sich allerdings nicht nur durch den Stenosegrad allein. Unter anderem erhöhen folgende Faktoren das carotisassoziierte Schlaganfallrisiko: stumme Infarkte im Schädel-CT, eine nachgewiesene Stenoseprogression, verminderte Plaqueechogenität, eine ungleichmäßige Plaquemorphologie, Mikroembolien in der transkraniellen Dopplersonografie sowie ein Zustand nach kontralateraler transitorisch-ischämischer Attacke (TIA) oder Insult.2, 7, 10, 11 Um für betroffene Patient:innen mit asymptomatischen Carotisstenosen ein sinnvolles Nutzen-Risiko-Verhältnis zu erreichen, muss die Lebenserwartung zumindest 5 Jahre betragen, und das dokumentierte institutionelle Risiko für schwere periprozedurale Komplikationen (Insult und Letalität) darf nicht über 3 % betragen.2, 7
Offen-chirurgische oder interventionelle Therapie?
Für Patient:innen mit symptomatischen Carotisstenosen ist eine bis zu zweieinhalbfach erhöhte periinterventionelle Insultrate nach Carotisstenting dokumentiert, weshalb in den meisten Fällen der chirurgischen Behandlung der Vorzug zu geben ist.2 Für Patient:innen mit asymptomatischen Carotisstenosen sind die vorliegenden Daten teilweise weniger konsistent. Hier ist es wichtig, zwischen Registerstudien und randomisierten Multicenterstudien zu unterscheiden. In großen Registern wie dem Deutschen Register zur Carotis-Revaskularisation gehen sowohl CAS als auch CEA mit einem periprozeduralen Schlaganfallrisiko von etwa 1 % einher.7 Es muss aber berücksichtigt werden, dass die behandelnden Spezialist:innen ihren Patient:innen selbstverständlich die individuell besser geeignete und/oder aufgrund der Erfahrungen im behandelnden Zentrum bevorzugte Therapieform zukommen ließen; es ist daher klar, dass bei Registerstudien ein Selektionsbias besteht. Darüber hinaus werden Behandlungsergebnisse nicht zwingend objektiv, im konkreten Fall von einem Facharzt/einer Fachärztin für Neurologie, kontrolliert. Damit ergibt sich ein weiterer potenzieller Bias, der tatsächlich bestehende Unterschiede zwischen dem prozeduralen Risiko von CAS und CEA verschleiern könnte. Alle bisher erschienenen randomisierten Studien zum Thema haben nicht ausreichend Patient:innen eingeschlossen, um die drängende Frage, welche Therapieform mit einem geringeren prozeduralen Risiko verbunden ist, abschließend zu klären. Eine rezent durchgeführte Metaanalyse der vier Studien mit den größten Fallzahlen – CREST-1, ACT-1, SPACE-2 und ACST-2 – hat ergeben, dass das periprozedurale 30-Tage-Risiko, einen Schlaganfall zu erleiden und/oder daran zu versterben, nach CAS ca. 1,5-fach höher ist als nach CEA (p = 0,0046 hinsichtlich Schlaganfalls, p = 0,017 hinsichtlich Schlaganfalls und Tod). Im Gegensatz dazu ist das Risiko, einen perioperativen Myokardinfarkt zu erleiden, bei CAS-Patient:innen signifikant niedriger als nach CEA.12
Einen besonderen Stellenwert nimmt die rezenteste dieser großen randomisierten Studien, ACST-2, ein, in welche 3.625 Patient:innen eingeschlossen wurden. Auf den ersten Blick scheint der Vorteil der CEA hier nur noch minimal zu sein. Es muss allerdings berücksichtigt werden, dass die Fallzahl der eingeschlossenen Patient:innen immer noch zu gering ist, um einen Vorteil einer der beiden Behandlungsmethoden definitiv darzulegen.13 Bei genauer Betrachtung zeigt sich, dass die Konfidenzintervalle sowohl des Risikos für „perioperativer Schlaganfall oder Tod“ (odds ratio [OR] 1,35, 95%-KI 0,91–2,03) als auch für „schwerer Schlaganfall“ („disabling stroke“; OR 1,09, 95%-KI 0,46–2,61) bei einer ausreichend hohen Fallzahl mit großer Wahrscheinlichkeit einen signifikanten Vorteil für die CEA erwarten lassen. Dies spiegelt sich auch in der Neuauflage der Behandlungsrichtlinien der Europäischen Gesellschaft für Gefäßchirurgie wider (European Society for Vascular Surgery [ESVS] 2023 Clinical practice guidelines on the management of atherosclerotic carotid and vertebral artery disease): Für Patient:innen mit asymptomatischen Carotisstenosen gibt es eine Klasse-IIa- Empfehlung zur CEA; Carotisstenting wird im Sinne einer Klasse-IIb-Empfehlung als potenzielle Alternative genannt. Patient:innen mit einem erhöhten perioperativen Behandlungsrisiko aufgrund internistischer Komorbiditäten sollen bevorzugt einer endovaskulären Behandlung zugeführt werden.2 Dasselbe gilt für ungünstige anatomische Voraussetzungen wie eine hohe periphere Stenose ebenso wie für mögliche frühere Behandlungen (Rezidiveingriff, Bestrahlung, Neck-Dissektion).10, 14
Resümee
Die Carotis-Chirurgie ist in erfahrenen Händen eine sichere Methode mit sehr guter Langzeitprognose zur Behandlung einer asymptomatischen ebenso wie einer symptomatischen Stenose der Arteria carotis. Unter strenger Indikationsstellung und in spezialisierten Zentren in hoher Qualität ausgeübt, kann eine Carotisoperation Patient:innen vor einem möglicherweise lebensbeeinträchtigenden oder gar lebensgefährdenden Schlaganfall schützen. Im Fokus soll nicht nur der Stenosegrad, sondern vor allem die Plaquemorphologie sein. Bei der Operation wird der gesamte embolisierungsfähige Plaque entfernt, beim Stenting wird dieser lediglich an die Wand gedrückt. Das Best Medical Treatment hat sich über die vergangenen Jahre deutlich gebessert und ist ein unerlässlicher Teil der Behandlung von Patient:innen mit einer asymptomatischen Carotisstenose.
Was spricht für die konservative Behandlung?
|
OA Dr. Benjamin Matosevic (li) |
 |
 |
Die Prävalenz der asymptomatischen Carotisstenose steigt mit dem Alter und liegt insgesamt bei 1–2 %, bei Männern ist sie höher als bei Frauen. Die asymptomatische Carotisstenose stellt uns im klinischen Alltag immer wieder vor eine Herausforderung. Es gilt zu entscheiden, ob der:die vor uns sitzende Patient:in einer operativen Versorgung zugeführt werden soll oder nicht. Dazu gibt es drei rezente Guidelines: Eine 2021 publizierte Richtlinie der European Stroke Organisation (ESO), eine ebenfalls 2021 publizierte Richtlinie der Society for Vascular Surgery (SVS) sowie die bald erscheinende Guideline der Europäischen Gesellschaft für Gefäßchirurgie (ESVS).
Guideline-Empfehlungen: Die ESO empfiehlt, dass bei allen Patient:innen mit einer Stenose von ≥ 60 % (nach NASCET-Kriterien) im Falle eines individuell hohen Schlaganfallrisikos die chirurgische Sanierung mittels Carotisendarteriektomie (CEA) über das medikamentöse Management zu stellen ist. Ab einem Alter von 75 Jahren soll eine exakte individuelle Risiko-Nutzen-Abwägung erfolgen. Bei solchen ausgesuchten Patient:innen kann eine CEA dann in Betracht gezogen werden, wenn das Schlaganfallrisiko unter bester medikamentöser Therapie („best medical treatment“, BMT) hoch ist und die Lebenserwartung noch zumindest 5 Jahre beträgt. Die Richtlinie der SVS schlussfolgert ähnlich, setzt den Stenosegrad mit ≥ 70 % jedoch höher an. Die ESVS empfiehlt die CEA ebenfalls ab einem Stenosegrad von 60 % (nach NASCET). Zusätzlich sollte zumindest ein bildgebender Faktor, der ein erhöhtes Embolierisiko in sich birgt, vorhanden sein.
Risikoreduktion durch BMT
Die meisten der in den Richtlinien zitierten randomisiert kontrollierten Studien wurden vor ca. 20 Jahren publiziert. Sie zeigten ein Schlaganfallrisiko von ca. 2 % pro Jahr im medikamentösen Arm. In rezenteren Studien sinkt das Risiko auf einen Wert von 0,34 % bis 1,4 %. Auch bei Patient:innen mit hoch- und höchstgradigen Stenosierungen (70–99 % nach NASCET) lag in einer ca. 3.700 Teilnehmer:innen umfassenden retrospektiven Analyse der Jahre 2008 bis 2012 von Chang et al. aus Kalifornien die jährliche Inzidenz bei 0, 9 % unter stringenter medikamentöser Therapie. Keyhani et al. analysierten retrospektive Daten von Veteranenregistern aus den USA. Sie zeigten ein 5-Jahres-Risiko für einen Schlaganfall unter BMT von 7,8 % vs. 5,6 % nach CEA. Die Risikoreduktion von 2,3 % war nicht mehr signifikant, wenn das allgemeine Mortalitätsrisiko eingerechnet wurde. Ein retrospektiver Vergleich derselben Autorengruppe zum Thema Stent vs. BMT zeigte ein statistisch identes 5-Jahres-Risiko für Schlaganfälle in beiden Gruppen (6,9 % vs. 7,1 %).
Adäquate medikamentöse Therapie
Acetylsalicylsäure: Die adäquate medikamentöse Therapie umfasst einerseits die Gerinnungshemmung, andererseits die optimale Behandlung der Risikofaktoren. An erster Stelle der Thrombozytenfunktionshemmer ist die Acetylsalicylsäure (ASS) mit einer Dosis von 100 mg pro Tag zu nennen. Bei ASS-Unverträglichkeit bzw. im Falle einer konkomitanten peripheren arteriellen Verschlusserkrankung (pAVK) oder koronaren Herzkrankheit (KHK) ist auf Basis der CAPRIE-Studie Clopidogrel als Alternative zu nennen. Die Kombination aus ASS und Dipyridamol kommt weiterhin als Therapiealternative in Frage. In der COMPASS-Studie erwies sich die Kombination von ASS und Rivaroxaban 2,5 mg zweimal täglich als effektiv in der Verhinderung des kombinierten Endpunktes (Schlaganfall, Myokardinfarkt und vaskulärer Tod) versus einer ASS-Monotherapie (5,4 % vs. 4,1 %, p < 0,001). Demgegenüber war jedoch die Rate an Blutungen im Kombinationsarm höher (3,1 % vs. 1,9 %, p < 0,001). Die Studie umfasste Patient:innen mit stabiler arteriosklerotischer Gefäßerkrankung (KHK, pAVK, cAVK). In der Subgruppe der Patient:innen mit Carotisstenose war der Endpunkt vermindert – allerdings statistisch nicht signifikant. Außerdem waren ein rezenter, nichtlakunärer Schlaganfall sowie ein lakunärer oder hämorrhagischer Schlaganfall Ausschlussgründe. Somit ist nach Meinung der Autor:innen die Einsetzbarkeit dieser Therapiemöglichkeit a priori etwas eingeschränkt.
Cholesterinsenker: Die Risikoreduktion durch den Einsatz von Cholesterinsenkern ist ebenfalls bestens belegt. Patient:innen mit asymptomatischer Carotisstenose fallen in die Hochrisikogruppe und sollten ein Ziel-LDL-Cholesterin von ≤ 55 mg/dl erreichen bzw. sollte das Ausgangs-LDL zumindest halbiert werden. Es stehen mittlerweile mehrere Substanzklassen zur Auswahl. An erster Stelle sind die Statine zu nennen, wobei nur mehr die hochpotenten Wirkstoffe Atorvastatin und Rosuvastatin zum Einsatz kommen sollen. Hochpotente Statine senken das LDL-Cholesterin um bis zu 50 %. Bei Erreichen der Zielwerte zeigte sich in der „Treat Stroke to Target“-Studie ein signifikanter Benefit in Bezug auf Tod, Schlaganfall, Myokardinfarkt und revaskularisierende Eingriffe. Außerdem kann additiv zu den genannten Statinen der Cholesterinabsorptionshemmer Ezetimib zum Einsatz kommen. Es kann das LDL-Cholesterin um bis zu 15 % senken.
Bempedoinsäure: Als dritte orale Substanzklasse ist die Bempedoinsäure (BA) zu nennen. Sie hemmt in der Leber die ATP-Citrat-Lyase (ACL), ein der HMG-CoA-Reduktase vorgeschaltetes Enzym in der Cholesterinsynthese. Die mögliche Senkung des Ausgangs-LDL-Wertes beträgt ebenfalls ca. 15 %.
Die PCSK9-Inhibitoren Evolocumab und Alirocumab werden subkutan appliziert. Eine LDL-Senkung von 55–75 % wird beschrieben. Die Verabreichung erfolgt alle 14 Tage. Wirkort der beiden letztgenannten Präparate ist die Leberzelle. Die beiden Antikörper binden an das Protein PCSK9 und erhöhen durch dessen Inhibition die LDL-Rezeptordichte an der Leberzelloberfläche. Ein weiterer Wirkstoff, der in diesen Regelkreis eingreift, ist die siRNA Inclisiran. Es induziert den Abbau der PCSK9-mRNA und erhöht so ebenfalls die LDL-Rezeptordichte. Eine Senkung von ca. 50 % wurde in den Studien beobachtet. Bei Patient:innen mit Diabetes mellitus wird eine gute Kontrolle des HbA1c mit Werten von 6,5 % empfohlen. Die Blutdruckgrenze liegt je nach Alter bei 140/90 mmHg bzw. 135/85 mmHg.
Risikofaktoren
Faktoren, die das Risiko erhöhen, eine asymptomatische Stenose in eine symptomatische zu konvertieren:
- Stenosegrad: Hier zeigten Howard et al. in einer 2021 publizierten Studie, dass ein höherer Stenosegrad mit einem höheren Risiko an ipsilateralen Schlaganfällen vergesellschaftet ist. Das 5-Jahres-Risiko betrug 14,6 % bei einer Stenose von 70–99 % (nach NASCET) vs. 0 % bei einem Stenosegrad von 50–69 %. Dementsprechend zeigte sich in einer 9.300 Patient:innen umfassenden Studie von Gologorsky et al. – rezent publiziert im Fachmagazin Stroke – bei Stenosegraden von 50–69 % ein jährliches Risiko von 0,31 % über 10 Jahre. Bei ca. 30 % der Schlaganfälle nahm der Stenosegrad deutlich zu. Yan et al. publizierten 2015retrospektive Daten zu 315 asymptomatischen Carotisstenosen, deren Stenosegrad im Laufe der regelmäßigen Kontrollen bis zum Verschluss zunahm. Erstens waren 254 der 315 Verschlüsse vor 2002 registriert worden, und zweitens hatten nur 3 Patient:innen zum Zeitpunkt des Verschlusses einen Schlaganfall. Die bisher einzige randomisiert kontrollierte, jedoch vorzeitig beendete SPACE-2-Studie zeigte eine sehr niedrige Rate an Ischämien im BMT-Arm.
- Beschaffenheit der Plaques: Hypoechogenität, ein lipidreicher Plaquekern, eine Einblutung in die Plaque, Ulzeration bzw. eine dünne fibröse Berandung sowie das Gesamtausmaß der Plaque können als Risikofaktoren für eine Risikostenose erfasst werden. Des Weiteren sind eine allfällige Neovaskularisation, Mikroembolien im TCD-Monitoring sowie stumme Infarkte im cCT und cMRT hinweisend für ein höheres Schlaganfallrisiko.
Kontralaterale TIA/Strokes und männliches Geschlecht sowie eine verminderte zerebrovaskuläre Reservekapazität werden als Risiko für einen ipsilateralen Schlaganfall gesehen. Details zu den jeweiligen Odds Ratios findet man in den Guideline der ESVS. Möglich, aber in der Praxis schwer umzusetzen, ist eine PET-Untersuchung der Carotis zur Beurteilung der Plaqueinflammation, die auch als Risikofaktor für eine Ruptur und eine damit verbundene Symptomatik zu sehen ist.
Resümee
Zusammenfassend nimmt das Schlaganfallrisiko unter BMT deutlich ab. Kalzifizierte Stenosen, die im Verlauf nur langsam progredient sind und erst im Alter von über 75 Jahren hochgradig werden, zeigen ein niedriges Risiko, einen Schlaganfall zu erleiden. Bei jüngeren Patient:innen mit hohem Stenosegrad, Progredienz und/oder ungünstiger Plaquemorphologie kann in Ruhe über eine CEA nachgedacht werden. Sollten Komorbiditäten vorliegen und eine Intervention unbedingt notwendig sein, ist auch eine Stentapplikation möglich.