Chirurgische Therapie des Pankreaskarzinoms
Das Pankreaskarzinom zählt nach wie vor zu einer der gefährlichsten Krebserkrankungen solider Organe. Die Heilungschance 5 Jahre nach Diagnosestellung liegt bei unter 10 % (über alle Stadien betrachtet)1, die Inzidenz an Neuerkrankungen hat sich seit den 1980er Jahren bis heute beinahe verdoppelt (Abb. 1).2
Herausforderungen in Diagnose und Therapie
Was sind nun konkret die Problembereiche beim Pankreaskarzinom (Synonym für duktales Adenokarzinom des Pankreas, PDAC), welche die Diagnose und erfolgreiche Behandlung so schwierig gestalten?
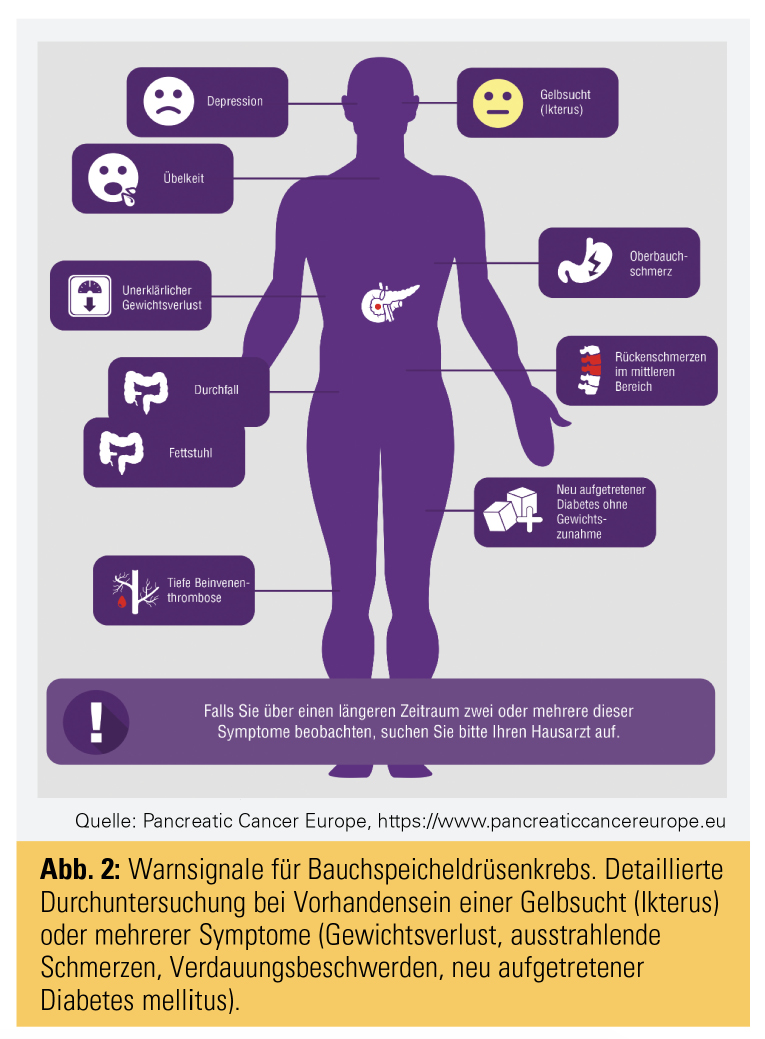
Eine besondere Herausforderung stellt die späte Diagnosestellung dar. Diese ist oftmals darin begründet, dass Beschwerden häufig spät und unspezifisch auftreten und zudem nicht eindeutig der Bauchspeicheldrüse zuzuordnen sind (Abb. 2).
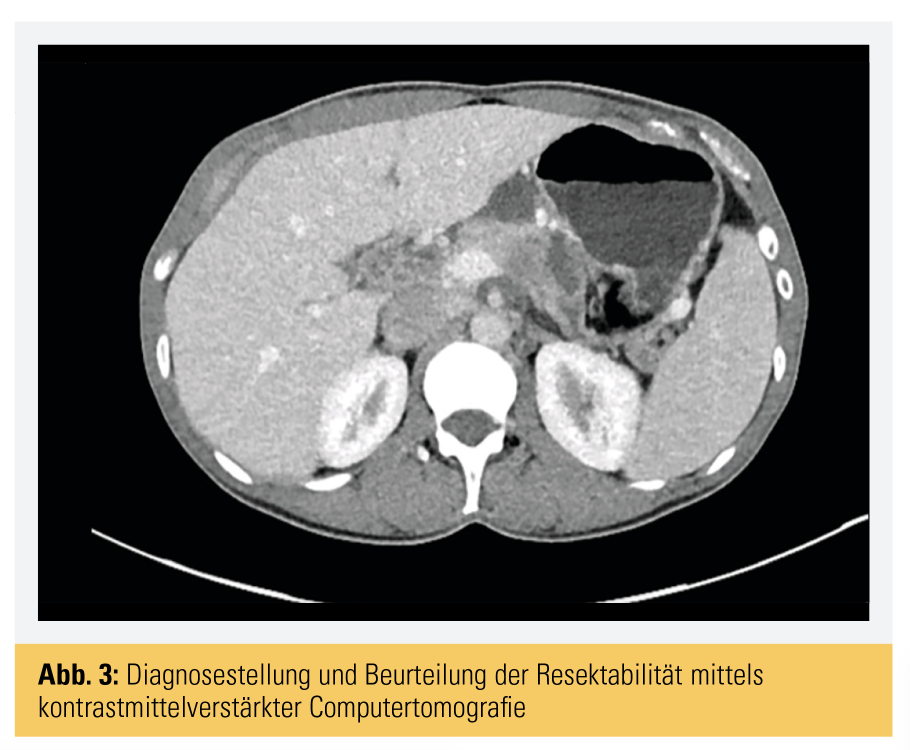
Zum Zeitpunkt der Diagnose ist die Erkrankung daher oftmals weit fortgeschritten oder bereits metastasiert und somit nicht mehr resektabel. Gegenwärtig gibt es Bemühungen, die Bevölkerung, aber auch die Ärzteschaft über diese Warnsignale aufzuklären und bei Vorhandensein eines Ikterus oder mehrerer Symptome (Gewichtsverlust, ausstrahlende Schmerzen, Verdauungsbeschwerden, neu aufgetretener Diabetes mellitus) eine gezielte Abklärung zum Ausschluss einer Erkrankung der Bauchspeicheldrüse vorzunehmen. Zur verlässlichen Diagnosestellung eines Pankreaskarzinoms ist eine kontrastmittelverstärkte Computertomografie (KM-CT) am besten geeignet (Abb. 3).3
Wird dabei eine verdächtige Raumforderung gesehen, reicht das bereits aus, um die Indikation zur Operation zu stellen. Ein histologischer Nachweis ist vor einer Operation nicht notwendig. Die lokale Resektabilität wird anhand der Nahebeziehung zu den großen Blutgefäßen, Truncus coeliacus, Leberarterie, Mesenterialarterie, Pfortader und Mesenterialvene, beurteilt. Man unterscheidet eine eindeutig resektable Situation mit Fetttrennungslinie zu den Blutgefäßen oder Umwachsung der venösen Gefäße um weniger als den halben Umfang von einer eindeutig nichtresektablen Situation mit kompletter Umwachsung venöser und/oder arterieller Blutgefäße bis zum Verschluss venöser Blutgefäße, die nach einer Resektion nicht mehr zu rekonstruieren sind. Dazwischen gibt es eine „borderline“ – grenzwertig – resektable Situation, bei der die Blutgefäße zwar zum Teil umwachsen, aber prinzipiell nach Resektion wieder zu rekonstruieren sind.4 Für diese Situation gibt es unterschiedliche Behandlungsmöglichkeiten: entweder die primäre Operation oder die zunächst neoadjuvante Behandlung mit Chemotherapie und/oder Bestrahlung mit dem Ziel der anschließenden radikalen Resektion und Rekonstruktion, falls notwendig (Abb. 4).
In zahlreichen aktuellen Studien hat sich der Erfolg einer neoadjuvanten Therapie bei borderline resektablem Pankreaskarzinom bestätigt, insbesondere durch Verlängerung des Gesamtüberlebens im Vergleich zur sofortigen Operation und anschließender (adjuvanter) Behandlung.5 Diese Ergebnisse sind einerseits durch die relevante Wirksamkeit aktueller Chemotherapie-Kombinationen zur neoadjuvanten Behandlung zu nennen. Andererseits aber auch durch eine gewisse Selektion von Patienten mit einer Erkrankung, die auf diese Chemotherapie anspricht oder zumindest unter Kontrolle gebracht werden kann und bis zur Operation kein Wachstum oder Metastasierung zeigt. Diese Gruppe von Patienten mit borderline resektabler Tumorsituation und partiellem Ansprechen oder Stabilisierung unter neoadjuvanter Therapie wies eine hohe Rate radikaler (R0-)Resektion sowie längeres Gesamtüberleben verglichen zu Patienten ohne neoadjuvante Behandlung auf.6, 7 Der Vorteil einer lokoregionalen Bestrahlung bei borderline resektablen Tumoren vor einer Operation ist in Bezug auf das Langzeitüberleben nicht eindeutig belegt und Gegenstand zahlreicher Studien, wie der österreichweit laufenden Studie „ABCSG-P02“, die eine neoadjuvante Therapie mittels FOLFIRINOX mit und ohne anschließende Bestrahlung bei Patienten mit primär nichtresektablem Pankreaskarzinom vergleicht.8
Mittlerweile gibt es Hinweise darauf, dass die anatomisch-radiologische Beurteilung der Resektabilität einer Erkrankungssituation wahrscheinlich nicht ausreichend ist und dazu weitere Faktoren wie die Tumorbiologie (Tumormarker, regionaler Lymphknotenbefall im CT, eventuell auch die allgemeine Entzündungsaktivität zum Zeitpunkt der Diagnose) sowie die Konstitution der Patienten (Performance-Status nach ECOG, Zusammensetzung der Körperkompartimente: Muskulatur, Fett) in Betracht gezogen werden müssen.9 Auch laufen derzeit Studien, um die Beurteilung der „Resektabilität“ einer Erkrankung – im Sinne einer nachhaltigen Heilung – genauer vorhersagen zu können. Hierbei handelt es sich um eine der Aufgaben des interdisziplinären Tumorboards. Dort werden sämtliche Befunde einschließlich der CT-Bilder durch Experten der beteiligten Fachrichtungen besprochen und die Behandlungsstrategie festgelegt. Dabei hat sich gezeigt, dass die Empfehlungen des Tumorboards verglichen mit der Zeit vor dem Tumorboard zu einer höheren Resektionsrate und zu einer besseren Unterscheidung von fortgeschrittenen Erkrankungen führen.10
Wichtige Faktoren zu einer erfolgreichen Behandlung des Pankreaskarzinoms sind die möglichst rasche und korrekte Diagnose sowie korrekte Beurteilung der R0-Resektabilität. Bei resektablen Erkrankungssituationen sollte die kurzfristige Resektion, auch ohne histologische Diagnosesicherung vor der Operation, innerhalb weniger Wochen ab Diagnosestellung erfolgen. Bei borderline resektablen, lokal fortgeschrittenen nichtresektabelen und metastasierten Stadien ist die histologische Diagnosesicherung durch eine transgastrische Biopsie im Rahmen einer endoskopischen Ultraschalluntersuchung (EUS) oder eine gezielte Biopsie von Metastasen vor Beginn einer neoadjuvanten Behandlung erforderlich. Im Falle von borderline resektablen Stadien sollte ein Resektionsversuch nach 3–6 Zyklen Chemotherapie und Ansprechen oder zumindest Stabilisierung der Erkrankung unternommen werden. Durch neoadjuvante Behandlung bei borderline und fortgeschrittenen nicht-resektablen Tumoren kann bei bis zu 77 % der Patienten eine Erkrankungskontrolle und bei 54 % bzw. 23 % eine R0-Resektion erzielt werden.5 Bei weit fortgeschrittenen Tumoren mit breiter Infiltration in das umgebende Gewebe und um die Blutgefäße sowie im metastasierten Stadium hat die Chirurgie keinen bzw. einen sehr geringen Stellenwert in Bezug auf Verbesserung der Überlebensprognose.
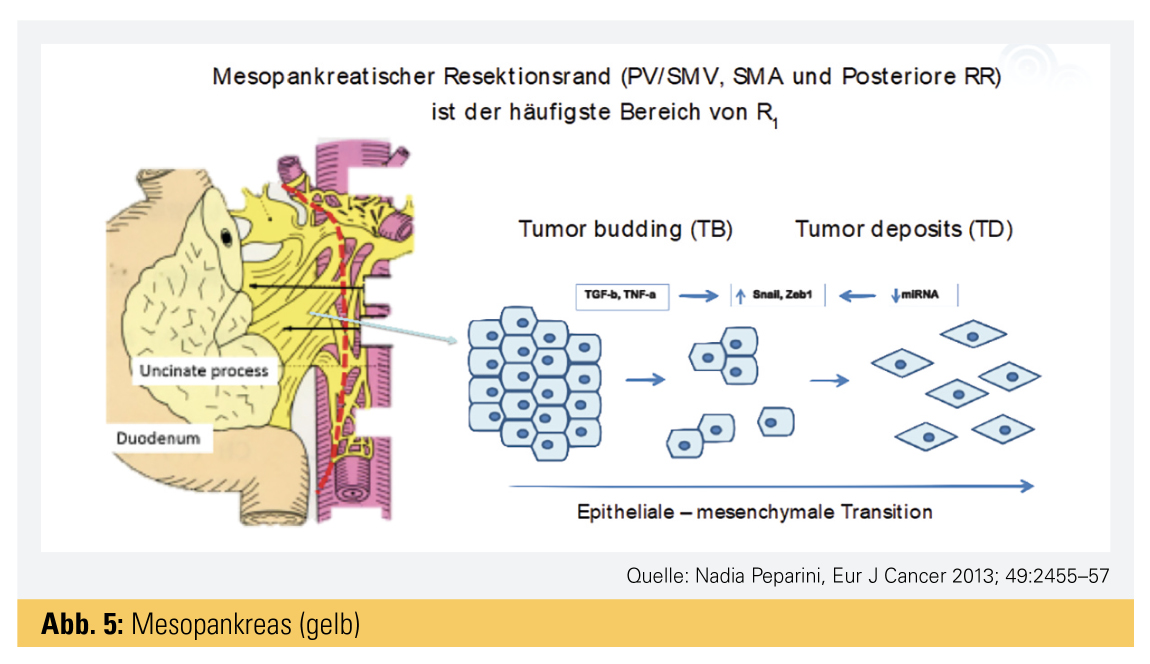
Das hauptsächliche Operationsziel ist die mikroskopisch komplette Tumorentfernung ohne Residualtumor (R0-Resektion). Dieses Behandlungsprinzip wird aber durch die spezielle Tumorbiologie des Pankreaskarzinoms erschwert, da Tumorzellen entlang der Blut- und Lymphgefäße sowie der Nervenscheiden weit in die Umgebung vorwachsen und dabei eine sogenannte epidermal mesenchymale Transition (EMT) vollziehen, die es dem Tumor erlaubt, enger mit dem umgebenden Bindegewebe in Kontakt zu kommen und sich darin zu integrieren.11 Dies macht es für die verschiedenen Behandlungskonzepte – einschließlich der Chirurgie – so schwierig, den Tumor zu erreichen bzw. komplett zu entfernen. Das Mesopankreas, die Bindegewebsregion um das Pankreas, welche dicht von Blut- und Lymphgefäßen sowie von Nerven durchzogen ist, ist eine Schlüsselstelle für die Radikalität der Resektion (Abb. 5).12 Aktuelle Studien konnten belegen, dass die Radikalität der Resektion und das Überleben mit der Entfernung des tumorbefallenen Anteils des Mesopankreas zusammenhängt.13 Insbesondere die „Gefäßgrube“ (jener Bereich des Mesopankreas entlang der mesenteriellen Gefäßachse) ist bei Primärtumoren im Pankreaskopf häufig durch Tumorzellen infiltriert; bei zu geringem Resektionsausmaß des Gewebes um und entlang dieser Blutgefäße ist der Resektionsrand (RR) dort positiv, d. h., die Tumorzellen reichen bis an den RR. Zudem hat der Abstand der Tumorzellen vom nächstgelegenen RR einen wesentlichen Einfluss auf das Überleben.14 Man unterscheidet heute „R0-narrow“ (Tumorzellen unter 1 mm zum RR) und „R0-wide“ (Tumorzellen mehr als 1 mm vom nächsten RR) im Unterschied zu „R1“-Tumorzellen bis zum RR.15
Operationstechniken im Wandel der Zeit: Diese Erkenntnisse haben die Operationstechniken in der Pankreaschirurgie über die vergangenen Jahre wesentlich beeinflusst. Immer stärker wird das Augenmerk auf die komplette Entfernung des Mesopankreas in der Umgebung der vom Tumor befallenen Abschnitte des Pankreas gelegt und die einzelnen Operationsschritte daraufhin abgestimmt. Begriffe wie „artery first“ (zuerst die Mesenterialarterie frei präparieren), „uncinate first“ (der Processus uncinatus wird zuerst präpariert) oder „anterior approach“ weisen darauf hin, dass die konkrete Planung der Präparationsschritte von der Tumorlokalisation und dessen Ausdehnung in die Umgebung bestimmt werden (Abb. 6).16, 17 Aus all den durch Studien belegten Ergebnissen wird der Tumorentfernung aus dem Mesopankreas nunmehr besondere Bedeutung beigemessen und in Anlehnung an das vom Mastdarm bekannte Operationsprinzip „TME“ in diesem Zusammenhang von Total mesopancreatic Excision gesprochen. Dies kann bei der Pankreaskopfresektion im Rahmen der pyloruserhaltenden partiellen Duodenopankreatektomie (PPPDP) umgesetzt werden wie auch bei der radikalen anterioren modularen Pankreatosplenektomie (RAMPS). Gemeint ist damit die Pankreaslinksresektion en bloc, unter Mitnahme des peripankreatischen Lymphfettgewebes bis an die linke Nierenvene und die Nebenniere.18
Rekonstruktionsmaßnahmen: Nach einer PPPDP ist die Rekonstruktion der abgesetzten Organe bzw. Abflüsse mittels Anastomosen notwendig. Wesentlich zur komplikationsfreien Heilung ist – neben einer technisch einwandfreien Anlage der Anastomosen – die Entscheidung über die Platzierung von Drains in Abhängigkeit des Risikos für eine Pankreasfistel. Dazu kann ein „fistula risk score“ berechnet werden, der die Beschaffenheit des Pankreasgewebes, die Größe des Pankreasganges, die zugrunde liegende Erkrankung und den intraoperativen Blutverlust beinhaltet.19 Bei einem niedrigem Score sind Drainagen zur Pankreasanastomose nicht förderlich, sondern erleichtern das Auftreten einer Leakage, während die Drainagen bei mittlerem und hohem Score dem Auftreten klinisch relevanter Fisteln vorbeugen.20 Neben der Pankreasfistel sind die Leakage aus der Gallengangsanastomose, eine postoperative Blutung und die verzögerte Magenentleerung als Komplikationen nach Pankreaskopfresektion zu nennen. Als wesentlichste Komplikationen nach einer Pankreaslinksresektion ist das Auftreten von Pankreasfisteln, Abszessen und Blutungen zu nennen. Es ist somit besonders wichtig, dass diese Eingriffe einerseits von geübten Chirurgen mit einer Fallzahl von mehr als 10 Operationen pro Jahr durchgeführt werden und andererseits das betreuende Team in der Erkennung und Behandlung typischer Komplikationen geschult ist.
Gegenwärtig wird ein wachsender Anteil der Resektionen entweder laparoskopisch oder mit Hilfe eines Operationsroboters durchgeführt. Während die laparoskopische Pankreaslinksresektion für verdächtige Zysten (IPMN, MCN), neuroendokrine Tumoren sowie kleine, auf die Bauchspeicheldrüse begrenzte Karzinome in vielen Zentren bereits zum operativen Standard gehört, wird die laparoskopische oder roboterchirurgische Pankreaskopfresektion bisher nur in wenigen, sehr spezialisierten Zentren durchgeführt. Sinn und Gefahren dieser Operationsmethode bei Pankreaskopfresektionen werden noch intensiv diskutiert.
Resümee
Zur rechtzeitigen Diagnose eines Pankreaskarzinoms ist es wichtig, bestimmte Warnsignale zu beachten und bei Vorhandensein dieser eine genaue Abklärung einzuleiten. Die KM-CT ist zur Diagnosestellung und Beurteilung der Resektabilität gut geeignet. Dabei wird anhand der Nahebeziehung zu den großen Blutgefäßen zwischen resektabel, borderline resektabel und lokal fortgeschritten nichtresektabel unterschieden. Die interdisziplinäre Beurteilung der Erkrankungssituation und Zusammenarbeit in der Behandlung kann das Behandlungsergebnis verbessern. Insbesondere bei Patienten mit borderline und fortgeschrittenen nichtresektablen Stadien erfolgt eine neoadjuvante Behandlung in Form von Chemotherapie und gegebenenfalls Bestrahlung. Für die Chirurgie ist die komplette Tumorentfernung durch eine R0-Resektion bei möglichst wenig Komplikationen das wesentliche Behandlungsziel. Hierfür sind die Kenntnis der Tumorbiologie dieser Erkrankung, die anatomisch topografischen Strukturen um das Pankreas sowie entsprechende Erfahrung durch eine hohe Operationsfrequenz von Wichtigkeit. Für ein professionelles Komplikationsmanagement ist ein geschultes und erfahrenes Behandlungsteam erforderlich

























































































_Astrid_Bartl_opt.jpg)

