Diabetes und Rheuma in der klinischen Praxis
Eine Kausalität zwischen Typ-1-Diabetes mellitus (T1DM) und rheumatologischen Erkrankungen konnte bislang nicht belegt oder pathophysiologisch erklärt werden, wenn auch eine jeweilige Häufung vorzuliegen scheint: Bei Menschen mit T1DM wurden bis zu siebenmal häufiger ein positiver Rheumafaktor und/oder anticitrullinierte Autoantikörper als in der nichtdiabetischen Vergleichspopulation festgestellt, wenngleich hier keine Aussage über die tatsächliche RA-(Rheumatoide-Arthritis-)Aktivität zum Untersuchungszeitpunkt getroffen wurde. Das alleinige Vorliegen von Antikörpern stellt nämlich nur einen Mosaikstein in der rheumatologischen Diagnose dar, erlaubt aber keine sichere Aussage, ob in Zukunft tatsächlich eine Erkrankung entwickelt werden wird. Bei Patient*innen mit T2DM ist eine derartige Häufung nicht zu beobachten.
Menschen mit einer diagnostizierten RA haben ein fünffach erhöhtes Risiko, an einem T1DM zu erkranken. Für die Komorbidität T2DM liegt das entsprechende Risiko bei einer 1,5-fachen Erhöhung.1
Autoimmunität und kardiovaskuläres Risikoprofil
Pathophysiologisch können bei Autoimmunprozessen ähnliche Muster beobachtet werden: Primäre lymphozytäre Infiltrate setzen sich aus aktivierten CD4- und im Weiteren CD8-positiven Zellen zusammen, zusätzlich befinden sich im entzündlichen Infiltrat autoantikörperproduzierende aktivierte B-Lymphozyten. Am Beginn der Erkrankungen stehen antigen-(AG-)präsentierende Zellen (APC) wie Makrophagen und aktivierte dentritische Zellen. APC präsentieren das spezifische AG für die jeweilige Autoimmunerkrankung den CD4-positiven T-Lymphozyten, so kommt es in weiterer Folge zur Aktivierung der B-Lymphozyten und somit zur Autoantikörperproduktion. CD8-positive T-Lymphozyten starten die Produktion von Zytokinen, so wird der Autoimmunprozess weiter verstärkt.
Proinflammatorische Zytokine wie Interleukin-1 (IL-1), Interleukin-6 (IL-6) und Tumornekrosefaktor-alpha (TNF-alpha) spielen sowohl bei T1DM, T2DM und RA eine bedeutende Rolle. Ob es letztlich zum Ausbruch einer Autoimmunerkrankung kommt, scheint vom Zusammenwirken genetischer Disposition und Umwelteinflüssen abzuhängen. CD4-positive T-Lymphozyten nehmen zu Beginn einer RA eine wesentliche Rolle ein; im Verlauf der Erkrankung führen proinflammatorische Zytokine zu einer fortschreitenden Gelenkzerstörung. IL-1, IL-6 und TNF-alpha werden in der entzündlich veränderten Synovialis nachgewiesen – und fördern die Freisetzung destruktiver Enzyme.2
Menschen mit RA oder Psoriasisarthritis (PsA) haben ein höheres Risiko für kardiovaskuläre Erkrankungen im Vergleich zur Normalbevölkerung. Erklärt wird dies so, dass für die Entstehung der RA, jedoch vermutlich auch für die Atherosklerose, proinflammatorische Zytokine wie IL-1, IL-6 und TNF-alpha verantwortlich sind. Diese führen nicht nur in der Synovia zur Freisetzung destruktiver Enzyme, sondern auch im Lymphsystem und im Fettgewebe. Dies kann zur systemischen Freisetzung von Zytokinen führen und periphere Gewebe, wie z. B. die Skelettmuskulatur und das Gefäßendothel, tangieren. In weiterer Folge kommt es zu vaskulärer Dysfunktion und auch Erhöhung der Insulinresistenz.3 Noch höher soll das Risiko für metabolische Erkrankungen, Insulinresistenz und Diabetes mellitus für Patient*innen mit PsA sein. Studiendaten von Radner et al. zufolge würde in einer Subgruppe die Therapiekombination von csDMARDs und TNF-Blocker eine erhöhte Inzidenz von arterieller Hypertonie und T2DM beobachtet, was wiederum auf die schwerer zu kontrollierende Inflammation zurückzuführen sei.4 Eine konsequente Primärprophylaxe hinsichtlich der kardiovaskulären Risikofaktoren wird bei Patient*innen mit RA und PsA empfohlen. Ein besonderes Augenmerk gilt für jene, die bereits länger als 10 Jahre an einer RA leiden, eine RF/CCP-Positivität oder extraartikuläre Manifestationen aufweisen.5 Bei Frauen scheint eine bestehende RA einer der Hauptrisikofaktoren für die Entwicklung einer kardiovaskulären Erkrankung zu sein. Das weibliche Geschlecht scheint auch ein höherer Risikofaktor für T2DM bei PsA zu sein. Dreiher et al. vermuten, dass aufgrund der Eigenschaften der weiblichen Sexualhormone, z. B. die höhere Insulinresistenz während der Lutealphase der Menstruation und in der Schwangerschaft, die Einnahme von Kontrazeptiva oder Östrogenmangel nach der Menopause ursächlich für diesen Unterschied sind. Eine gesteigerte Insulinresistenz findet sich auch bei Frauen mit polycystischem Ovarsyndrom. Frauen mit metabolischem Syndrom haben höhere Spiegel von IL-1 oder hochsensitivem CRP (hsCRP) im Vergleich zu Männern mit metabolischem Syndrom.6
Glukokortikoide und DMARDs bei rheumatologischen Erkrankungen
Glukokortikoide (GC) stellen nach wie vor eine wichtige, effiziente Therapieoption dar, vor allem in der Anfangsphase vieler rheumatologischer Erkrankungen, teilweise sind GC ein fixer Bestandteil von Dauertherapien, jedoch zumindest für eine rasche Krankheitskontrolle alternativlos. Besteht ein T1DM oder T2DM als Komorbidität, sollte der Einsatz von GC auf das unbedingt notwendige Maß reduziert werden, z. B. wird bei monoarthritischem Befall eine intraartikuläre Injektion gegenüber einer systemischen Therapie bevorzugt. Eine längerfristige Nutzung von GC in einer Dosis über der Cushing-Schwelle führt zur Erhöhung der Insulinresistenz und damit verbunden zu einer Verschlechterung der Stoffwechsellage – unabhängig vom bereits bestehenden höheren CV-Risiko.7
Zugelassene „disease-modifying antirheumatic drugs“ (DMARDs) sollen mittel- bis längerfristig zu einer glukokortikoidfreien Remission führen. In klinischen Studien konnte unter den Vertretern verschiedener Gruppen (csDMARDs, bMARDs, tsDMARDs) eine Stoffwechselneutralität beschrieben werden. Eine Ausnahme scheint hier die Substanz Hydroxychloroquin zu sein, unter der bei T2DM eine Verbesserung der Blutzuckerkontrolle und des HbA1c, bedingt durch Verbesserung der Insulinsensitivität und verminderte Inzidenz, erreicht werden kann.8 Ein vermuteter positiver Stoffwechseleffekt von Methotrexat (csDMARD) über die Besserung der entzündlichen Aktivität konnte in einer Studie mit T1DM ohne rheumatologische Komorbidität nicht belegt werden.9
Der Einsatz des bDMARD Abatacept bei frühdiagnostiziertem T1DM konnte in einer doppelblind randomisierten Phase-II-Studie eine Verzögerung des Verlaufs (langsamere Abnahme des stimulierbaren C-Peptides) um 6–9 Monate sowie insgesamt eine bessere Stoffwechsellage im Vergleich zu Placebo zeigen.10 Der Interleukin-1-Rezeptorantagonist Anakinra zeigte bei adipösen Patient*innen mit länger bestehendem T1DM eine Verbesserung der Insulinsensitivität.11 Eine Interleukin-6-Blockade durch Tocilizumab führt bei RA zu einer Remission der Grunderkrankung, Schultz et al. zeigten einen Benefit für die Stoffwechselkontrolle. Die Hypothese der Besserung der Insulinresistenz des Fettgewebes wurde mit Hilfe des HOMA-Index (Methode zur Berechnung der Insulinsensitivität und Beta-Zellfunktion) gestützt, dürfte aber IL-6-spezifisch sein, da vergleichbare Effekte unter einer guten Krankheitskontrolle und CRP-Reduktion unter TNF-alpha-Blockern nicht beobachtet werden.12
Für Patient*innen mit Arthrosen kann die Substanz Diacerein eingesetzt werden, in Österreich ist das Präparat Verboril® bekannt. Antiinflammatorische Effekte, mediiert durch eine Interleukin-1-Hemmung, führen zur Verbesserung des nozizeptiven, neuropathischen und inflammatorischen Schmerzes.13 Zhang et al. beschreiben in ihrem Review den positiven Effekt auf Nüchternblutzucker und HbA1c-Senkung, basierend auf der Verbesserung der Insulinresistenz durch Reduktion von IL-6, TNF-alpha und IL-1. Limitiert ist der Einsatz dieser Substanz durch die gastrointestinalen Nebenwirkungen.14
Gelenkerkrankungen bei der Komorbidität T1DM/T2DM
Diabetische Cheiroarthropathie (DCA): Eine diabetesspezifische Gelenkerkrankung ohne autoinflammatorischen Hintergrund stellt die Cheiroarthropathie dar. Die Patient*innen bemerken eine eingeschränkte Beweglichkeit aller Gelenke im Bereich der Hände durch Verjüngung/Verengung der Haut und Sehnen, benannt wird das Bild der DCA auch als „diabetische Sklerose oder Pseudosklerodermatose“. Die Erstmanifestationen sind oft die Metacarpophalangealgelenke, gefolgt von den proximalen Interphalangealgelenken. Hier zeigt sich eine schmerzlose Einschränkung der Extension dieser Gelenke, in weiterer Folge kommt es zur Einschränkung einer völligen Extension oder Flexion aller Finger, dies kann nun auch mit Schmerzen und Steifheit assoziiert sein. Die Haut imponiert im Vollbild wächsern. Man kann davon ausgehen, dass diese Manifestation mit einer systemisch mikrovaskulären Beteiligung einhergeht. Im klinischen Status wird die Erscheinung auch als „Prayer-Hand“ oder „Table top sign“ beschrieben – was bedeutet, die palmaren Handflächen können weder aneinandergelegt noch satt auf einen Tisch aufgelegt werden. Differenzialdiagnostisch sollte eine Dupuytren’sche Kontraktur ausgeschlossen werden, diese bezieht sich jedoch meist auf den 4. und 5. Finger.
Ätiologisch geht man davon aus, dass es zu einer vermehrten Einlagerung eines glykosylierten Kollagens in Haut, subkutanes Fettgewebe, Sehnen, Muskeln und periartikuläres Gewebe kommt. Darüber hinaus kommt es bei der diabetischen Mikroangiopathie zur Verdickung der kapillären Basalmembran und in der Folge zu einer Ischämie des Gewebes, was zur Hautfibrose führt. Es scheint ein dreifach höheres Risiko für mikrovaskuläre Komplikationen zu geben, sobald die Patient*innen eine DCA aufweisen.
Die Behandlung der DCA ist in erster Linie in einer Verbesserung der glykämen Kontrolle adressiert, zusätzlich werden NSAR verabreicht und Physio- sowie Ergotherapie empfohlen, eine komplette Reversibilität ist nur in früheren Stadien möglich.15
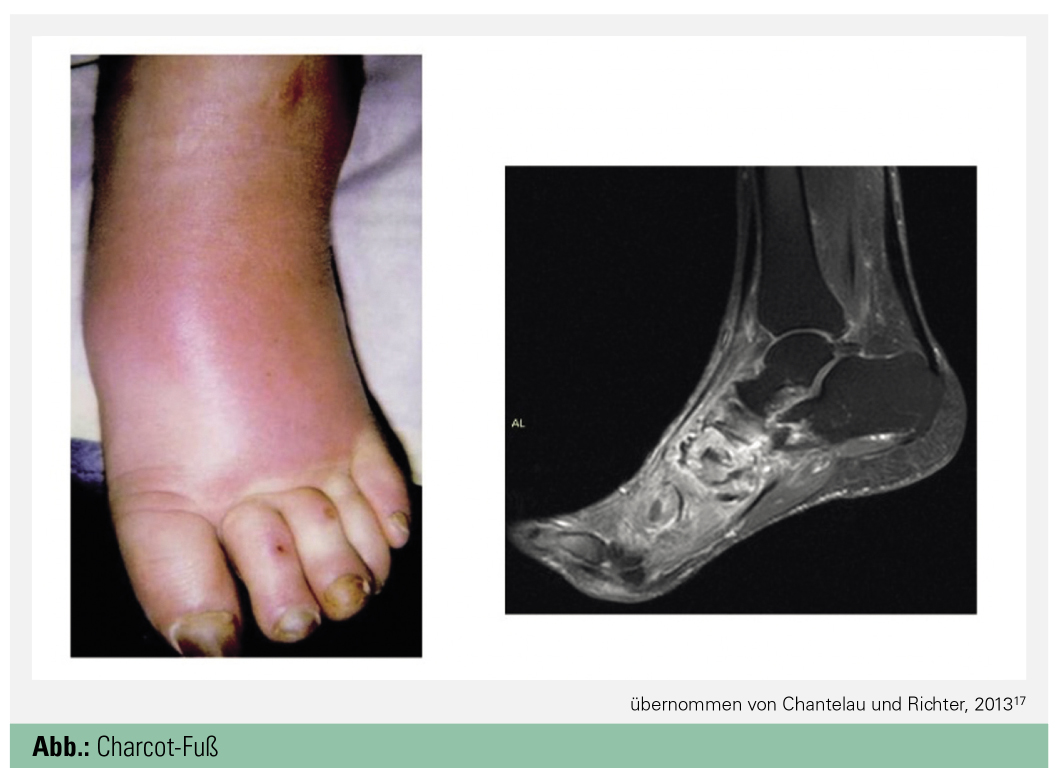
Charcot-Fuß: Die Diagnose des Charcot-Fußes ist primär eine klinische und in fortgeschrittenem Stadium auch eine radiologische; als Risiko gelten T1DM, T2DM, periphere Neuropathie und Adipositas, Komplikationen im fortgeschrittenen Stadium sind Ulzera, Osteomyelitis, lokale Entzündungen oder Erysipele, Luxationen im Gelenk und Frakturen (Abb.). Klinisch präsentieren sich Patient*innen afebril mit normalen Vitalparametern und einseitigen Ödemen, oft lassen sich eine Temperaturdifferenz sowie eine Hautrötung feststellen. Infektionsparameter wie Leukozyten CRP oder Blutsenkung sind meist im Normbereich.
In der Magnetresonanztomografie zeigen sich ein periartikuläres Knochenmarködem, ein angrenzendes Weichteilödem ein Gelenkerguss sowie mikrotrabekuläre Stressfrakturen.
Therapeutisch wird in erster Linie die Ruhigstellung, zumindest bis zur Resorption des Ödems an der unteren Extremität, empfohlen, weiterführend sollte der*die Patient*in einen Entlastungsschuh tragen. Ebenso ist ein Hautschutz notwendig, im Extremfall kann es auch Indikationen zu chirurgischen Eingriffen geben. Medikamentös können Bisphosphonate eingesetzt werden. Interessant ist eine randomisiert kontrollierte Einzelstudie, wo der Einsatz von 200IE intranasalem Calcitonin mit ergänzender Kalziumeinnahme untersucht wurde. Hier zeigte sich nach 3 und 6 Monaten eine Verringerung der Knochenumsatzparameter, was als Wirksamkeit der Behandlung interpretiert wurde, eine klinische Verbesserung konnte mit dieser Behandlungsmethode noch nicht berichtet werden.16
„frozen shoulder“, Synonym: adhäsive Kapsulitis, findet sich vermehrt bei Patient*innen mit T1DM, T2DM (Inzidenz 10,8 bis 30 %) oder Schilddrüsenerkrankungen. Patient*innen mit höherem HbA1c haben eine deutlich höhere Prävalenz zur Entwicklung einer „frozen shoulder“.Pathogenetisch scheint es zur Aktivierung von Entzündungsmediatoren zu kommen, die zu globaler Fibroplasie führen, wodurch die entzündlichen Veränderungen der Gelenkkapsel ausgelöst werden. Die nicht enzymatische Glykosylierung kann zu schmerzhaften Tendinopathien unterschiedlicher Lokalisationen (Achillessehne, lateraler Epikondylus) führen.
Therapeutisch können eine Vielzahl konservativer Maßnahmen, z. B. NSAR, systemische Steroide, Steroidinfiltrationen, Physiotherapie, Stoßwellentherapie, Akupunktur, Calcitonin und Nervenblockade, versucht werden, bevor die Patient*innen orthopädisch zur chirurgischen Sanierung vorgestellt werden. Prognostisch haben Patient*innen mit T1DM oder T2DM im Vergleich zu Nichtdiabetiker*innen schlechtere Heilungschancen.18, 19
Diabetischer Muskelinfarkt ist eine mikrovaskuläre Komplikation bei T1DM oder T2DM mit schlechter glykämischer Kontrolle. Die Symptomatik umfasst Schwellungen und Schmerzen, lokalisiert in der unteren Extremität. Die Dauer der Beschwerden kann über Wochen bestehen, anschließend werden spontane Regressionen der Beschwerden beobachtet. Laborchemisch zeigt sich meist erhöhte HbA1c, CRP, Blutsenkung und CK. Differenzialdiagnosen sind eine Pyomyositis, spontane gangränöse Myositis, clostridiale Myonekrose, nekrotisierende Fasziitis und venöse Thrombosen. In der Magnetresonanztomografie findet sich ein Korrelat zur klinischen Symptomatik. Ein konsequentes Regime zur Einstellung der Insulintherapie ist ein wichtiger Bestandteil der Therapie – ebenso wie ein Low-Dose-Acetylsalicylsäuretherapie, Ruhigstellung und Schmerztherapie. Chirurgische Interventionen sind zu vermeiden, da die Rekonvaleszenz bis zu 13 Wochen dauern kann.7, 20
Hyperurikämie: Eine häufige, metabolisch bedingte Komorbidität, vor allem bei Patient*innen mit T2DM, stellt die Hyperurikämie dar. Diese kann zu Gichtanfällen führen, klassisch ist hier die Podagra, Manifestationen können aber auch in anderen Gelenken beobachtet werden. Klinisch stellt sich das Bild einer entzündlichen Monoarthritis dar. Der urikosurische Effekt von SGLT-2-Inhibitoren im Rahmen einer antidiabetischen Therapie trägt zur Senkung der Harnsäure bei.21 Die im April 2020 zugelassene Substanz Bempedoinsäure senkt bei voller Statinwirkung zusätzlich LDL-C, Non-High-Density-Lipoprotein-Cholesterin (Non-HDL-C) und Apolipoprotein B (Apo B) sowie Gesamtcholesterin. Als unerwünschte Nebenwirkung von Bempedoinsäure wird eine Erhöhung der Harnsäurespiegel im Serum aufgrund einer Hemmung des renal-tubulären OAT2 beschrieben, weiters kann es zur Verschlimmerung einer Hyperurikämie oder bereits bestehender Gicht kommen, in diesem Fall sollte die Therapie beendet werden.22
Aussicht
Ziel sollte sein, jene Patient*innen frühzeitig zu identifizieren, die gefährdet sind, im Rahmen einer Autoimmunerkrankung auch T1DM/T2DM oder andere Autoimmunerkrankungen zu entwickeln. Eine Grazer Forschungsgruppe unter der Leitung von Thomas Pieber stellt nun in Aussicht, dieses Ziel zu erreichen. Die Gruppe arbeitet an einem gemeinsamen Forschungsprojekt der US-amerikanischen Förderorganisation zur Diabetesforschung mit der Lupus Research Alliance und der National Multiple Sclerosis Society mit. Ziel dieses Projekts ist es, die gemeinsamen Wegstrecken der Entstehung von Erkrankungen aus dem autoimmunologischen Formenkreis (T1DM, Multiple Sklerose [MS], systemischer Lupus erythematodes [SLE], rheumatoide Arthritis) besser zu verstehen. Es sollen die aktuellen Ansätze maschinellen Lernens auf unterschiedliche klinische und metabolische Daten von Patient*innen mit T1DM, SLE, MS, RA sowie von gesunden Freiwilligen angewandt werden. Damit sollen Muster aus sehr großen Datensätzen identifiziert werden, gemeinsame oder unterschiedliche Eigenschaften von Immunzellen und assoziierter Immunwege erkannt werden. Durch das Prinzip des maschinellen Lernens sollen Forscherbias und das Risiko, wichtige Informationen der untersuchten Daten zu übersehen, stark reduziert werden.
- Jiang P et al., Clin Exp Rheumatol 2015; 33:115–121
- Graf S, Schumm-Draeger PM, Z Rheumatol 2011; 70:747–751
- Ferguson LD et al., Nat Rev Rheumatol 2019; 15:461–474
- Radner H et al., Arthritis Care Res 2017; 69:1510–1518
- Charles-Schoeman C, Curr Rheumatol Rep 2012; 14:455–462
- Dreiher J et al., Dermatol Res Pract 2013; 2013:580404
- Hua C et al., RMD Open 2020; 6
- Cansu DU, Korkmaz C et al., Rheumatology 2008; 47:378–379
- Buckingham BA, Sandborg CI, Clin Immunol 2000; 96:86–90
- Orban T et al., Lancet 2011; 378:412–419
- van Asseldonk EJP et al., Clin Immunol 2015; 160:155–162
- Schultz O et al., PLoS One 2010; 5:e14328
- Almezgagi M et al., Biomed Pharmacother 2020; 131:110594
- Zhang Q et al., Am J Clin Exp Immunol 2017; 6:97–106
- Cherqaoui R et al., Case Rep Endocrinol 2013; 2013:257028
- Marmolejo VS et al., Am Fam Physician 2018; 97:594–599
- Chantelau EA, Richter A, Swiss Med Wkly 2013; 143:w13831
- Strahl A et al., Z Rheumatol 2018; 77:113–126
- Pandey V, Madi S, Indian J Orthop 2021; 55:299–309
- Horton WB et al., J Miss State Med Assoc 2016; 57:39–42
- Zhao Y et al., Diabetes Obes Metab 2018; 20:458–462
- Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt 2019 [cited 2021 May 30]. Available