DOAK bei tumorassoziierten venösen Thromboembolien
Im Rahmen der Fortbildungsveranstaltung „Blutiger Donnerstag“ im Jänner 2018 stellte Univ.-Prof. Dr. Ingrid Pabinger-Fasching, Abteilung für Hämatologie und Hämostaseologie, AKH Wien, das Potenzial direkter oraler Antikoagulanzien (DOAK) in der Prävention und Behandlung tumorassoziierter venöser Thromboembolien (VTE) vor.
DOAK kommen bereits sehr breit bei Nichttumorpatienten in der Behandlung von tiefen Beinvenenthrombosen und in der Prophylaxe von Schlaganfällen bei Patienten mit Vorhofflimmern zum Einsatz. Im Gegensatz zu den bei Tumorpatienten bereits eingesetzten niedermolekularen Heparinen (NMH), die subkutan verabreicht werden müssen, und Vitamin-K-Antagonisten (VKA), die zum einen ein häufiges Monitoring erfordern und zum anderen langsam an- und abfluten, eignen sich DOAK bei Tumorpatienten besonders. Gründe hierfür liegen in der oralen Darreichungsform, dem raschen An- und Abfluten und einem nicht nötigen Monitoring.
State-of-the-Art-Behandlung
Eine VTE stellt eine häufige Komplikation bei Tumorpatienten und in der Krebstherapie dar.1, 2 Sie gilt bei chirurgisch oder medikamentös behandelten Tumorpatienten als zweithäufigste Todesursache.3 Die Risiken für wiederkehrende Thrombosen sowie für Blutungen sind bei Tumorpatienten höher als bei Nichttumorpatienten.4 Diese beiden Komplikationen spielen eine wichtige Rolle, da sie sowohl zur Mortalität als auch zur Morbidität beitragen, mit der Tumorbehandlung interferieren können sowie das Risiko einer Hospitalisierung erhöhen.
Bisherige Studien, die Tumorpatienten mit einer VTE einschlossen, zeigten, dass die Rate der rezidivierenden Thrombosen bei einem 6-monatigen Behandlungszyklus mit NMH im Vergleich zu VKA niedriger war. Das Blutungsrisiko war hingegen bei den beiden Behandlungsmethoden ähnlich.5, 6 Leitlinien empfehlen aus diesem Grund die Behandlung mittels niedermolekularen Heparins7–9, über den Nutzen dieser Behandlung jenseits der ersten sechs Monate ist bisher allerdings wenig bekannt. Die Therapie ist für die Patienten beschwerlich, da täglich eine subkutane Injektion nötig ist und diese wiederum den Einsatz der Behandlung limitiert.10, 11
DOAK bei Tumorpatienten
In klinischen Phase-III-Studien konnte für die DOAK Dabigatran12, Rivaroxaban13, 14, Apixaban15 und Edoxaban16 bei der Behandlung von tiefer Beinvenenthrombose und Lungenembolie der Nachweis einer Nichtunterlegenheit gegenüber der Standardbehandlung mit dem VKA Warfarin erbracht werden. Bei Patienten mit Krebserkrankung, die auch in die Phase-III-Zulassungsstudien eingeschlossen waren, waren DOAK bei der Behandlung von VTE ebenso wirksam wie VKA und zudem mit weniger häufigen und weniger schweren Blutungen assoziiert.17–19 Allerdings muss an dieser Stelle darauf hingewiesen werden, dass der Anteil an Tumorpatienten in diesen Studien nur rund 4–9 % der Gesamtpatientenpopulation betrug und wahrscheinlich die breite Palette von Patienten mit aktiver Tumorerkrankung in den Studien nicht repräsentativ vertreten war.
Belegte Wirksamkeit und Sicherheit: Die 2016 publizierte Leitlinie20 zum Einsatz von DOAK in der Behandlung und Prophylaxe bei Tumorpatienten weist zwar darauf hin, dass sie den VKA nicht unterlegen sind, unmittelbare Daten zur Wirksamkeit und Sicherheit von DOAK bei Krebs fehlten zu diesem Zeitpunkt allerdings noch. Rezent wurden nun relevante Daten21, 22 über die Wirksamkeit und Sicherheit von DOAK im Vergleich zu Langzeit-NMH bei der Behandlung tumorassoziierter VTE publiziert:
Hokusai VTE Cancer
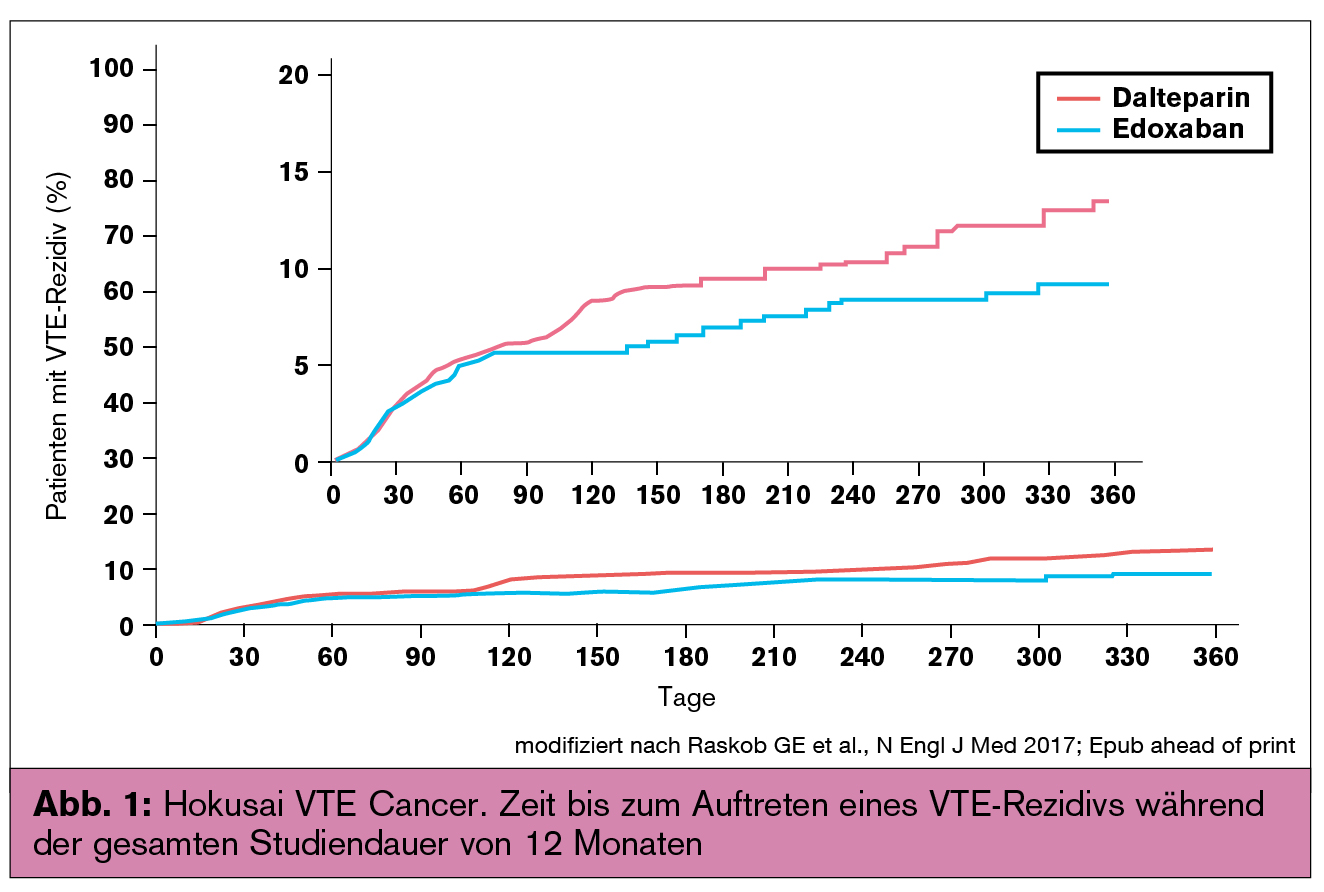
In der randomisierten Open-Label-Studie Hokusai VTE Cancer21 wurde Edoxaban mit Dalteparin zur Behandlung von Patienten mit tumorassoziierter VTE verglichen. Die beiden Therapieregime wurden für mindestens sechs bis maximal zwölf Monate gegenübergestellt, um eine Anleitung für die Behandlungsplanung auch nach sechs Monaten bereitzustellen. Als kombinierter primärer Studienendpunkt wurde das Auftreten eines VTE-Rezidivs oder schwerer Blutungen gewählt. Die Rationale für den kombinierten primären Studienendpunkt ist gemäß den Studienautoren: 1) Tumorpatienten haben sowohl ein erhöhtes Risiko eines VTE-Rezidivs als auch für antikoagulationsbedingte Blutungen; 2) die VTE-Therapie mittels Antikoagulanzien soll das Wiederauftreten der VTE mit einem minimalen Risiko für schwere Blutungen verhindern, da diese unerwünschten Ereignisse während oder nach der Behandlung oft korrelieren. Die Studienhypothese lautete, dass Edoxaban hinsichtlich des kombinierten primären Studienendpunkts einer Behandlung mit Dalteparin nicht unterlegen sein wird. Nichtunterlegenheit wurde definiert mit einer Obergrenze des 95%-Konfidenzintervalls für eine HR von < 1,5 und einem zweiseitigen Signifikanzniveau von α = 0,05.
Zu den Einschlusskriterien der Studie zählten unter anderem Tumorpatienten mit akuter symptomatischer VTE oder VTE als Zufallsbefund, eine „aktive“ Krebserkrankung (definiert entweder als Diagnose innerhalb der letzten sechs Monate oder rezidivierend/lokal fortgeschritten/metastasiert) sowie Diagnose innerhalb von zwei Jahren vor der Randomisierung. Patienten mit Basalzell- oder Plattenepithelkarzinom der Haut, aktiven Blutungen, einer Lebenserwartung von weniger als drei Monaten oder einer Kreatinin-Clearance < 30 ml/min waren von der Studie ausgeschlossen. Insgesamt wurden 1.050 Patienten 1 : 1 randomisiert, das mittlere Alter lag in beiden Gruppen bei 64 Jahren. Patienten im Edoxaban-Arm (n = 522) erhielten vor Einleitung der oralen Substanz eine mindestens fünftägige subkutane Therapie mit NMH. In der Dalteparin-Gruppe (n = 524) wurde die Anfangsdosis von 200 IU/kg pro Tag nach 30 Tagen auf 150 IU/kg pro Tag reduziert.
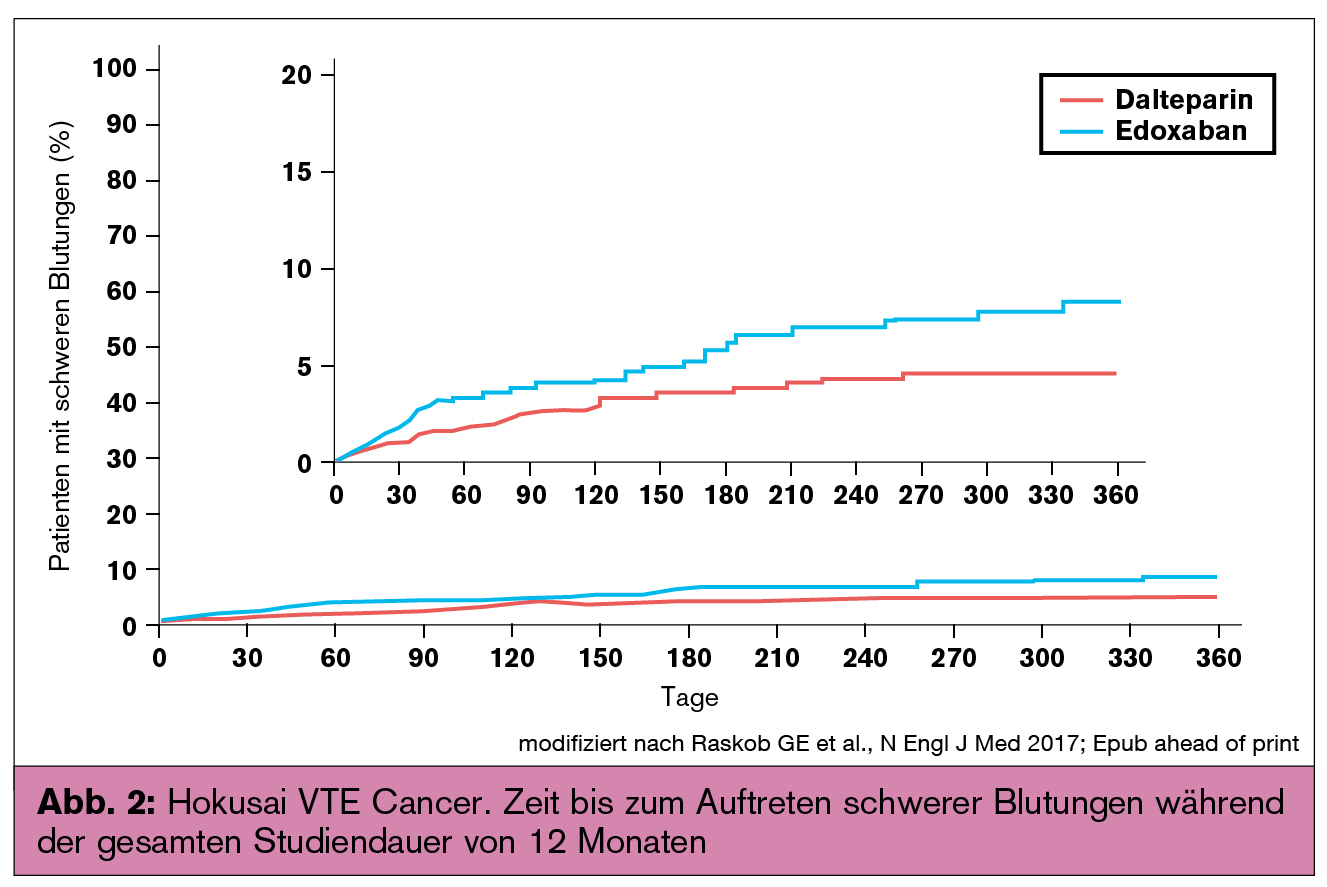
Der primäre Outcome eines VTE-Rezidivs oder einer schweren Blutung trat bei 12,8 % der Edoxaban-Gruppe und bei 13,5 % der Dalteparin-Gruppe auf (HR: 0,97; 95%-KI: 0,70–1,36; p = 0,006 für Nichtunterlegenheit). Im Folgenden wird kurz auf die sekundären Studienendpunkte verwiesen: 7,9 % der Patienten der Edoxaban-Gruppe und 11,3 % der Dalteparin-Gruppe hatten ein VTE-Rezidiv (p = 0,09). Die Zeit bis zum Auftreten eines Rezidivs ist in Abbildung 1 dargestellt. Schwere Blutungen traten bei 6,9 % der Patienten unter Edoxaban und bei 4,0 % unter Dalteparin auf (p = 0,04). Die Zeit bis zum Auftreten schwerer Blutungen ist in Abbildung 2 dargestellt.
Pilotstudie SELECT-D
In der investigatorinitiierten prospektiv randomisierten Pilotstudie SELECT-D22 wurden 406 Tumorpatienten mit VTE 1 : 1 zu Rivaroxaban (15 mg zweimal täglich für 3 Wochen, dann 20 mg einmal täglich für insgesamt 6 Monate) oder Dalteparin (200 IU/kg täglich im 1. Monat, 150 IU/kg in den Monaten 2–6) randomisiert. Diese Studie ist bisher noch nicht als Vollpublikation erschienen. Im untersuchten Patientenkollektiv (medianes Alter: 67 Jahre) wiesen 38 % der Patienten entweder eine frühe oder lokal fortgeschrittene Erkrankung auf, 59 % eine Metastasierung und 3 % hämatologische Malignome. Jede Gruppe wurde sechs Monate lang mit Dalteparin beziehungsweise Rivaroxaban behandelt. Als primärer Outcome wurde ein VTE-Rezidiv definiert. Nach dem Studienzeitraum lag die VTE-Rezidivrate unter Dalteparin bei 11 %, unter Rivaroxaban bei 4 %. Zu den sekundären Outcomes zählten unter anderem schwere Blutungen sowie klinisch relevante nichtschwerwiegende Blutungsereignisse. Das Auftreten Ersterer war in den beiden Armen ähnlich (Dalteparin-Arm: 3 %, Rivaroxaban-Arm: 4 %), während sich Letztere öfter im Rivaroxaban-Arm zeigten (Dalteparin-Arm: 2 %, Rivaroxaban-Arm: 13 %).
Resümee
Beide Studien, Hokusai VTE Cancer und SELECT-D, weisen in dieselbe Richtung: DOAK zeigen eine zumindest gleich gute Effektivität (Wahrscheinlichkeit des Auftretens eines Rezidivs) bei der Behandlung tumorassoziierter VTE. Im Vergleich zur Standardtherapie treten bei DOAK etwas mehr Blutungen, vor allem aus dem Gastrointestinaltrakt, auf. Weitere Studien, die sich mit der Behandlung tumorassoziierter VTE beschäftigen, laufen.
FACT-BOX
Aus Österreich wurden 28 Patienten in die Hokusai-VTE-Cancer-Studie eingeschlossen. Die vier teilnehmenden Zentren waren Wien (I. Pabinger-Fasching), Graz (M. Brodmann), Feldkirch (R. Mathies) und Steyr (D. Rossmann).
Kommentar: Univ.Prof. Dr. Ingrid Pabinger-Fasching
Meiner Meinung nach könnten Patienten mit tumorassoziierter Thrombose bereits mit DOAK behandelt werden. Die besten Daten gibt es zweifellos zu Edoxaban. Verwendet man DOAK bei tumorassoziierter VTE, sollten im Wesentlichen, natürlich unter Einbeziehung von Kreatinin, Alter usw., dieselbe Dosis und dieselben Behandlungsmodi eingesetzt werden wie bei Nichttumorpatienten; das erhöhte Risiko einer gastrointestinalen Blutung ist aber in Betracht zu ziehen. Die klinische Relevanz der Interaktion von DOAK mit Antitumormedikamenten bedarf noch umfassender Untersuchungen, allerdings ist diese mit Edoxaban im Vergleich zu anderen DOAK am niedrigsten.