Geriatrische Aspekte zum Management des Typ-2-Diabetes
Im Rahmen der Aktualisierung der Leitlinienempfehlungen der Österreichischen Diabetesgesellschaft (ÖDG) erfolgte auch eine Überarbeitung des Kapitels über geriatrische Aspekte bei Diabetes mellitus.1 Inhalte nehmen dabei Bezug auf rezente Entwicklungen in der Therapie des Typ-2-Diabetes, auf aktuelle Studienergebnisse und internationale Leitlinienempfehlungen, wie jene der American Diabetes Association (ADA).2
Leitlinien für ältere Menschen mit Diabetes mellitus sind von großer Bedeutung im Hinblick auf die hohe Prävalenz des Diabetes mellitus im fortgeschrittenen Lebensalter, die bei Über-70-Jährigen rund 25 % beträgt.3, 4
Geriatrie-Kontext
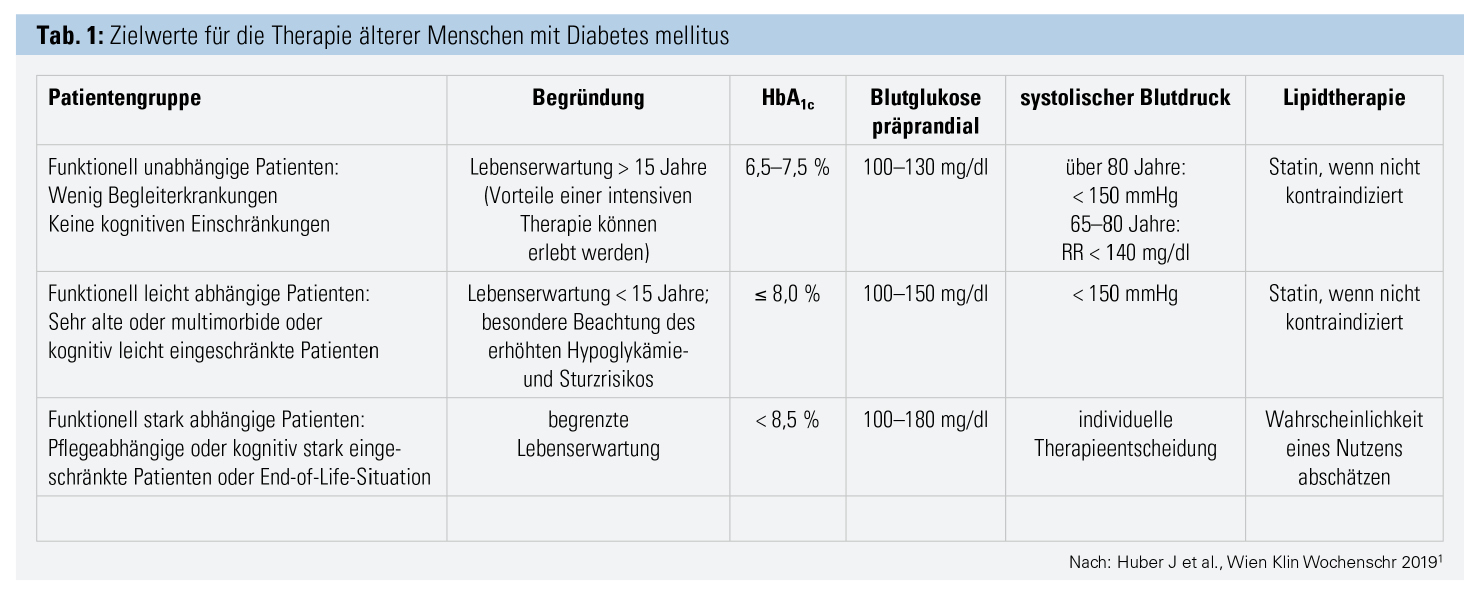
In der Betreuung geriatrischer Patienten mit Diabetes mellitus ist es grundsätzlich wichtig, die individuelle Situation des Patienten zu beachten. Komorbiditäten und dem Risiko einer Polypharmazie – wie auch möglichen funktionellen und kognitiven Einschränkungen – kommen hinsichtlich der Definition der Therapieziele und der Therapiewahl eine wichtige Bedeutung zu (Tab. 1).5–7
Entsprechend der Definition der ÖGGG ist ein geriatrischer Patient ein biologisch älterer Patient (kalendarisch meist > 80 Jahre), der mehrere relevante und behandlungsbedürftige Diagnosen (Multimorbidität) aufweist, einen besonderen Handlungsbedarf in rehabilitativer, sozialer und psychosozialer Hinsicht erfordert sowie durch akute Erkrankungen vom Verlust der Selbstständigkeit bedroht ist. Sogenannte geriatrische Syndrome mit multikausaler Entwicklung sind für die Gesamtprognose und damit auch für die Definition der Behandlungsziele wichtig.
Zu den maßgeblichen geriatrischen Syndromen zählen die Immobilität und Instabilität (erhöhtes Sturzrisiko), intellektueller Abbau, Inkontinenz, Inappetenz, Isolation und iatrogene Schädigungen.
Eine besondere Vulnerabilität besteht bei geriatrischen Patienten hinsichtlich des Hypoglykämierisikos: Altersassoziierte Veränderungen des autonomen Nervensystems können zu einer Abschwächung gegenregulatorischer Mechanismen und damit zu einer atypischen klinischen Symptomatik von Hypoglykämien führen. Das Risiko für schwerwiegende Komplikationen von Hypoglykämien, wie kardiovaskuläre Ereignisse oder Stürze, ist bei älteren Patienten erhöht.
Zum erhöhten Hypoglykämierisiko geriatrischer Patienten trägt auch die häufige Fehl- und Mangelernährung bei. Das Vorliegen einer Malnutrition ist mit der Entwicklung eines gesteigerten Muskelabbaus im Rahmen einer Sarkopenie und mit Frailty assoziiert.
Das geriatrische Frailty-Syndrom beschreibt einen Zustand verminderter körperlicher Leistungsfähigkeit und erhöhter Vulnerabilität gegenüber Stressoren und bezieht physische, psychische und soziale Bereiche mit ein („ein dynamischer, veränderlicher Zustand erhöhter Vulnerabilität gegenüber äußeren Stressoren und Reduktion der körperlichen Leistungsfähigkeit“).8, 9
Die Diagnose von Frailty erfolgt in der klinischen Praxis häufig anhand der von Fried 2001 definierten Kriterien (unbeabsichtigter Gewichtsverlust, Muskelschwäche, verminderte Gehgeschwindigkeit, reduzierte Aktivität, Erschöpfung).8 Frailty korreliert mit einem deutlich erhöhten Risiko für Multimorbidität, Krankheitskomplikationen, Delir, perioperativen Risiken, einer erhöhten Pflegebedürftigkeit und Institutionalisierungsrate sowie einer gesteigerten Mortalität.10 Ein Screening auf das Vorliegen von Frailty ist deshalb zur Beurteilung der Notwendigkeit von Unterstützung und Versorgungsstrukturen bei älteren Menschen von grundlegender Bedeutung, vor allem aber auch in Bezug auf die Behandlungskonzepte und Betreuung diabetischer Patienten.
Screening und Diagnostik des Diabetes mellitus
Die diagnostischen Kriterien für einen Diabetes mellitus bei älteren Menschen entsprechen den allgemein gültigen und damit altersunabhängigen Definitionen.1, 2 Der Anstieg der Prävalenz des Diabetes mellitus im höheren Lebensalter wird auf eine altersassoziierte Zunahme der Insulinresistenz, aber auch eine Beeinträchtigung der Insulinsekretion zurückgeführt.11 Eine ausschließliche Bestimmung der Nüchternblutzuckerwerte ist deshalb für den diagnostischen Ausschluss eines Diabetes mellitus bei älteren Menschen nicht ausreichend. Ein HbA1c-Wert von 5,7–6,4 % korreliert mit einem erhöhten Diabetesrisiko, bei einem HbA1c-Wert über 6,5 % liegt ein manifester Diabetes mellitus vor. Die klinischen Symptome einer Hyperglykämie, wie vermehrter Durst, Gewichtsreduktion, Sehstörungen und allgemeine Schwäche, können bei älteren Patienten aufgrund der Multimorbidität und Medikation fehlinterpretiert werden und so zu einer Verzögerung der Diagnose führen.
Ernährungsempfehlungen bei Diabetes mellitus
Aktuelle Leitlinienempfehlungen betonen auch hinsichtlich der Ernährungsempfehlungen die Notwendigkeit eine Bezugnahme auf die individuelle Situation des Patienten.2 Strikte Diätformen sind bei geriatrischen Patienten aufgrund des erhöhten Risikos für die Entwicklung einer Malnutrition kontraindiziert.
Als vorrangig gilt bei geriatrischen Patienten eine adäquate Deckung des Energiebedarfs (30 kcal/kg Körpergewicht/Tag) sowie zur Prävention bzw. Therapie einer Sarkopenie eine ausreichende Proteinzufuhr, die bei Fehlen einer höhergradigen Niereninsuffizienz 1,0–1,5 g Protein/kg Körpergewicht pro Tag betragen sollte.1 Insbesondere bei einer längerfristigen Therapie mit Metformin muss das erhöhte Risiko für einen Vitamin-B12-Mangel Berücksichtigung finden.
Medikamentöse Therapie des Typ-2-Diabetes
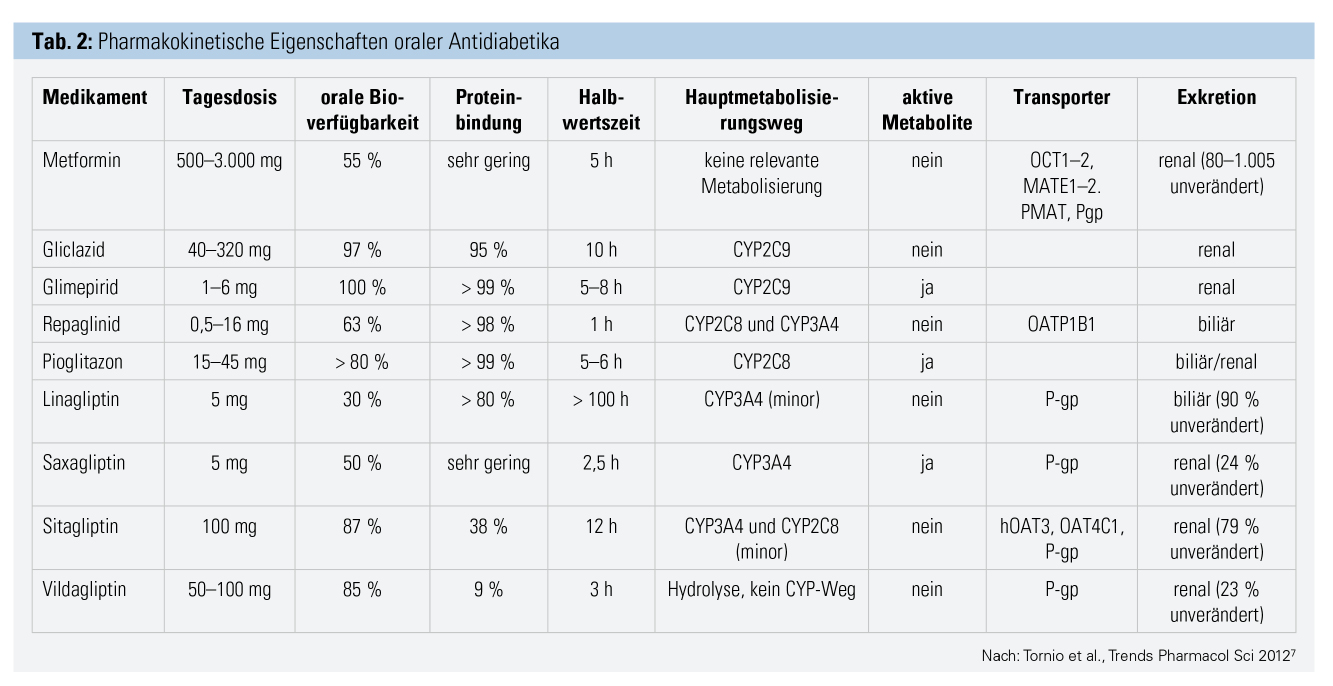
Orale Antidiabetika: Die Wahl des Therapieregimes erfolgt bei Typ-2-Diabetes entsprechend aktuellen Leitlinienempfehlungen vorrangig unter Berücksichtigung des Vorliegens kardiovaskulärer Erkrankungen und/oder einer Nephropathie.1, 2 Das Hypoglykämierisiko und die Gewichtseffekte zählen zu weiteren Entscheidungskriterien. Vor allem bei geriatrischen Patienten muss die Dosierung der Medikamente an das Körpergewicht und die Nierenfunktion angepasst werden (Tab. 2).7 Um das Risiko von Arzneimittelinteraktionen und Komplikationen zu reduzieren, wird eine regelmäßige Überprüfung der Medikationsliste im Sinne einer Kontrolle der Indikationsstellung und Dosierung empfohlen.
- Metformin gilt als medikamentöse Basistherapie in der Behandlung des Typ-2-Diabetes. Bei geriatrischen Patienten kann jedoch der gewichtsreduzierende Effekt unerwünscht sein. Metformin unterliegt keiner Plasmaproteinbindung und wird praktisch unverändert renal ausgeschieden.7 Die Nierenfunktion stellt ein wichtiges Kriterium hinsichtlich einer Kontraindikation für Metformin bzw. Notwendigkeit zur Dosisanpassung dar. Bei einer eGFR zwischen 45 und 59 ml/min und beim Fehlen weiterer Risikofaktoren für eine Laktazidose ist in Österreich laut Zulassungstext eine Verabreichung von Metformin in einer Dosierung von maximal 2-mal 500 mg möglich. Die Nierenfunktion muss dabei zumindest im Abstand von 3 bis 6 Monaten kontrolliert werden. Bei einer eGFR unter 45 ml/min besteht eine absolute Kontraindikation für Metformin. In Bezug auf möglich Arzneimittelinteraktionen von Metformin wird eine Beeinflussung der renalen Clearance durch Cimetidin beschrieben.7 Zu beachten ist auch eine mögliche Akkumulation von Metformin bei gleichzeitiger Einnahme von Medikamenten, welche die Nierenfunktion verschlechtern könnten, wie nichtsteroidale Antirheumatika, Cyclosporin, Aminoglykoside und Kontrastmittel.6 Unter Bezugnahme auf die aktuellen Leitlinienempfehlungen1, 2 erfolgt die Erweiterung einer Basistherapie mit Metformin in Abhängigkeit vom Fehlen bzw. Vorliegen einer manifesten kardiovaskulären Erkrankung. Bei einer manifesten kardiovaskulären Erkrankung sollten Substanzklassen mit einem in Studien belegten kardiovaskulären Vorteil der Vorzug gegeben werden. Dazu zählen insbesondere SGLT-2-Inhibitoren und GLP-1-Analoga.
- SGLT-2-Inhibitoren weisen neben den kardiovaskulären Vorteilen
auch keine relevanten Arzneimittelinteraktionen auf. Aufgrund der Glukosurie ist das Risiko für genitourethrale Infekte sowie der milde diuretische und blutdrucksenkende Effekt dieser Medikamentenklasse zu beachten. Eine Anpassung der Begleitmedikation kann deshalb erforderlich sein. - Der Einsatz von GLP-1-Analoga, die subkutan injiziert werden müssen, ist bei geriatrischen Patienten aufgrund der Appetithemmung und Gewichtsreduktion mit einem erhöhten Risiko für die Entwicklung einer Malnutrition begrenzt.
- Bei Pioglitazon sind bei älteren Menschen vor allem die erhöhte Neigung zur Flüssigkeitsretention und Ödembildung sowie das erhöhte Frakturrisiko bei älteren Frauen zu beachten.1, 2 Infolge eines gemeinsamen Metabolisierungsweges über das Zytochrom P450 erhöhen Gemfibrozil und Trimethoprim die Pioglitazonspiegel.
- DPP-4-Inhibitoren werden bei älteren Patienten aufgrund der guten Verträglichkeit, des im Vergleich zu Sulfonylharnstoffderivaten deutlich geringeren Hypoglykämierisikos und des geringen Arzneimittelinteraktionspotenzials häufig eingesetzt.1 In klinischen Studien konnte die kardiovaskuläre Sicherheit von DPP-4-Hemmern aufgezeigt werden, für Saxagliptin und Alogliptin wurde jedoch eine Zunahme der stationären Aufnahmen wegen Herzinsuffizienz beschrieben.12 Bei Sitagliptin, Saxagliptin, Vildagliptin und Alogliptin muss bei einer GFR < 50 ml/min eine Dosisreduktion erfolgen.
- Sulfonylharnstoffderivate und Repaglinid weisen eine hohes Hypoglykämierisiko und Arzneimittelinteraktionspotenzial auf. Der Einsatz von Sulfonylharnstoffderivaten sollte insbesondere bei einer eingeschränkten Nierenfunktion (GFR < 30 ml/min) vermieden werden.1, 2
Eine Indikation zur Insulintherapie bei Typ-2-Diabetes besteht, wenn durch diätetische Maßnahmen und orale Antidiabetika bzw. GLP-1-Analoga das individuelle Therapieziel nicht erreicht wird oder Kontraindikationen gegenüber oralen Antidiabetika oder GLP-1-Analoga bestehen. Eine vorübergehende Insulintherapie kann bei Typ-2-Diabetes darüber hinaus bei schweren Begleiterkrankungen oder perioperativ angezeigt sein.1, 2 Die Insulintherapie führt zu einer effektiven HbA1c-Reduktion. Altersunabhängig gelten als Hauptnebenwirkungen der Insulintherapie ein erhöhtes Hypoglykämierisiko und die Gewichtszunahme. Die vor allem infolge der anabolen Effekte von Insulin zu beobachtende Gewichtszunahme kann bei geriatrischen Patienten jedoch durchaus erwünscht sein.
Voraussetzung zur erfolgreichen Umsetzung der Insulintherapie ist eine entsprechende Schulung der Patienten. Das strukturierte geriatrische Assessment gestattet, anhand der Testergebnisse zu erkennen, ob ältere Patienten in der Lage sind, Insulin selbst zu verabreichen, oder ob eine Unterstützung durch das Betreuungsumfeld oder die Hauskrankenpflege erfolgen muss.
Das Insulinregime sollte gerade bei älteren Patienten einfach und im Alltag gut umsetzbar sein. Zu betonen ist dabei auch die Notwendigkeit einer adäquaten Ernährung, um Hypoglykämien zu vermeiden („Essen auf Rädern“).
Die basalinsulinunterstützte orale Therapie (BOT) mit einer Therapieerweiterung mit oralen Antidiabetika durch ein langwirksames Basalinsulin gilt als gute Möglichkeit zur initialen Insulinisierung. Langwirksame Insulinanaloga (Insulin glargin U 100, Insulin detemir) und vor allem langwirksame Insulinanaloga der zweiten Generation (Insulin glargin U 300, Insulin degludec) weisen eine gegenüber NPH-Insulin deutlich geringere Dosis-Wirkungs-Variabilität und ein geringes Hypoglykämierisiko auf. Eine Alternative stellt die sogenannte konventionelle Insulintherapie mit der 2-mal täglichen Injektion eines Mischinsulins dar.