Hepatitis C – Erste „Real-Life-Daten“
Die Therapie der chronischen Hepatitis C wurde durch die Einführung direkt antiviral wirksamer Substanzen vor allem beim Genotyp-1-Patienten grundlegend modifiziert und die Heilungschancen bei diesem Patientenkollektiv wurden deutlich verbessert. Im Frühjahr 2012 kam es zur Zulassung von Telaprevir und Boceprevir, Proteaseinhibitoren (PI) der ersten Generation, in Kombination mit pegyliertem Interferon (peg-IFN) und Ribavirin (RBV) bei Genotyp(GT)-1-Patienten.
Klinischer Einsatz der PI der 1. Generation beim GT-1
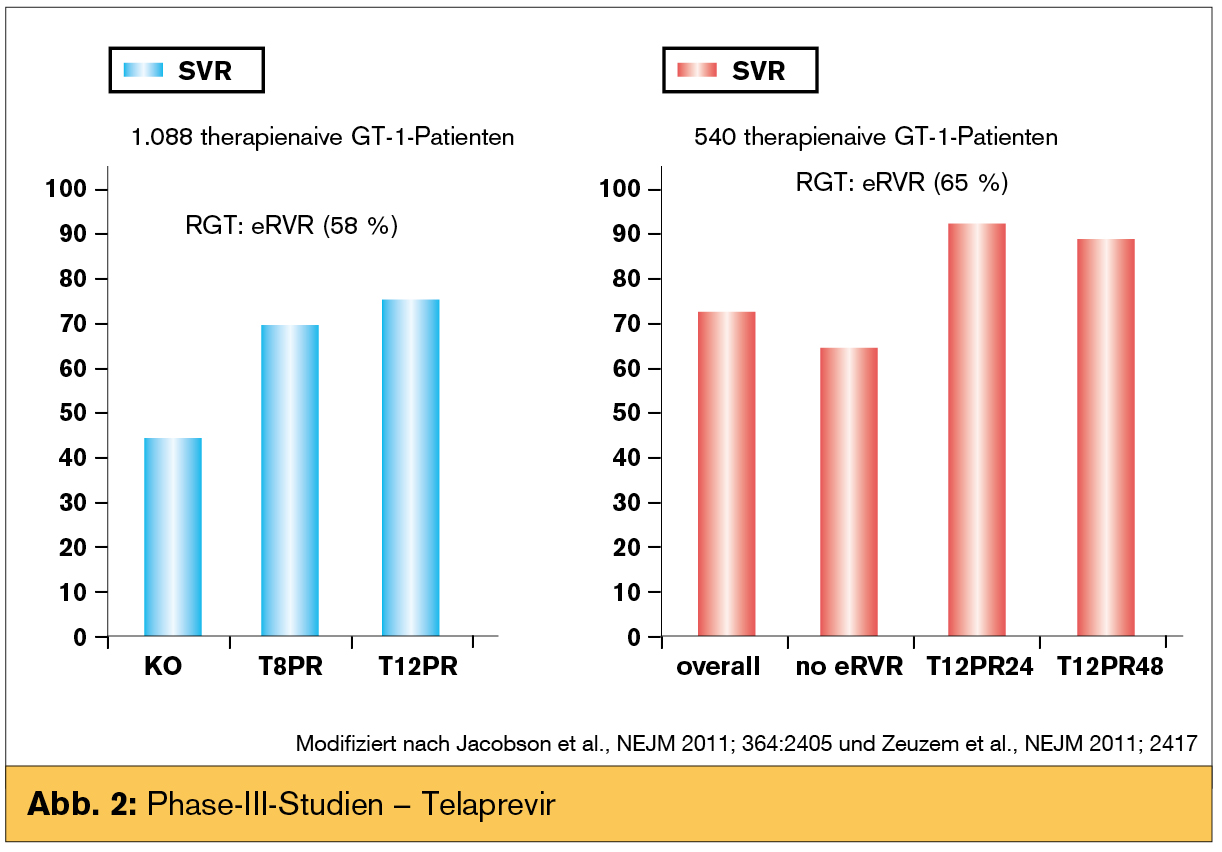
Therapienaive Patienten: Zwei Phase-III-Studien liegen für den Proteaseinhibitor Telaprevir (Incivo®) vor. In einer Studie wurde Telaprevir in einer Dosierung von 750 mg 3-mal täglich in Kombination mit peg-IFN und RBV entweder für 8 oder 12 Wochen eingesetzt mit anschließender peg-IFN/RBV-Therapie für insgesamt 24 Wochen. Bei Patienten, die einen „extended rapid virologic response“ (eRVR), definiert als nicht nachweisbare HCV-RNA zu Woche 4 und 12 erzielen konnten, wurde die Therapie beendet. Bei Patienten ohne eRVR wurde die peg-IFN/RBV-Therapie für eine Gesamttherapiedauer von 48 Wochen verlängert. Die 2. Studie bestätigte, dass bei Patienten mit einem eRVR eine Therapieverkürzung auf 24 Wochen (12 Wochen Tripel- gefolgt von 12 Wochen Dualtherapie) im Sinne einer „response-guided therapy“ (RGT) ausreicht bzw. eine Therapieverlängerung auf 48 Wochen zu keiner zusätzlichen Verbesserung führt.
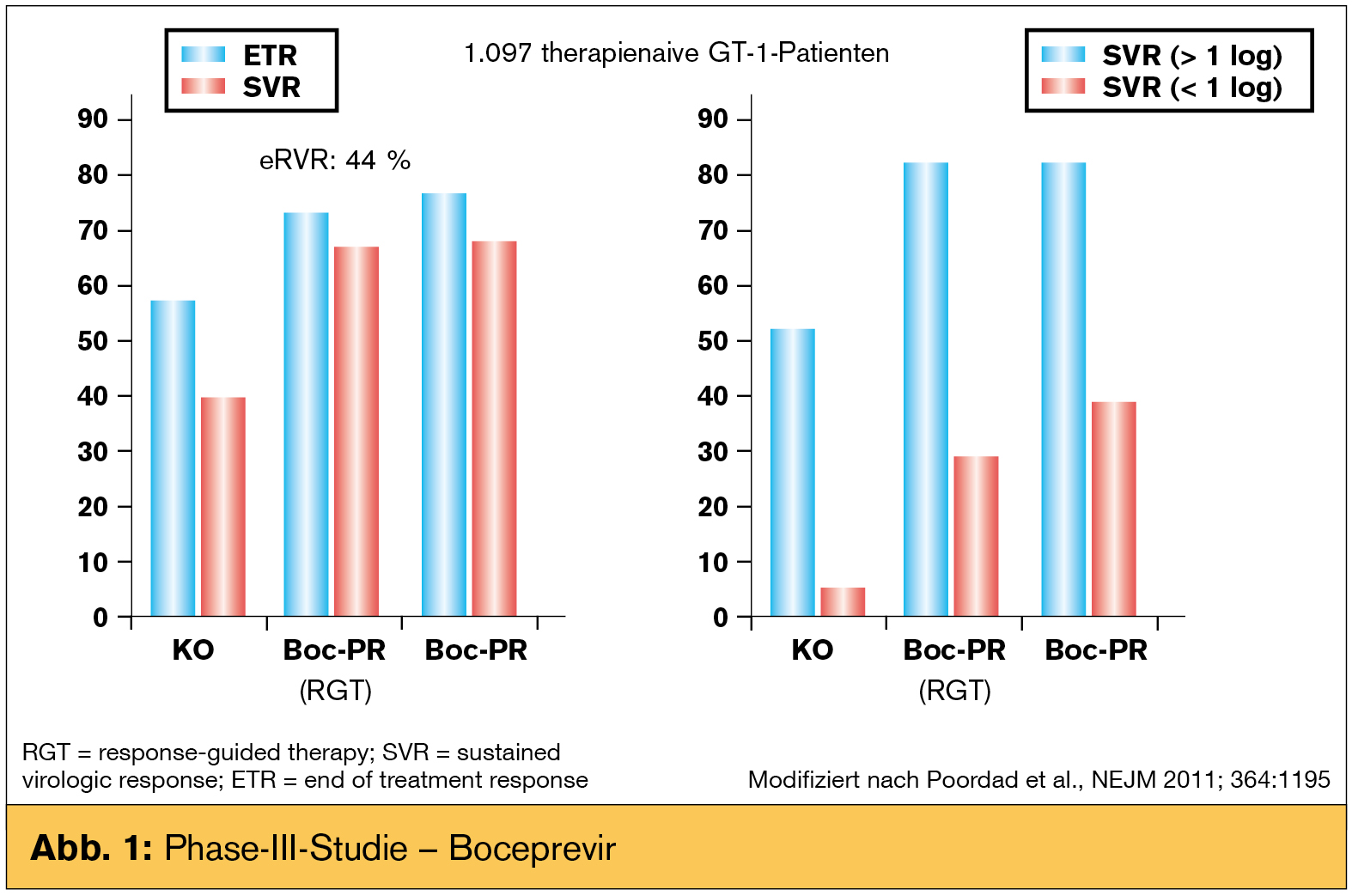
Zu Boceprevir (Victrelis®) liegt eine Phase-III-Studie vor. Im Gegensatz zu Telaprevirstudien erhielten die Patienten zur Bestimmung der Interferonsensitivität zunächst peg-IFN/RBV für 4 Wochen („Lead-in-Phase“). Patienten mit geringer IFN-Sensitivität, definiert als Virusabfall < 1 log-Stufe, zeigten im Weiteren unter der Tripeltherapie ein signifikant schlechteres Ansprechen. Die Lead-in-Phase stellt somit einen klinisch relevanten prädiktiven Parameter für das Ansprechen auf eine antivirale Therapie dar. Im Anschluss an die Lead-in-Phase wurde Boceprevir in einer Dosierung von 800 mg 3-mal täglich in Kombination mit peg-IFN/RBV über weitere 24 Wochen bei Erreichen eines eRVR (nicht nachweisbare HCV-RNA zu Woche 8 und 24) bzw. über weitere 44 Wochen bei Patienten ohne eRVR verabreicht.
Die Ergebnisse hinsichtlich Heilungsraten („sustained virologic response“, SVR) beider Substanzen sind in den Abbildung 1 und 2 zusammengefasst.
Therapieversager auf Vortherapie mit peg-IFN und RBV: In diesem Patientenkollektiv müssen drei Gruppen unterschieden werden:
- Relapser: Patienten sind zu Therapieende HCV-RNA-negativ, danach wiederum positiv.
- Partielle Responder: Patienten zeigen zu Woche 12 einen Abfall der HCV-RNA > 2 log-Stufen, werden im weiteren Verlauf jedoch nie HCV-RNA-negativ.
- Null-Responder: Patienten zeigen zu Woche 12 einen HCV-RNA-Abfall von < 2 log-Stufen.
In den „Therapieversagerstudien“ wurden die Patienten gemäß dem Ansprechen auf die Vortherapie eingeteilt. Es konnte für beide Substanzen gezeigt werden, dass Relapser von einer Tripeltherapie am meisten profitieren, da sie Heilungsraten ident zu therapienaiven Patienten aufweisen. Partielle Responder sprachen schlechter auf eine Therapie an, jedoch wiederum besser im Vergleich zu Null-Respondern, bei denen die geringsten SVR-Raten gesehen wurden. Im Vergleich zu peg-IFN/RBV-Kontrollgruppen waren die SVR-Raten der Tripeltherapie in allen Subgruppen jedoch signifikant besser.
Patienten mit fortgeschrittener Leberfibrose/-zirrhose: In die Zulassungsstudien wurde nur eine geringe Anzahl von Patienten mit fortgeschrittener Fibrose/Zirrhose inkludiert. Daher sind die Erfahrungen zur Tripeltherapie bei diesem Patientenkollektiv limitiert. Bei therapienaiven Patienten und Relapsern konnten zufrieden stellende Responseraten beobachtet werden. Jedoch sprachen gerade Null-Responder mit Leberzirrhose, also Patienten mit größter Notwendigkeit einer Viruselimination, nur in einem geringen Prozentsatz (SVR 14 %) auf die Tripeltherapie an.
Nebenwirkungen: Die Zulassungsstudien für Telaprevir als auch Boceprevir ergaben, dass beide Substanzen zusätzlich zu den bekannten Nebenwirkungen von peg-IFN/RBV weitere Nebeneffekte aufweisen. Wie rezente „Real-Life-Studien“ zeigten, können diese Nebenwirkungen vor allem bei Patienten mit fortgeschrittener Leberfibrose/-zirrhose potenziell lebensbedrohlich sein. Daher sollte die Tripeltherapie Spezialabteilungen vorbehalten bleiben.
Beide Substanzen führen zu einer Verstärkung der Anämie. Bei etwa 40 % der Patienten kam es in den bisherigen Tripeltherapiestudien zu einer therapiebedürftigen Anämie. Daher sollten regelmäßige (monatliche) Blutbildkontrollen durchgeführt werden. Die additive Potenz der Proteaseinhibitoren erlaubt eine Dosisreduktion von RBV zur Behandlung der Anämie ohne negativen Einfluss auf das virologische Ansprechen. Eine Dosisreduktion von Telaprevir oder Boceprevir darf aufgrund der dadurch möglichen Resistenzentwicklungen nicht erfolgen.
Bei Telaprevir stehen dermatologische Nebenwirkungen im Vordergrund. Bis zu 50 % der Patienten klagen über Juckreiz und Hautausschläge. Besonders unangenehm ist der perianale Juckreiz. Selten (< 1 %) kann es zu schweren dermatologischen Erkrankungen (Steven-Johnson-Syndrom; „drug rash with eosinophilia and systemic symptoms“, DRESS) kommen, die ein sofortiges Absetzen von Telaprevir erfordern. Eine unangenehme, aber nicht gefährliche Nebenwirkung von Boceprevir stellen Geschmacksstörungen dar.
Medikamenteninteraktionen: Da Telaprevir und Boceprevir über das Zytochrom P450-3A abgebaut werden, sind Interaktionen mit zahlreichen Medikamenten wie Antibiotika, orale Kontrazeptiva, Benzodiazepine und Immunsuppressiva beschrieben worden. Detaillierte Information sind über die Website www.hep-druginteractions.org erhältlich.