Hepatitis C und chronische Nierenerkrankung
Hepatitis-C-Virus-(HCV-)Infektion und chronische Niereninsuffizienz (Chronic Kidney Disease – CKD) oder akutes Nierenversagen sind aus zwei Gründen von großer wechselseitiger Bedeutung. Erstens stellen CKD-Patienten eine Hochrisikopopulation für eine HCV-Infektion dar, nicht zuletzt aufgrund des gegebenen Infektionsrisikos im Rahmen der Hämodialyse. Zweitens kann das HCV selbst verschiedene Nierenerkrankungen auslösen. Zudem erhöht eine HCV-Infektion das Risiko einer Progredienz zum dialysepflichtigen Nierenversagen bei Patienten mit CKD. Nach einer Nierentransplantation (NTX) vermindert eine HCV-Infektion mit aktiver Replikation das Transplantat- und Patientenüberleben.
HCV-Infektion als CKD-Folge
Bevor strenge Hygienerichtlinien, regelmäßiges serologisches Screening und Erythropoetin-Präparate die Rate an nosokomialen HCV-Infektionen bei Dialysestationen deutlich verringerten, war die Rate an HCV-positiven CKD-Patienten bis zu 10-fach höher als in der Allgemeinbevölkerung. Daten der DOPPS-Arbeitsgruppe zeigten, dass die HCV-Prävalenz bei Dialysepatienten von 14,3 % im Studienzeitraum 1996–2001 auf 8,7 % im Zeitraum 2012–2015 zurückging, wobei die Prävalenz in der nierengesunden Population der teilnehmenden Länder 1–2 % betrug. Aktuelle Guidelines empfehlen das 6-monatliche serologische HCV-Screening bei Dialysepatienten sowie die einmalige Untersuchung im Rahmen jeder erstmaligen Abklärung für CKD und bei Patienten vor der Listung zur NTX. Bei Detektion eines positiven Anti-HCV-Antikörpers muss eine Untersuchung der HCV-RNS erfolgen, um das Vorliegen einer Infektion zu beweisen oder auszuschließen.
HCV als Ursache für Nierenerkrankungen
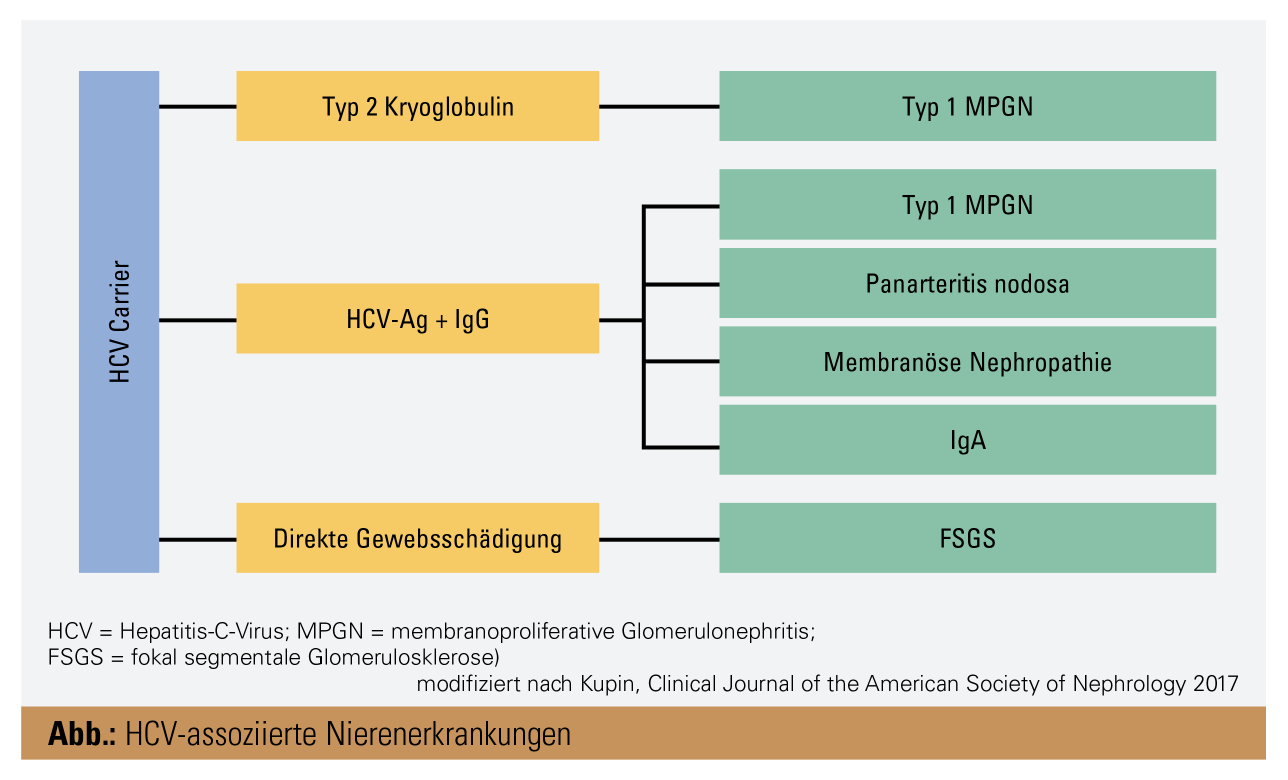
HCV-Positivität erhöht die Inzidenz einer Reihe kardiovaskulärer Komorbiditäten wie arterieller Hypertonus und Diabetes mellitus, beides häufige Ursachen für das Auftreten von CKD. Weiters gibt es eine Reihe renaler Erkrankungen (membranoproliferative Glomerulonephritis [MPGN] Typ 1 mit und ohne Kryoglobulinen, Panarteriitis nodosa und membranöse Nephropathie), welche als extrahepatische Manifestation von HCV auftreten können. Insgesamt sind diese Entitäten selten und werden für < 10 % aller GFR-Abfälle bei HCV-Patienten verantwortlich gemacht.
HCV-assoziierte Glomerulonephritiden sind primär eine Folge der Ablagerung von Immunkomplexen aus viralen Antigenen und Immunglobulinen im Glomerulum. Aufgrund seiner lymphotropen Eigenschaften infiziert das HC-Virus neben Hepatozyten auch CD81+-B-Zellen und führt dort zur Produktion von poly- und monoklonalen Kryoglobulinen. Während Kryoglobulinämie Typ 3 (polyklonale) quasi nicht zu GN führt, lagern sich Typ-2-Kryoglobuline (monoklonal) als riesige Immunkomplexe subendothelial ab und führen zu MPGN. Klinisch imponiert dieses Krankheitsbild sehr heterogen, angefangen von Proteinurie und Hämaturie bis hin zu akut nephritischen Verläufen, wobei auch eine Manifestation als nephrotisches Syndrom möglich ist. Somit ist für die Diagnosestellung eine Nierenbiopsie von großer Relevanz. Laborchemisch findet sich typischerweise eine deutliche Aktivierung des klassischen Komplementpfades (C4-Verbrauch). Unbehandelt stellt Typ-2-Kryoglobulinämie eine Präkursor-Läsion für das Auftreten von B-Zell-Lymphomen dar und kann über die Beteiligung weiterer Organe im Rahmen einer kryoglobulinassoziierten Vaskulitis weitere Morbidität und Mortalität nach sich ziehen.
HCV und CKD-Progression
Die im Vergleich zu HCV-negativen Patienten deutlich erhöhte Mortalität von HCV-infizierten Dialysepatienten wird einer erhöhten kardiovaskulären Morbidität aufgrund der HCV-assoziierten Entzündung angelastet. Außerdem spielt die stark erhöhte Inzidenz hepatischer Komplikationen wie Zirrhose und hepatozelluläres Karzinom eine Rolle. Nierentransplantierte Patienten mit HCV haben ebenso ein deutlich reduziertes Transplant- und Patientenüberleben im Vergleich zu nichtinfizierten (10-Jahres-Patientenüberleben 66,1 % versus 81,5 %; 10-Jahres-Transplantüberleben 45,7 % versus 59,2 %).
HCV-Therapie bei CKD-Patienten
Das Ziel einer HCV-Therapie besteht im Erreichen einer Sustained virologic Response (SVR), definiert als nicht nachweisbare HCV-RNA 12 bis 24 Wochen nach dem Ende einer antiviralen Therapie. Da es in der Zwischenzeit belastbare Daten für die positiven Effekte auf Überleben, hepatische und extrahepatische Manifestationen einer HCV-Therapie durch alle CKD-Stadien gibt, sollten laut geltenden Richtlinien eine Therapie bei allen HCV-infizierten Patienten angedacht werden.
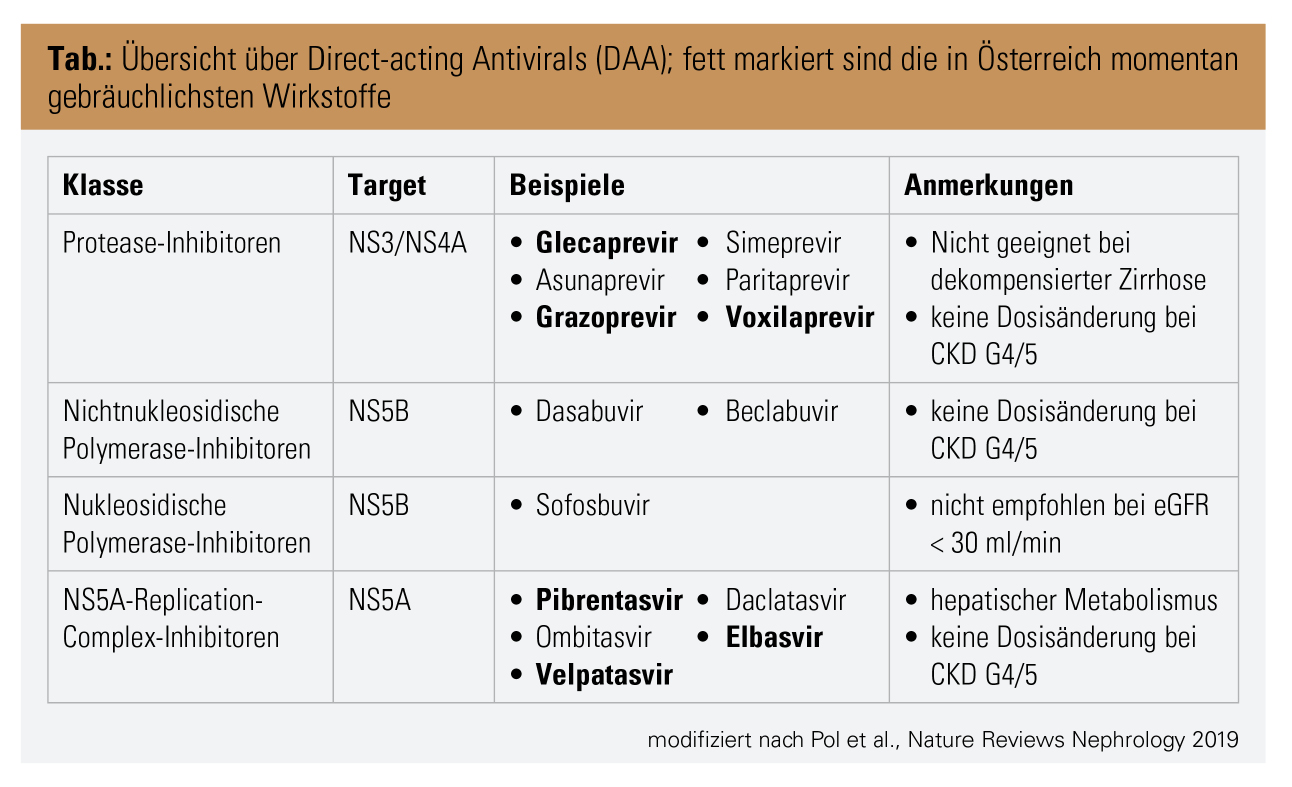
Vor der Einführung von Direct-acting Antivirals (DAA; Tab.) war die Peg-Interferon- und ribavirinbasierte Therapie bei CKD-Patienten aufgrund der renalen Ausscheidung von Ribavirin, der erhöhten Nebenwirkungsrate sowie der geringen SVR-Raten nur sehr begrenzt möglich.
Bei Patienten mit CKD G1–3 (eGFR > 30 ml/min/1,73 m2) unterscheidet sich die HCV-Therapie nicht von der bei nierengesunden HCV-Patienten und richtet sich nach dem Ausmaß einer bereits bestehenden Zirrhose – da Protease-Inhibitoren bei dekompensierter Zirrhose kontraindiziert sind – und (je nach verfügbaren Substanzen) nach dem HCV-Genotyp und -Subtyp.
Bei HCV-Infizierten mit einer eGFR < 30 ml/min/1,73 m2 (CKD G4 und G5) eignen sich Protease-Inhibitoren aufgrund der hepatischen Verstoffwechslung sehr gut. Ebenso verhält es sich mit den NS5A-Inhibitoren: In der bisher größten randomisierten, kontrollierten Studie (C-Surfer) zur HCV-Therapie bei Patienten mit fortgeschrittener CKD (inklusive Dialysepatienten) und Genotyp 1 oder 4 mit Grazoprevir und Elbasvir wurde eine SVR-Rate von 99 % erreicht. Ebenso wurde in der EXPEDITION-4-Studie bei 104 CKD-G4- und CKD-G5-Patienten (82 % Dialyse) mit der pangenotypisch wirksamen Kombination Glecaprevir und Pibrentasvir bei 98 % ein SVR erreicht. Sofosbuvir soll in dieser Situation nur verwendet werden, wenn es keine andere Alternative gibt, da es zu Sofosbuvir bei schwerer Nierenfunktionsstörung keine Dosierungsempfehlungen gibt.
Obwohl die Datenlage bei NTX-Patienten noch relativ limitiert ist, zeigt die zur Verfügung stehende Evidenz doch ermutigende Resultate: In einer randomisierten Open-Label-Studie konnte bei NTX-Patienten mit einer eGFR > 40 ml/min mit Sofosbuvir und Ledipasvir eine SVR-Rate von 100 % erreicht werden.
HCV-positive Organspender
Während im Eurotransplant-Raum die Rate an Organspendern durch Drogen-Intoxikationen (welche häufig HCV-positiv sind) bei < 1 % liegt, hat sich Inzidenz dieser Organspender in den USA im Rahmen der Opioid-Krise zwischen 2001 und 2016 mehr als verzehnfacht. Dadurch würde durch einen generellen Ausschluss von HCV-positiven Spenderorganen die Wartezeit auf eine Niere deutlich verlängert werden. Während die Verwendung HCV-positiver Spenderorgane für HCV-positive Empfänger breit akzeptiert ist, wird nun auch die Verwendung HCV-positiver Organe für HCV-negative Empfänger diskutiert. Angesichts der sehr hohen Heilungschancen einer HCV-Infektion stellt dieser Zugang sicher eine Möglichkeit zur Erweiterung des Spenderpools dar. Es gibt allerdings noch keine Konsensusempfehlungen dazu, wobei präliminäre Daten mit DAA auch hier vielversprechend sind.
Resümee
HCV und CKD weisen viele Überschneidungen auf. CKD-Patienten sind in einem hohen Risiko für HCV-Infektionen ausgesetzt. Eine HCV-Infektion verschlechtert die Prognose bei CKD-Patienten, ebenso kann HCV zu spezifischen renalen Pathologien führen. Eine DAA-Therapie bei CKD-Patienten ist sicher und verbessert die Prognose.























































































_Christian_Jungwirth_opt.jpg)
