Indikationen und Kontraindikationen zur Lebertransplantation
Basierend auf den Empfehlungen der European Association for the Study of the Liver (EASL) wurden von der Österreichischen Gesellschaft für Gastroenterologie (ÖGGH) und der Österreichischen Gesellschaft für Transplantation, Transfusion und Genetik – Austrotransplant (ATX) umfassende Empfehlungen zur Lebertransplantation (LTx) publiziert.1, 2 Welchen Zweck kann also eine Zusammenfassung über Indikationen und Kontraindikationen zur Lebertransplantation (LTx) haben?
Das Ziel der vorliegenden Arbeit ist nicht eine Zusammenfassung dieser Empfehlungen, sondern eine kritische Reflexion über die Trends im Bereich der Indikationen für eine LTx, ohne dabei die Grenzen für dieses Therapieverfahren durch die Diskussion über die Risiken für den individuellen Patienten und die Gesellschaft aus den Augen zu verlieren.
Indikationen im Wandel
Ursprünglich wurde die LTx als Last Court of Appeal angesehen und erst dann in Erwägung gezogen, wenn alle anderen konservativen oder chirurgischen Therapiemöglichkeiten erschöpft waren.3 Aufgrund der immer besseren Ergebnisse hat sich die LTx für bestimmte Indikationen – wie z. B. dem hepatozellulären Karzinom (HCC) in frühen Stadien (Abb. 1) – zum Behandlungsstandard entwickelt.4
Da die Transplantation immer noch als einzige kurative Behandlungsoption beim HCC gilt, sollte bei jedem Patienten mit HCC die Option zur Transplantation geprüft werden. Diese Überlegung stellt natürlich auch die Resektion von HCCs bei Leberzirrhose generell infrage. In Anbetracht der Tatsache, dass nach einer Resektion die Rezidiv- bzw. Rekurrenzraten nach Resektion von HCCs nach 5 Jahren bei 50–70 % liegen, ist die LTx jene Therapieform, die mit den niedrigsten Rezidivraten assoziiert ist.5–7 Trotzdem wird die Resektion als Standardverfahren angesehen, wenn das residuale Lebervolumen und die portale Hypertension dies erlauben.
LTx bei nichtresezierbaren Lebertumoren
Der scheinbare Widerspruch in der Empfehlung zur Resektion statt LTx trotz höherer Rezidivraten begründet sich in der Risikobewertung einer Resektion und dem potenziellen Nutzen einer Transplantation in Bezug auf das Überleben perioperativ und in der Langzeitnachsorge.
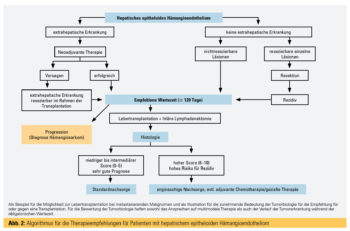
Solche grundsätzlichen Überlegungen gelten gleichermaßen für die LTx zur Therapie anderer nichtresezierbaren Tumoren. Neben dem HCC kann eine LTx auch bei ausgewählten Patienten mit intrahepatischem Cholangiokarzinom (iCCC)8, metastasierten neuroendokrinen Tumoren der Leber9 oder vaskulären Lebertumoren wie dem hepatischen epitheloiden Hämangioepitheliom (HEHE)10 erwogen werden. Bei diesen Tumoren bedarf es jedoch einer individualisierten Entscheidung, für die sich erst in den letzten Jahren Transplantationskriterien und auf Prognosemodellen basierende Behandlungsalgorithmen durchsetzten.
Diesen im Vergleich zur Transplantation selteneren Indikationen wird jedoch aufgrund des großen „transplant benefits“ immer mehr Beachtung geschenkt.11 Der vorläufige Höhepunkt dieser Entwicklung ist die LTx für Patienten mit nichtresezierbaren Lebermetastasen bei kolorektalem Karzinom, was derzeit jedoch nur innerhalb von Studienprotokollen durchgeführt werden sollte.12
Standardindikation dekompensierte Leberzirrhose
Die häufigste Indikation zur LTx ist mit 53 % der durchgeführten Transplantationen aber immer noch eine dekompensierte Leberzirrhose, die als „gemeinsame Endstrecke“ chronischer Lebererkrankungen unterschiedlichster Ätiologien gilt.13 Da ein fortgeschrittener zirrhotischer Umbau der Leber beinahe immer irreversibel und langsam progedient verläuft, ist auch der positive Effekt einer Transplantation umso größer, je länger die Nachbeobachtung wird.14 Im indirekten Vergleich des Überlebens größerer Patientenkohorten nach einer LTx mit dem spontanen Verlauf einer dekompensierten Leberzirrhose ist das Risiko für transplantierte Patienten in den ersten Monaten nach Transplantation höher13, weshalb eine strenge Risiko-Nutzen-Abwägung jede LTx-Evaluierung begleitet.
Typische Komplikationen einer Zirrhose, die eine Dekompensation definieren, sind Aszites, hepatische Enzephalopathie und Ösophagusvarizenblutung. Da sich die Prognose einer dekompensierten Zirrhose grundlegend von der Prognose einer kompensierten Zirrhose unterscheidet, sind das Auftreten einer der genannten Komplikationen Alarmsymptome, die zur Überlegung führen müssen, ob eine LTx für die betroffene Patientin oder den betroffenen Patienten infrage kommt.15 Da insbesondere die Enzephalopathie schwer objektivierbar ist, beruht die Indikationsstellung zur LTx aktuell vorwiegend auf dem MELD-Score, der sich aus Kreatinin, Bilirubin und INR errechnet.16 Ein signifikanter Überlebensvorteil wurde für die LTx in retrospektiven Studien erst ab einem MELD-Score von 15 oder höher beobachtet, weshalb aktuelle Empfehlungen erst ab MELD 15 eine Evaluierung zur LTx vorschlagen.17
Da eine ätiologische Therapie die Rekompensation der Zirrhose begünstigt, sind sowohl eine ätiologische Abklärung als auch eine Therapie auf der Warteliste indiziert. Wie rezent insbesondere für Patienten mit Hepatitis C gezeigt werden konnte, besteht bei einer ätiologischen Therapie auch eine realistische Chance auf Rekompensation ohne weitere Notwendigkeit zur Transplantation.18
Akutes Leberversagen und LTx
Im Gegensatz zu Patienten mit Zirrhose, bei denen eine LTx durch eine rechtzeitige Aufnahme auf die Warteliste durch eine Listung ab MELD 15 erreicht wird, verbietet die hohe Kurzzeitmortalität bei Patienten mit akutem Leberverssagen eine längere Wartezeit. Bei Patienten mit akutem Leberversagen ist daher eine sogenannte High-Urgency-(HU-)Listung möglich, bei der eine Priorisierung in der Organzuteilung im Eurotransplantraum erfolgt.19
Ein akutes Leberversagen wird durch eine akute schwere Funktionsstörung mit Hyperbilirubinämie und Gerinnungsstörung ohne präexistierende Lebererkrankung charakterisiert. Im Gegensatz zu einer Leberfunktionsstörung bei Sepsis wird das akute Leberversagen zusätzlich auch durch eine Bewusstseinstrübung im Sinne einer hepatischen Enzephalopathie definiert. Der Schweregrad eines akuten Leberversagens und vor allem die Indikationsstellung zur akuten Lebertransplantation erfolgt nach den sogenannten King’s College oder nach den Clichy-Kriterien (Tab. 1 und 2).20
In dieser komplexen Definition sind zwei caveats für die HU-Listung zur Transplantation enthalten. Einerseits die Formulierung „ohne präexistierende Lebererkrankung“, was eines sorgfältigen Ausschlusses einer Leberzirrhose und somit einer Abgrenzung vom akut-auf-chronischem Leberversagen bedarf, andererseits die Bewusstseinstrübung, deren Diagnose nur klinisch erfolgen kann und deren schwerste Ausprägung das Coma hepaticum ist, das bei akutem Leberversagen auch mit einem lebensbedrohlichen Hirnödem verbunden sein kann.
Ausnahmen für die HU-Listung trotz vorbestehender chronischer Lebererkrankung und sogar Zirrhose sind ein Mb. Wilson sowie das Budd-Chiari-Syndrom. Beide Erkrankungen werden neben dem anhepatischen Syndrom nach Hepatektomie wegen toxischem Lebersyndrom oder Lebertrauma auch im Eurotransplant-Handbuch angeführt.19 Patienten, die sich außerhalb dieser Standardindikationen – z. B. mit einer Erstmanifestation einer Autoimmunhepatitis auch im Zirrhosestadium mit einem akut-auf-chronischem Leberversagen präsentieren, können bei Eurotransplant in einem akuten Gutachterverfahren den HU-Status zugeteilt bekommen, wenn ein entsprechender Antrag gestellt wird.
Kontraindikationen zur LTx
Da zwischen der Indikationsstellung zur LTx und dem aktuellen Eingriff selbst bei Patienten mit HU-Listung Zeit vergeht, besteht vor der Transplantation die Notwendigkeit, Patienten auf möglich Kontraindikationen (zum Beispiel ein Hirnödem) zu untersuchen.21 Obwohl die akute zerebrale Funktionsstörung im Sinne einer hepatischen Enzephalopathie definitionsgemäß durch eine LTx reversibel ist, muss vor einer Transplantation ausgeschlossen werden, dass eine schwere irreversible Schädigung des zentralen Nervensystems durch eine Einklemmung durch Kleinhirnherniation oder durch eine zerebrale Blutung vorliegt.
Bei Patienten mit akut-auf-chronischem Leberversagen ist ein Hirnödem selbst bei schwerer Enzephalopathie selten.22 Bis vor wenigen Jahren waren bei Patienten mit Leberzirrhose eine schwere pulmonale Hypertonie oder eine schwere koronare Herzerkrankung Kontraindikationen gegen eine Transplantation, wobei beide „Kontraindikationen“ aufgrund der Fortschritte in chirurgischer und konservativer Therapie aufgelöst werden.23, 24 Trotz all dieser Fortschritte werden fortgeschrittene metastasierende Erkrankungen und akute unkontrollierte Infektionen wahrscheinlich die wenigen verbleibenden Kontraindikationen gegen eine LTx bleiben. Nach erfolgreicher Therapie von malignen Erkrankungen gilt der Konsensus, dass vor LTx-Listung ein „angemessenes“ rezidivfreies Intervall von 3–5 Jahren angestrebt werden soll. Fallserien von Patienten zeigen auch, dass selbst bei Frühkarzinomen eine Listung zur LTx möglich ist, wenn eine kurative Therapie vor der LTx oder kurz danach möglich ist.25
Alkoholabhängigkeit, alkoholische Fettleberhepatitis und LTx
Ein besonderes Risiko vor einer LTx stellen psychiatrische Erkrankungen dar, wobei sowohl chronischer Alkoholmissbrauch als auch die akute alkoholische Fettleberhepatitis mit akutem Leberversagen in den letzten Jahren einen Paradigmenwechsel erfahren.
Eine aktive Alkoholerkrankung zum Zeitpunkt der Indikationsstellung wird bei Patienten mit alkoholischer Leberzirrhose als Kontraindikation gegen die LTx angesehen, weil in dieser Situation das Risiko für einen Transplantatverlust durch ein schweres Alkoholrezidiv nach Transplantation zu hoch ist.26 Eine Ausnahme von dieser Regel repräsentieren Patienten mit akut-auf-chronischem Leberversagen im Rahmen einer alkoholischen Steatohepatitis. Unter bestimmten Umständen können für solche Patienten Ausnahmeregelungen erwogen werden. Dies gilt jedoch praktisch ausschließlich für Patienten mit einer Erstmanifestation des schädlichen Alkoholkonsums als schwere alkoholische Fettleberhepatitis, wenn eine gute soziale Anbindung besteht. Die Ergebnisse in Studien sind exzellent, insbesondere in Hinblick auf den großen Transplant-Benefit durch die infauste Prognose einer schweren alkoholischen Fettleberhepatitis.27–29
Für Patienten mit alkoholischer Leberzirrhose ohne akutes oder akut-auf-chronisches Leberversagen gilt auch der Konsensus, dass eine LTx nur dann durchgeführt werden sollte, wenn eine Motivation für eine dauerhafte Abstinenz nach der Transplantation besteht. Prognosefaktoren für eine Abstinenz sind die soziale Unterstützung und die Zahl der Alkoholrezidive vor der LTx. Die arbiträre Wartezeit und dokumentierte Abstinenz von 6 Monaten vor einer Transplantation wird in aktuellen Studien bezweifelt, weil diese Wartezeit ein schlechter Prognosefaktor für ein Alkoholrezidiv ist.30 Bei Patienten, die sich mit einer schwer dekompensierten Zirrhose und günstigen Prognosefaktoren bezüglich der Alkoholerkrankung präsentieren, kann daher auch eine Verkürzung des allgemein geforderten 3–6- monatigen Abstinenzintervalls gut begründet werden.
Zusammenfassung
Die LTx hat sich von einer Reservetherapie für Patienten, bei denen alle anderen Behandlungsmaßnahmen versagt haben oder nicht anwendbar sind, zu einer Standardbehandlung entwickelt. Damit verbunden ist eine stetige Verfeinerung der Indikationen. Insbesondere bei Patienten mit HCC scheint die Tumorbiologie (AFP und Ansprechen auf neoadjuvante lokoregionäre und systemische Therapien) mehr als das bloße Tumorstadium die Rezidivwahrscheinlichkeit nach LTx vorherzusagen. Auch das Dogma, dass metastasierte Tumorerkrankungen eine Kontraindikation gegen eine LTx darstellen, gilt weder für neuroendokrine Tumoren noch für hepatische epitheloide Hämangioendotheliome – im Gegensatz dazu bleiben z. B. das fortgeschrittene Cholangiokarzinom (> 2 cm) oder das Hämangiosarkom absolute Kontraindikationen.
Die Möglichkeit zu simultanen Multi-OrganTransplantationen oder zur Kombinationen aus LTx und Koronar-Bypassoperationen scheinen alle Grenzen der Transplantation infrage zu stellen. Daher werden wir in Zukunft öfter diskutieren wann und weniger ob die Entscheidung zur Aufnahme von Patienten auf die Warteliste zur LTx erfolgen soll, um den größtmöglichen Nutzen für einen individuellen Patienten zu erzielen. Mit dieser Aufhebung von Grenzen wird aber auch die Frage nach der Gerechtigkeit und dem Nutzen der LTx für die Gesellschaft allgemein immer wichtiger – spätestens sobald die Mortalität auf der Warteliste steigen sollte. Eine Überregulierung dieses Bereiches kann und wird keine Antwort auf diese Herausforderung darstellen, sondern nur die kontinuierliche fachliche und ethische Fortbildung sowie Reflexion aller Beteiligten über die Ergebnisse der LTx und alternativer Behandlungsmethoden.
l., N Engl J Med 2011; 365(19):1790–1800