Kardiale Amyloidose – Diagnose, Therapie, Monitoring
Die kardiale Amyloidose rückte in letzter Zeit durch eine Verbesserung der Diagnostik und Therapie mehr und mehr in den Mittelpunkt des kardiologischen Interesses. Im folgenden Artikel sollen die Diagnose, die Therapie und das Monitoring der kardialen Amyloidose näher erläutert werden.
Ätiologie
Die Ätiologie der kardialen Amyloidose beruht auf einer Ablagerung überschüssiger Proteine in Form von Amyloidfibrillen im Herzgewebe. Die Amyloidablagerungen sind nicht auf das Herzgewebe beschränkt und können grundsätzlich auch in anderen Organen wie Niere, Haut, Weichteilgewebe sowie Leber abgelagert werden. Nachfolgend soll aber dezidiert auf die zwei wichtigsten Formen der kardialen Amyloidose, die AL-Amyloidose und die ATTR-Amyloidose, eingegangen werden.
Bei der AL-Amyloidose handelt es sich um eine überschüssige Proteinproduktion von Immunglobulin-(Ig-)Leichtketten im Rahmen hämatologischer Grunderkrankungen, wie monoklonaler Gammopathie oder eines multiplen Myeloms. Hierbei kommt es zur übermäßigen Produktion von Ig-Leichtketten vom Typ Kappa (ca. 20 %) oder Lambda (ca. 80 %) in Plasmazellen. Die übermäßig produzierten Proteine fallen aus und bilden Amyloidfibrillen im Gewebe. Die Inzidenz der AL-Amyloidose beträgt in Nordamerika ca. 1 : 100.000 pro Jahr.1 In ca. 50–70 % der Fälle besteht eine Herzbeteiligung, ansonsten ist auch häufig die Niere als Organ bei einer AL-Amyloidose betroffen.2
Bei der zweiten wichtigen Entität der kardialen Amyloidose handelt es sich um die transthyretin-(TTR-)assoziierte Amyloidose. Transthyretin wird als Protein in der Leber gebildet und dient physiologisch als Transportprotein für das Schilddrüsenhormon Thyroxin oder Retinol (Vitamin A). Es kommt im Serum als Tetramer vor und dissoziiert in Monomere, die sich im Gewebe als Amyloidfibrillen ablagern können. Einerseits kann es durch bestimmte Genmutationen zu einem defekten Transthyretin-Protein kommen, was als mutante Form der TTR-Amyloidose (ATTRm) bezeichnet wird, andererseits kann es durch vermehrte Dissoziation der Tetramere in Monomere im Alter zur senilen Form der ATTR-Amyloidose (ATTRwt) kommen. Die ATTRwt-Amyloidose ist dabei zahlenmäßig deutlich häufiger anzutreffen als die ATTRm-Form.
Prognose und Häufigkeit
Die Prognose der kardialen Amyloidose ist schlecht, und die 5-Jahres-Mortalität kann auf ca. 60 % geschätzt werden.3 In letzter Zeit wurden einige Studien zur Prävalenz der ATTR-Amyloidose bei verschiedenen Patientenkollektiven veröffentlicht. So konnte eine jüngst publizierte Studie von Gonzales-Lopez et al. zeigen, dass bei Patienten mit HFpEF, einer Hinterwanddicke von mindestens 12 mm und einem Alter > 60 Jahre bei bis zu 13 % der Patienten eine ATTRwt-Amyloidose vorliegt.4 Auch bei Patienten, die eine TAVI bei Aortenstenose erhielten, wurde eine begleitende ATTR-Amyloidose in bis zu 16 % der Fälle beobachtet.5 Durch verbesserte diagnostische Algorithmen konnte in den letzten Jahren eine deutliche Zunahme der ATTRwt-Diagnosen erreicht werden.
Diagnose
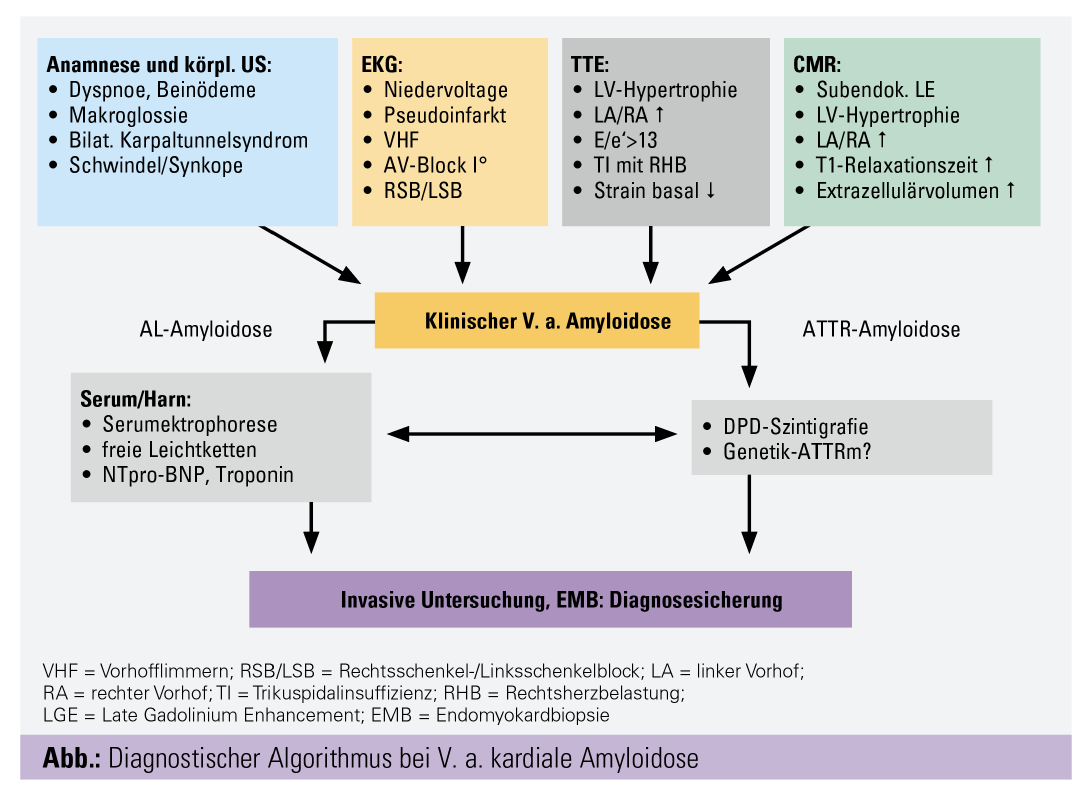
Die Diagnose der kardialen Amyloidose beruht einerseits auf der klinischen Symptomatik, der körperlichen Untersuchung, dem EKG sowie den Laboruntersuchungen, andererseits spielen bildgebende Verfahren wie die transthorakale Echokardiografie (TTE), die kardiale Magnetresonanztomografie (Herz-MRT) und seit kurzem die DPD-Knochenszintigrafie eine wichtige Rolle (Abb.). Zur Diagnosesicherung sollte in Zweifelsfällen bei uneinheitlichen Befunden eine invasive Herzkatheteruntersuchung mit Myokardbiopsie durchgeführt werden.
Symptomatisch werden viele Patienten mit Herzinsuffizienzsymptomen wie Dyspnoe, Beinödemen, Leistungsminderung sowie niedrigem Blutdruck oder aufgrund von Reizleitungsstörungen in Form von Schwindel oder sogar Synkopen. Typische Kardinalsymptome bei AL-Amyloidose sind periorbitale Einblutungen sowie eine vergrößerte Zunge mit Abdrücken der Zahnreihen (Makroglossie) als H. a. Amyloidablagerungen. Bei der ATTR-Amyloidose findet sich zudem häufig das Karpaltunnelsyndrom als H. a. eine Weichteilbeteiligung der Arme, die der kardialen Symptomatik oft Jahre vorangehen kann.
Im EKG zeigen sich häufig eine Niedervoltage, Pseudoinfarkt-Q-Zacken in V1–V3 (ca. 50 %), Vorhofflimmern, Reizleitungsstörungen wie AV-Blöcke sowie Rechts- und Linksschenkelblockbilder.6
Laborchemisch sollten die Nieren- und Leberfunktionsparameter, das kardiale Troponin sowie der Herzinsuffizienzmarker NT-proBNP bestimmt werden. Bei V. a. AL-Amyloidose sollte im Blut und im Harn eine Proteinelektrophorese durchgeführt sowie der Gehalt an freien Leichtkettenproteine bestimmt werden.
Echokardiografisch zeigt sich häufig das typische Bild einer hypertrophen Kardiomyopathie mit restriktiver Kardiomyopathie. Meist sind die Wanddicken > 14 mm, es zeigen sich eine diastolische Dysfunktion mit einem E/e´-Verhältnis > 13, vergrößerte Vorhöfe sowie in der Strain-Messung ein verminderter longitudinaler Strain in den basalen und midventrikulären Segmenten verglichen zum normalen apikalen Strain.7 Ein Perikarderguss sowie eine begleitende Rechtsherzbelastung mit pulmonaler Hypertonie können ebenfalls unspezifische Zeichen einer kardialen Amyloidose sein.
Im Herz-MRT zeigt sich häufig ein subendokardiales diffuses fleckförmiges Late Gadolinium Enhancement (LGE), eine verlängerte T1-Relaxationszeit und ein vergrößertes Extrazellulärvolumen aufgrund vermehrter Amyloidablagerungen.7 Die Herz-MRT-Untersuchung zeigt eine hohe Sensitivität (86–88 %) und Spezifität (80 %) zum Nachweis einer kardialen Amyloidose. Zwar kann mittels Herz-MRT der V. a. eine kardiale Amyloidose geäußert werden, jedoch kann keine abschließende Aussage zur Ätiologie (AL- vs. ATTR-Amyloidose) gemacht werden.
Anhand des in der Abbildung dargestellten Diagnosealgorithmus sollte bei klinischem Verdacht anhand Anamnese, körperlicher Untersuchung, pathologischer Befunde im EKG oder einer weiterführenden kardialen Bildgebung wie Herzecho oder Herz-MRT zur Differenzierung zwischen AL- vs. ATTR-Amyloidose eine Proteinelektrophorese mit freien Leichtketten im Serum und im Harn bestimmt sowie eine DPD-Knochenszintigrafie durchgeführt werden.
Gerade die Implementierung der DPD-Knochenszintigrafie in den Diagnosealgorithmus der kardialen Amyloidose hat die Detektion einer ATTRwt-Amyloidose deutlich erleichtert und dazu beigetragen, die Erkrankung in einem früheren Stadium zu diagnostizieren. Die DPD-Knochenszintigrafie besitzt eine außerordentlich hohe Sensitivität von 92–95 % sowie eine sehr hohe Spezifität von ca. 95 % in der Diagnose einer ATTR-Amyloidose, da der radioaktiv markierte Tracer spezifisch an Amyloidfibrillen bindet.7 Hierdurch kann bereits eine hohe Voraussagekraft für das Vorliegen einer ATTR-Amyloidose getroffen werden, während die DPD-Szintigrafie bei Patienten mit AL-Amyloidose in der Regel einen negativen Befund ergibt.
Zur weiteren Differenzierung zwischen ATTRwt- und ATTRm-Amyloidose werden in unserer Spezialambulanz die Patienten zusätzlich auf Mutationen im Transthyretin-Gen untersucht. Bei diagnostischer Unsicherheit, z. B. bei erhöhten Konzentrationen an freien Leichtketten im Serum/Harn sowie positiver DPD-Szintigrafie, sollte zur Diagnosesicherung eine Endomyokardbiopsie durchgeführt werden. Hiermit lässt sich mittels spezifischer Antikörper gegen ATTR-Amyloid oder AL-Leichtketten zweifelsfrei die Ätiologie der Amyloidose klären.
Therapie
Die Therapie der kardialen Amyloidose besteht zunächst in einer symptomatischen Behandlung mit Flüssigkeitsrestriktion und Diuretikagabe, insbesondere der Verabreichung von Mineralokortikoid-Rezeptor-Antagonisten (MRA) bei erhöhtem Lungendruck und kardialer Restriktion. Anzumerken ist, dass Betablocker aufgrund der negativen Chronotropie häufig bei restriktiver Kardiomyopathie nicht gut vertragen werden, weil sie insbesondere bei Belastung bei ohnehin geringem Schlagvolumen einen adäquaten Anstieg des HZV verhindern können. Auch die Gabe von ACE-Hemmern ist häufig nicht gut verträglich, da die Patienten bei diastolischer Funktionsstörung aufgrund des niedrigen Schlagvolumens meist einen niedrigen Blutdruck aufweisen. Bei zusätzlich eingeschränkter Linksventrikelfunktion sollte jedoch ein Therapieversuch vorgenommen werden.
Die spezifische Therapie der kardialen Amyloidose richtet sich nach der zugrunde liegenden Ätiologie. Bei AL-Amyloidose sollte der Patient in jedem Fall mit der Hämatologie/Onkologie besprochen werden. Bei jüngeren Patienten kommt eine Hochdosis-Melphalan-Therapie mit autologer Stammzelltransplantation, auch in Kombination mit einer möglichen Herztransplantation, in Frage. Ansonsten ergeben sich Chemotherapie-Schemata mit Melphalan und Kortison, ggf. in Kombination mit dem Proteasom-Inhibitor Bortezomib, um gezielt freie-Leichtketten-produzierende Plasmazellen zu eliminieren.6
Hinsichtlich der ATTR-Amyloidose hat es in den letzten Jahren ungemeine Fortschritte gegeben. Grundsätzliche Ansatzpunkte in der Therapie der ATTR-Amyloidose bestehen in einer verminderten Bildung des krankhaften Transthyretin-Proteins mittels Antisense-Oligonukleotiden in Form von siRNAs.8 Eine weitere vielversprechende Therapieoption besteht in der Stabilisierung von Transthyretin-Tetrameren mit dem Ziele der verminderten Dissoziation in Monomere, die im Gewebe als Amyloidfibrillen ausfallen und zu einer Fibrosierung mit Versteifung des Herzens führen.
Auf dem letztjährigen ESC-Kongress in München konnte erstmals eine große klinische Studie mit 441 Patienten mit ATTRwt und ATTRm vorgestellt werden, die einen Überlebensvorteil einer medikamentösen Therapie mit Tafamidis im Vergleich zu Placebo aufzeigte. Es zeigte sich eine 30%ige Reduktion der Sterblichkeit sowie eine 32%ige Reduktion der Hospitalisierungen bei ATTR-Amyloidose.9
Auch die Inhaltstoffe von Grüntee in Form konzentrierter Grünteekapseln können einen stabilisierenden Effekt auf den Krankheitsverlauf zeigen.10
Klinisches Monitoring
Hinsichtlich des klinischen Monitorings bei gesicherter kardialer Amyloidose sind Prognose-Scores von großem Nutzen. Beim modifizierten AL-Mayo-Score werden die drei Laborwerte für cTnT ≥ 25 ng/l, NT-proBNP ≥ 1.800 ng/l sowie die Differenz der freien Leichtketten dFLC ≥ 18 mg/ml verwendet, um eine prognostische Aussage hinsichtlich des Überlebens bei AL-Amyloidose treffen zu können.11 Hierbei gibt es pro pathologischem Laborwert 1 Punkt, bei 3 Punkten besteht die schlechteste Prognose, entsprechend einem Stadium IV.
Ein ähnlicher Score konnte von Gillmore et al. für die ATTR-Amyloidose etabliert werden. Hier fließen eine eGFR ≤ 45 ml/min/1,73m2 sowie ein erhöhter Wert für NT-proBNP ≥ 3.000 ng/l in die Prognoseabschätzung ein.12 Um den Verlauf insbesondere unter spezifischer Therapie, z. B. mit Tafamidis, besser abschätzen zu können, empfehlen wir halbjährliche Nachsorgeuntersuchungen mit Kontrolle der vorgenannten Prognoseparameter sowie die Durchführung von TTE und ggf. Herz-MRT und DPD-Knochenszintigrafie, um den Therapieerfolg besser abschätzen zu können.
Resümee
Die kardiale Amyloidose hat eine schlechte Prognose und sollte deshalb so früh wie möglich diagnostiziert werden. Die zwei wichtigsten Formen sind die AL- und die ATTR-Amyloidose, die beide zu Amyloidfibrillenablagerungen im Herzen führen. Neben klinisch körperlicher Untersuchung (periorbitale Blutungen, Makroglossie, Karpaltunnelsyndrom), Anamnese und EKG ist die kardiale Bildgebung mit Herzecho und Herz-MRT wegweisend, um den klinischen Verdacht zu erhärten. Eine weitere Differenzierung zwischen AL- und ATTR-Amyloidose gelingt mittels Proteinelektrophorese und Bestimmung der freien Leichtketten im Serum und im Harn (AL-Amyloidose) sowie der Durchführung einer DPD-Knochenszintigrafie bei V. a. ATTR-Amyloidose.
Die Therapie der AL-Amyloidose umfasst eine Chemotherapie mit/ohne autologe Stammzell-Transplantation sowie spezifische Proteasom-Inhibitoren, wie Bortezomib, gegen Plasmazellen. Für die ATTR-Amyloidose gibt es zwischenzeitlich eine lebensverlängernde Therapie mittels Tafamidis. Weitere Entwicklungen zur Therapieoptimierung sind in naher Zukunft zu erwarten.