Kardiale Bildgebung
Während Medizin und Technologie in ihrer Entwicklung stets eng miteinander verbunden waren, trifft dieser Zusammenhang besonders intensiv auf die kardiale Bildgebung zu. Einen bedeutenden Grundstein vor allem für die heute florierende Forschungstätigkeit auf dem Gebiet der kardiologischen Bildgebung als Triebfeder für weitere Entwicklungen stellt sicherlich das Aufkommen der multimodalen Bildgebung dar, bei der man sich nicht mehr lediglich auf eine Methode der kardialen Bildgebung verlässt, sondern sich durch Kombination des gesamten Bildgebungsspektrums einer Diagnose annähert. Reflektiert wird diese Entwicklung insbesondere in der Europäischen Gesellschaft für Kardiovaskuläre Bildgebung (EACVI), in der sich 2013 die Europäische Gesellschaft für Echokardiografie, kardiovaskuläre Magnetresonanz, nukleare Kardiologie und kardiale Computertomografie zusammenschlossen.
Echokardiografie
Die Umstellung von analoger auf digitale Signalverarbeitung eröffnete Möglichkeiten für Fortschritte in der transthorakalen (TTE) und transösophagealen Echokardiografie (TEE) sowohl in 2D als auch in 3D. So wurden technische Verfeinerungen wie Tissue Harmonic Imaging und Automated Border Detection zur Artefaktminimierung und Verbesserung der Bildqualität möglich.
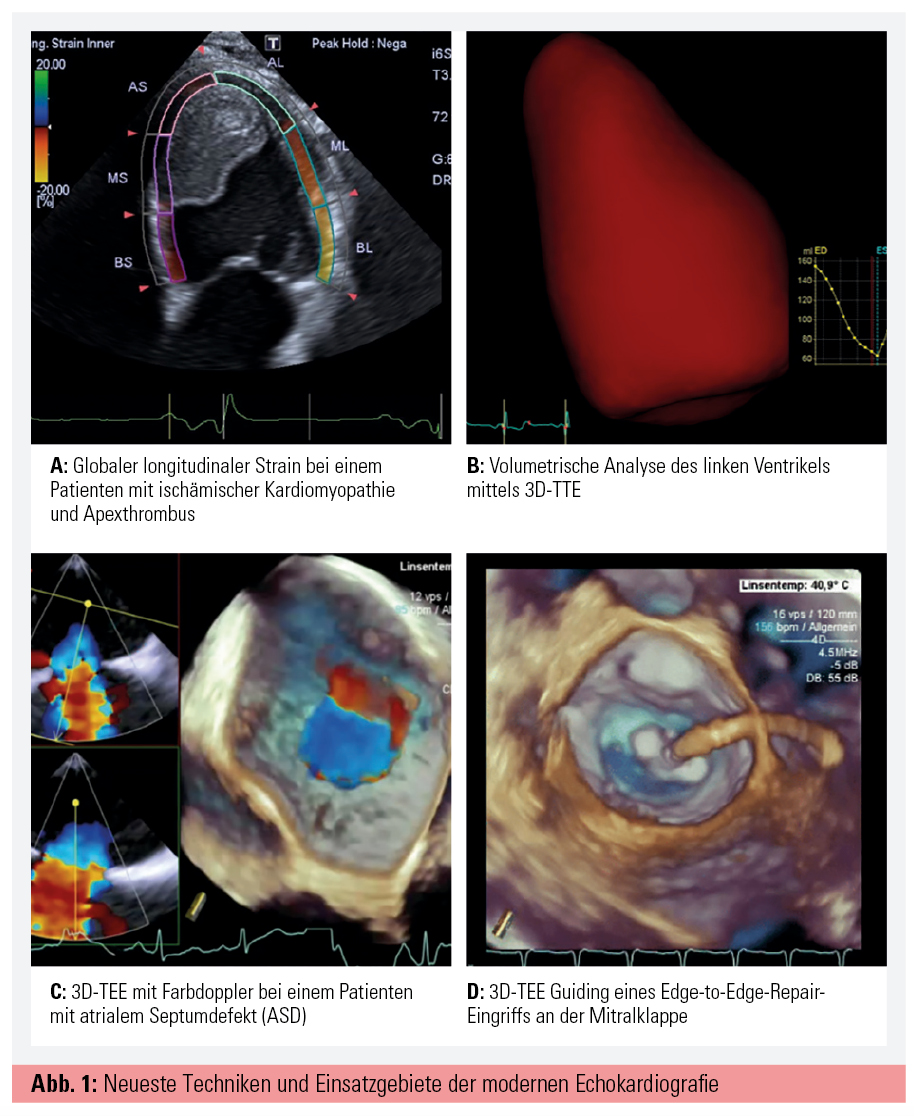
Als eine der wichtigsten Neuentwicklungen der letzten Jahre sei das myokardiale Deformation Imaging mittels Speckle Tracking hervorzuheben. Speckle Tracking verfolgt einzelne Bildpunkte – sogenannte „Speckles“ – innerhalb des Myokards, um somit Distanz, Geschwindigkeit und Richtung der Bewegung dieser Speckles zu analysieren und Aussagen über die Qualität der Kontraktion des Myokards treffen zu können (Abb. 1A). Der globale longitudinale Strain (GLS) ist der am besten validierte und weitestverbreitete Speckle-Tracking-Parameter.1 Große Bedeutung findet der GLS in der Beurteilung der systolischen Funktion, vor allem während der Chemotherapie, um eine frühzeitige myokardiale Schädigung erkennen zu können, in der Beurteilung von regionalen Wandbewegungsstörungen bei koronarer Herzkrankheit und in der kardialen Resynchronisationstherapie. Zusätzlich kann der myokardiale Strain als Entscheidungshilfe zur Festlegung des idealen Operationszeitpunkts bei Aortenklappenstenose und Mitralklappeninsuffizienz verwendet werden sowie zur Evaluierung der Mitbeteiligung der Dyssynchronie bei funktionellen Mitralinsuffizienzen.2, 3
Verbesserung von Schallkopftechnologie und Image Processing brachten große Fortschritte in der 3D-Echokardiografie. Im TTE haben sich hier vor allem die volumetrische Analyse der Herzhöhlen und die Beurteilung der systolischen Funktion durchgesetzt (Abb. 1B). Breitere Anwendung findet das 3D-TEE bei der Beurteilung von Shuntvitien (z. B. ASD, Abb. 1C), Klappenvitien sowie Prothesen, da hier mittels 3D-Farbdoppler eine genauere Beurteilung erfolgen kann. Vor dem Hintergrund der zunehmenden Transkathetereingriffe (TAVI, Edge-to-Edge Repair, LAA/ASD-Verschluss) entwickelte sich hier eigens als Subspezialität die interventionelle Echokardiografie, bei der Real-Time-3D und biplane Bildgebung zum Guiding den Grundstein für eine erfolgreiche Intervention bilden.4 Vor allem bei TAVI und Edge-to-Edge-Repair-Eingriffen kommt rezent zusätzlich das sogenannte Fusion Imaging zum Einsatz, welches Durchleuchtung und 3D-TEE superponiert, um optimales Guiding während der Intervention zu gewährleisten (Abb. 1D).5
Computertomografie
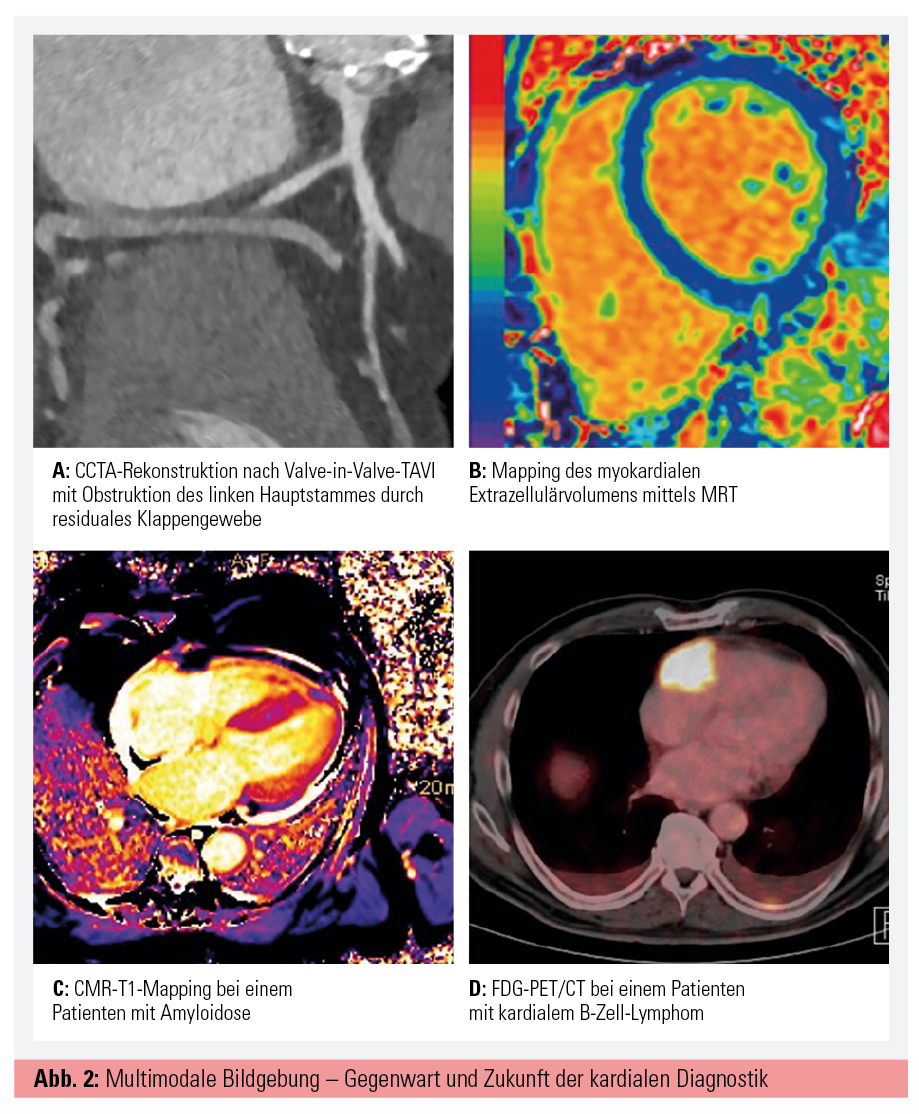
Die kardiale Computertomografie (CT) erlebte ihren ersten großen Durchbruch 1990 durch Agatston, der das Calcium Scoring zur Beurteilung der koronaren Herzkrankheit einführte.6 Mit der Entwicklung des Wide-Detector-CT, Dual-Source-CT und Dual-Energy-CT wurden im Hinblick auf räumliche und zeitliche Bildauflösung große Fortschritte gemacht, jedoch sind diese auch auf die Weiterentwicklung der Software zurückzuführen. Mit der Iterative Reconstruction wurde die Rekonstruktionstechnik verbessert. und durch die sogenannte Motion Correction kann nun die Bewegung der Koronarien während eines Herzzyklus berechnet werden. Ziel dieser Programme ist es, Strahlung sowie Artefakte zu minimieren und die Bildqualität zu verbessern (Abb. 2A).
Als nächster großer Durchbruch wird derzeit die Bestimmung der Fractional Flow Reserve (FFR) mittels Coronary computed tomography angiography (CCTA) gehandelt, welche mittlerweile durch mehrere Studien validiert wurde.7 Wie in der konventionellen Koronarangiografie kann mit dieser die hämodynamische Relevanz einer Stenose nichtinvasiv abgeklärt werden. Eine weitere Entwicklung ist die Myocardial CT Perfusion (CTP), welche wie die Myokardszintigrafie aus einer Ruhe- und einer Stressphase Bilder akquiriert und zur Ischämiediagnostik herangezogen werden kann.8 Einen nicht wegzudenkenden Stellenwert hat die CT derzeit als Voruntersuchung vor strukturellen Interventionen. Bei der TAVI können damit vor dem Eingriff der Aortenklappenanulus ausgemessen und so der Klappendurchmesser bestimmt werden, bei der kathetergesteuerten Mitralklappenimplantation kann mittels virtueller Simulationen beurteilt werden, ob durch die Intervention der linksventrikuläre Ausflusstrakt (LVOT) obstruiert würde.9, 10
Magnetresonanztomografie
Trotz schwieriger Anfänge aufgrund der langsamen Bildakquirierung der Magnetresonanztomografie und des sich bewegenden Herzens ist die kardiale MRT (CMR) mittlerweile Goldstandard in der Beurteilung von systolischer Funktion und kardialer Volumina. Die meisten CMR-Untersuchungen erfolgen mit auf Gadolinium basierendem Kontrastmittel, welches mit dem sogenannten Late Gadolinium Enhancement (LGE) exzellent in der Diagnostik von Perfusionsschäden, Narben, Fibrose oder Entzündung ist.11 Neuere Techniken, wie das sogenannte Mapping, kommen ohne Kontrastmittel aus und beruhen auf den intrinsischen, magnetischen T1- und T2-Relaxationseigenschaften des Myokards. Hier zeigte sich das T1-Mapping nützlich in der Diagnostik von akuten Pathologien wie Ödembildung, Infarkt, Myokarditis, diffuser Fibrose und subakuten Kardiomyopathien (Abb. 2B).12 Von Letzteren sei die Amyloidose herauszuheben, welche durch neu gewonnene Therapieoptionen an Bedeutung gewinnt und durch T1-Mapping sehr gut erfasst werden kann (Abb. 2C).13 T2-Mapping spielt eine Rolle in der Diagnostik von Ödemen nach Infarkten oder Myokarditis und ersetzt mittlerweile T2-gewichtete Sequenzen in den meisten Indikationen.14
Nuklearkardiologie
Die Myokardszintigraphie bleibt weiterhin der Goldstandard für Perfusionsanalysen und kommt nicht zuletzt dank der steigenden Zahl an komplexen Koronarinterventionen zur genaueren Ischämiequantifizierung zum Einsatz. Auch die myokardiale Vitalitätsanalyse mittels Szintigraphie erlebt aufgrund dessen wieder einen Aufschwung. Des Weiteren bewähren sich SPECT/CT und PET/CT bei Endokarditis als Entscheidungshilfe zur Diagnosestellung gemäß der ESC-Leitlinien, insbesondere wenn es sich um eine prothesen- oder sondenassoziierte Infektion handelt. Ein weiteres Einsatzgebiet der PET/CT stellt die Abklärung von kardialen Tumoren dar (Abb. 2D).15
Resümee
Die letzten zwanzig Jahre der kardialen Bildgebung standen ganz im Zeichen des multimodalen Imaging als bedeutende Subspezialität der Kardiologie. Die stetig steigenden Anforderungen an die kardiale Bildgebung im Kontext der derzeit stattfindenden rasanten technologischen Entwicklungen lassen auch weiterhin auf grundlegende Fortschritte hoffen.