Lupusnephritis 2012 – Frühzeitige Therapie anhand der histologischen Klassifizierung
Wann ist eine Nierenbiopsie indiziert?
Erste Hinweise für eine Nierenbeteiligung gibt das Harnsediment. Dieses sollte bei
Patienten mit SLE regelmäßig überprüft werden. Die Indikation für eine Nierenbiopsie wird beim SLE strenger als bei anderen Nierenerkrankungen gestellt, da bereits geringe Veränderungen im Harnsediment auch bei noch normaler Nierenfunktion (!) Ausdruck einer therapiebedürftigen Lupusnephritis (LN) sein können und daher nicht nur diagnostisch sondern auch prognostisch für den Patienten relevant sind. So stellen bereits eine glomeruläre Mikrohämaturie und/oder eine Proteinurie von > 0,5 g EW/24 h auch bei (noch) normaler Nierenfunktion eine Indikation zur Nierenbiopsie dar. Auch eine ungeklärte Leukozyturie (nach Ausschluss einer Infektion) sollte in einzelnen Fällen bioptisch abgeklärt werden. Liegt eine eingeschränkte Nierenfunktion bei unauffälligem Sediment vor, so entscheiden Dynamik und Anamnese über das weitere Vorgehen. Wichtig ist es,
initial auch das mögliche Vorliegen von Antiphospholipid-AK oder Lupus-Antikoagulans zu diagnostizieren.
Klinik und Histologie
Die Lupusnephritis weist das typische Bild einer Immunkomplex-Glomerulonephritis
auf. In der Immunhistologie (oder IF ) findet sich ein positives Staining für IgA, IgG, IgM sowie Komplementfaktoren (“full house”). Es gibt verschiedene histologische Typen der Lupusnephritis, welche sich hinsichtlich Prognose und therapeutischem Procedere unterscheiden.
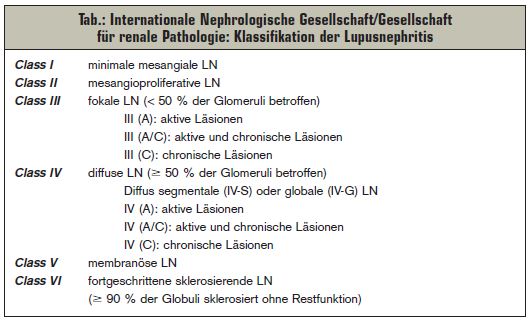
Die Evaluierung der Nierenbiopsie sollte daher nach dem ISN/RPS-2003-Klassifikations-System erfolgen, welches sich primär auf glomeruläre Veränderungen bezieht (>
Tab.). Darüber hinaus sind aber auch die Beurteilung tubulointerstitieller und vaskulärer Veränderungen sowie der Aktivitätsindex und der Chronizitätsindex für das therapeutische Vorgehen entscheidend.
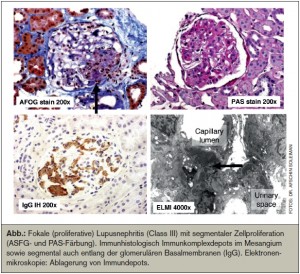
Die LN Class I beinhaltet lichtmikroskopisch unauffällige Glomeruli und weist nur geringe Immunglobulinablagerungen auf. Die LN Class II ist durch eine mesangioproliferative Glomerulonephritis mit mesangialen Immunkomplex-( IC)-Ablagerungen ohne lichtmikroskopische Veränderungen definiert. Klinisch findet sich meist eine Mikrohämaturie und/oder auch eine geringe Proteinurie (meist < 1 g/ 24 h). Die fokal segmental proliferative Glomerulonephritis (LN Class III,) ist neben mesangialen Veränderungen durch segmentale intrakapilläre Proliferationen in weniger als 50% der Glomeruli charakterisiert. Prognostisch ungünstige Faktoren sind zelluläre Proliferationen, Nekrosen und ausgedehnte subendotheliale IC-Ablagerungen sowie klinisch das Vorliegen eines nephrotischen Syndroms. Die häufigste und schwerste Form stellt die diffus-proliferative Glomerulonephritis (LN Class IV) dar, welche histologisch der LN Class III gleicht, es sind jedoch per definitionem mehr als 50% der Glomeruli betroffen. Drüber hinaus finden sich häufig ausgeprägte IC-Ablagerungen in den glomerulären Kapillarwänden sowie prognostisch ungünstige zelluläre Halbmonde, “crescents”. Der Verlauf ist aggressiv, die Patienten weisen oft schon zum Zeitpunkt der Diagnosestellung
eine eingeschränkte Nierenfunktion auf. Leitsymptome sind eine (akzelerierte) arterielle Hypertonie, eine große Proteinurie oder ein nephrotisches Syndrom, sowie – obligat – eine (Mikro-)Hämaturie. Die renale 5-Jahre-Überlebensrate wird in der Literatur zwischen 50% und 80% angeben.
Die LN Class V entspricht dem Bild einer membranösen Glomerulonephritis und ist durch
eine Verdickung der Kapillarwand charakterisiert. Klinischer Leitbefund ist die Proteinurie bis zum nephrotische Syndrom. Die Prognose ist deutlich besser als die der proliferativen Formen. Es soll jedoch darauf aufmerksam gemacht werden, dass in vielen Fällen auch ein Mischbild von LN Class III/ V oder LN Class IV/V vorliegt. Die LN Class VI entspricht mit einer globalen Sklerose von mehr als 90% der Glomeruli dem Bild einer “end stage kidney”.
Therapie – Indikation und Ziel
Die Therapie der Lupusnephritis basiert auf der diagnostischen Nierenbiopsie. Das
Hauptziel der Therapie besteht in der Langzeiterhaltung der Nierenfunktion bei möglichst niederer Toxizität und gleichzeitiger Prävention von Relapsen. Eine komplette renale Response entspricht entspricht definitionsgemäß einer Proteinurie von 1 g EW/24 h (was bei LN II selten ist!), so kann eine spezifische Therapie indiziert sein.
Die LN Class VI ist durch so hohe Chronizität charakterisiert, dass kein Benefit einer Immunsuppression zu erwarten ist und die Vorbereitung zur Nierenersatztherapie im Vordergrund steht.
Die proliferativen Formen der LN, dazu gehören LN Class III und IV, sind die schwersten Verlaufsformen. Für die meisten Patienten mit LN Class IIIA oder IIIA/C (±V) und Class IVA oder IVA/C (±V) ist eine Induktionstherapie mit Mycophenolat Mofetil (MMF) 3 g/Tag oder
low-dose i. v. Cyclophosphamid (EURO-Lupus-Schema 0,5 g alle 14 Tage, insgesamt
6-mal) in Kombination mit oralen Kortikosteroiden empfohlen. Ungünstige prognostische Faktoren in der Nierenhistologie (z. B. zelluläre Halbmonde) oder eine rasche Abnahme der GFR können den Einsatz von höher dosiertem Cyclophosphamid (i. v. CY 0,75-1 g/m2 für 6 Monate; 7 Boli) und /oder Plasmaseparation erforderlich machen. Für schwere oder therapierefraktäre Patienten stellt Rituximab eine sehr gute Alternative dar.
Milde Formen einer reinen LN Class V bedürfen primär einer Therapie mit ACE-I und/oder ARB. Liegt eine Proteinurie von > 1 g trotz Ausreizung einer Therapie mit ACE-I/ARB vor, so stellt MMF (Zieldosis 3 g/Tag) in Kombination mit oralen Kortikosteroiden die erste Wahl dar. IV Cyclophosphamid, Calcineurininhibitoren (Cyclosporin A, Tacrolimus) oder Rituximab sind weitere Alternativen. Nach Ansprechen auf die Initialtherapie, definiert als eine zumindest 50%-ige Reduktion der Proteinurie sowie Erreichen der Ausgangsnierenfunktion, kann nach 6-12 Monaten eine Remissionserhaltung mit MMF (2 g/Tag) oder Azathioprin (2 mg/kg/Tag) für mindestens 3 Jahre angestrebt und dann ausgeschlichen werden.
Monitoring und Prognose
Zur Evaluierung einer Therapieresponse sind initial ambulante Begutachtungen alle
2-4 Wochen für die ersten 3 Monate erforderlich, danach dem Therapieerfolg entsprechend länger, in jedem Falle aber lebenslang. In diesem Zusammenhang muss auch die extrarenale Krankheitsaktivität überprüft werden. Für das nephrologische Follow-up sind die Bestimmung von S-Kreatinin (GFR), Proteinurie, Harnsediment (Mikrohämaturie, Zylinder, Leukurie), Serum C3, Serum-Anti-dsDNA Titer, Blutbild und
Serumalbumin die Basis.
Eine Re-Biopsie sollte bei therapierefraktären Patienten und bei Verdacht auf Relapse durchgeführt werden, da neben einer Progression auch der Switch zu einer anderen histologischen LN-Class möglich ist. Ein schleichender Kreatininanstieg stellt eine weitere Indikation dar. Die Begleittherapie bei Patienten mit Lupusnephritis umfasst die optimale
Blutdruckeinstellung, bevorzugt mit ACE-I +/- ARB sowie die Kontrolle der Dyslipidämie
mit Statinen. Hydroxychloroquin wird bei allen Patienten im Hinblick auf eine Reduktion renaler Relapse sowie zur möglichen Reduktion des bei diesen Patienten
ohnehin erhöhten kardiovaskulären Risikos empfohlen. Eine Osteoporose-Prophylaxe ist obligatorisch.
• Die frühzeitige Diagnose der Lupusnephritis und die rechtzeitige Etablierung einer Therapie sind für die Prognose entscheidend.
• Bereits geringe Veränderungen im Harnsediment stellen eine Indikation für eine Nierenbiopsie dar, zumal dies auch bei normaler Nierenfunktion Ausdruck einer therapiebedürftigen Lupus – nephritis sein kann.
• Patienten mit Lupusnephritis erfordern eine lebenslange nephrologische Kontrolle, der Übergang in eine andere Form der LN ist jederzeit möglich.