Medikamentöse Therapie der Adipositas
Die Adipositas ist eine Erkrankung für sich und auf Basis einer entsprechenden Genetik wohl auch der wichtigste Risikofaktor für die Entstehung eines Typ-2-Diabetes.
In der EU waren laut EUROSTAT im Jahr 2014 etwa 17 % der Erwachsenen zwischen 20 und 74 Jahren adipös, 36 % übergewichtig.1 Diese Zahlen sind bereits weiter gestiegen (etwa 20 bzw. 40 %). Erhöhter BMI bedeutet erhöhte Mortalität bei Männern und Frauen, wobei dies allerdings auch für Untergewicht gilt („J-shaped curve“).2 Weltweit ist der größte Teil des Typ-2-Diabetes der Adipositas zuzuordnen, so auch in Europa.3, 4 Diabetes und Adipositas zusammen erhöhen das Mortalitätsrisiko auf etwa das 7 Fache.5
Es wird immer wieder darüber diskutiert, ob die Adipositas eine Erkrankung an sich darstellt. Eine rezente Publikation der European Association for the Study of Obesity (EASO) hat sie zum „Gateway of Ill Health“, also zu einem zentralen krankheitsbestimmenden Faktor erklärt6 und später auch eine neue Klassifikation der Adipositas als eigenständige Erkrankung für ICD-11 vorgeschlagen.7
In der „Milan Declaration 2015“ der EASO wurde die Adipositas als „progressive Erkrankung“ genannt und ihre wichtige Rolle für viele andere Erkrankungen wie die meisten NCDs („non communicable diseases“; nicht übertragbare Erkrankungen) hervorgehoben. Damit wurde die zentrale Rolle der Adipositas bei Diabetes, Hyperlipidämie und Hypertonie mit der Konsequenz erhöhter kardiovaskulärer Morbidität und Mortalität anerkannt.
Die WHO hat die Adipositas daher zum größten globalen chronischen Gesundheitsproblem erklärt, das neuerdings die Bedeutung der Malnutrition bei Weitem übertrifft. Im Jahr 2030 könnten neueren Projektionen zufolge etwa 60 % der Weltbevölkerung übergewichtig oder adipös sein.8–10
Lebensstiltherapie als Basis
Die Grundlage der Adipositastherapie liegt in der Lebensstilintervention. Diese umfasst lege artis Ernährung, Bewegung und Verhaltenstherapie.
Beim Gewichtmanagement werden weltweit und in allen Kulturen von Frauen Ernährungsmaßnahmen und von Männern Bewegungsmaßnahmen bevorzugt. Eine Zunahme der Muskelmasse und eine Verminderung der Körperfettmasse braucht in der Regel aber bei ALLEN Menschen beide Maßnahmen.
Bewegung: Die größte Herausforderung jeder Lebensstilbehandlung liegt in der Steigerung körperlicher Aktivität. Aerobe Bewegung ist zur Verminderung des Körperfettes und des Bauchumfangs geeignet. Bei Sarkopenie ist auf eiweißreiche Ernährung in Kombination mit Muskelaufbau durch unterstützendes Krafttraining zu achten. Einen besonders wichtigen Faktor stellt neben der Muskelmasse auch die Funktionalität der Muskulatur dar (z. B. Handgrip Test). Insbesondere im Alter ist die körperliche Fitness von großer prognostischer Bedeutung.
Ernährung: Eine erfolgreiche Gewichtsreduktion kann nur mit einer energiereduzierten Diät erreicht werden; diese kann fettreduziert, aber auch kohlenhydratreduziert sein und entspricht am besten einem mediterranen Ernährungsmuster. Im Fall einer fettreduzierten Diät sollte die Kohlenhydratqualität beachtet werden (bevorzugt komplexe Kohlenhydrate, möglichst wenig Mono- und Disaccharide). Supplemente mit definiertem Inhalt können im Ersatz einzelner oder mehrerer (meist 2) Mahlzeiten hilfreich sein. Auch ketogene Kostformen (mit vollem oder häufigem Mahlzeitenersatz) haben ihre Berechtigung (meist am Anfang), meist gefolgt von einem 1- bis 2-tägigen Mahlzeitenersatz.
Verhaltenstherapeutisch geht es in der Praxis darum, die Patienten zu motivieren, ihre Ernährung unter Berücksichtigung der persönlichen Präferenzen zu verändern, die Energiezufuhr zu reduzieren und diese Umstellung dauerhaft beizubehalten. Daher sind heutzutage individuell maßgeschneiderte Kostformen zu erstellen, die auch persönliche Präferenzen, Abneigungen, kulturelle und religiöse Hintergründe sowie die individuelle ökonomische Situation in Betracht ziehen.
Medikamentöse Adipositastherapie als Unterstützung
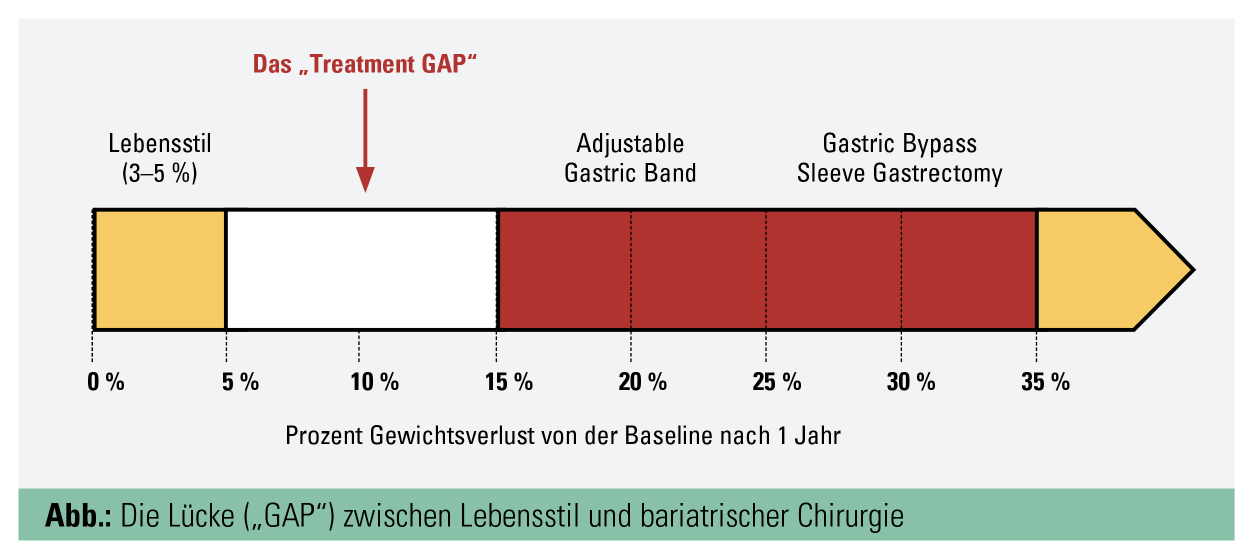
Nach wie vor wird die Lebensstilintervention als primäre Adipositastherapie betrachtet, welche durch die Gabe von Antiadiposita in ihrem Erfolg unterstützt werden kann (Abb.).
Im Darm wirksames Medikament
In Europa ist der Triglyzerid-Lipase-Hemmer Orlistat seit etwa 20 Jahren am Markt, wobei eine rezeptpflichtige Formulierung (3-mal 120 mg, Xenical®) und eine OTC-Formulierung (3-mal 60 mg, ALLI®) auf den Markt gebracht wurden.
Orlistat soll gleichzeitig mit einer fettarmen Diät eingesetzt werden (die ja selbst eine Lebensstiltherapie mit Gewichtsreduktion unterstützt) und reduziert die Fettresorption um weitere 30 %, wodurch ein Summeneffekt entsteht. Potenzielle Nebenwirkungen sind in erster Linie gastrointestinaler Natur (Fettstuhl, Diarrhö), insbesondere wenn (nicht adäquat) eine fettreiche Ernährung als Basis genutzt wird. An Tagen mit zu erwartender fettreicher Ernährung (z. B. am Abend) soll Orlistat wegen seiner langen Halbwertszeit bereits morgens weggelassen werden. Die zu erwartende Wirkung ist stark unterschiedlich. Es wird daher empfohlen, Orlistat nur bei jenen Personen länger als 3 Monate einzusetzen, die in dieser Zeitspanne mindestens ≥ 5 % Gewicht reduzieren (bei Diabetes ≥ 3 %). Bei längerfristiger Gabe empfehlen wir die zusätzliche Gabe von Multivitaminpräparaten und auch ergänzend Vitamin D.
Zentral wirksame Medikamente
Derzeit sind in der EU zwei zentral wirksame Medikamente registriert worden:
Die Fix-Kombination von Naltrexon und Bupropion (Mysimba®) verwendet zwei schon lange erhältliche Substanzen, die in Kombination einen synergistischen Effekt auf das Appetitverhalten und damit das Körpergewicht entfalten. Das Einnahmeschema beginnt in der 1. Woche mit 1 Tablette morgens, in der 2. Woche mit je 1 Tablette 1/0/1, in der 3. Woche mit 2/0/1 und ab der 4. Woche mit 2/0/2, wobei manche Patienten nicht mehr als 1/0/1 benötigen (was dann günstiger kommt). Für dieses Produkt bestehen relative und absolute Kontraindikationen, die als Checkliste von der Homepage der Firma Cheplapharm heruntergeladen werden können (Checkliste für verordnende Ärzte – Mysimba®). Bei Beachtung derselben ist die Therapie als sicher zu betrachten. Auch hier ist die Wirkung unterschiedlich – es wird daher empfohlen, das Produkt nur bei jenen Personen länger als 3 Monate einzusetzen, die in dieser Spanne mindestens ≥ 5 % Gewicht reduzieren (bei Diabetes ≥ 3 %).
Zur täglichen Injektion ist der GLP-1-Rezeptoragonist Liraglutid zugelassen (3 mg bei Adipositas, Saxenda®). Die aus der Diabetestherapie bekannte Substanz nutzt hier den zentralen, dosisabhängigen appetitvermindernden Effekt. Speziell am Anfang der Therapie und bei Dosis-Steigerung können Übelkeit und gastrointestinale Symptome wie Übersäuerung auftreten. Aus der Diabetestherapie sind mit bis zu 1,8 mg Liraglutid Senkungen kardiovaskulärer Endpunkte bekannt. Im Übrigen gelten die gleichen Regeln wie bei allen anderen Produkten. Auch hier ist die Wirkung unterschiedlich – es wird daher empfohlen, das Produkt nur bei jenen Personen länger als 3 Monate einzusetzen, die in dieser Spanne mindestens ≥ 5 % Gewicht reduzieren (bei Diabetes ≥ 3 %).
Gewichtserhaltung (Maintenance)
Eine noch größere Rolle als in der Gewichtsreduktion hätte die medikamentöse Therapie in der Gewichtserhaltung. Nach z. B. durch Ernährungstherapie erreichter Gewichtsreduktion kann eine medikamentöse Anschlusstherapie helfen, das Gewicht zu stabilisieren. Unter Liraglutid wurde gezeigt, dass Patienten in dieser Phase sogar noch weiter abnahmen. Eine solche Behandlung kann dann z. B. nach 6 Monaten versuchsweise pausiert werden – nach Zielvereinbarung, ab welcher eventuellen erneuten Gewichtszunahme die antiadipöse Therapie wieder begonnen werden soll (zyklische Therapieform).
Prävention von Gewichtszunahme
Aus Sicht der Adipositas ist auch darauf zu achten, gewichtssteigernde Begleittherapien zu vermeiden. Dies gestaltet sich jedoch meist schwierig, da sehr viele Arzneimittelgruppen ein gewichtssteigerndes Potenzial aufweisen. Zu diesen sind u. a. auch viele traditionelle Antidiabetika zu rechnen. Im Allgemeinen sind heute jene antidiabetischen Therapien zu bevorzugen, die das Gewicht der Diabetiker nicht steigern, sondern – wenn möglich – eine Gewichtsreduktion unterstützen (Metformin, DPP4-Inhibitoren, SGLT-Inhibitoren und GLP-1-Analoga).
Generell gibt es einige gewichtssteigernde Begleittherapien, auf die – natürlich nur wenn möglich – verzichtet werden sollte oder welche zumindest durch gewichtsneutrale oder reduzierende Alternativen ersetzt werden sollten. Hierzu zählen u. a. viele Psychopharmaka, welche zugleich auch die wichtigste gewichtssteigernde Begleittherapie per se darstellen. Des Weiteren sind auch Steroidhormone oder Betablocker für eine moderate Gewichtssteigerung bekannt. Unter Letzteren ist zudem eine gehäufte Diabetesmanifestation zu beobachten.
Zusammenfassung
Die medikamentöse Adipositastherapie wird in Zukunft eine der Säulen des Gewichtsmanagements werden. Bisher wird bei einem BMI ab 40 kg/m2 die Adipositaschirurgie erstattet (bei Diabetes mellitus Typ 2 ab 35 kg/m2). Darunter wäre eine medikamentöse Therapie durchaus sinnvoll, zumindest bei Respondern.
Die Problematik der medikamentösen antiadipösen Therapien liegt in erster Linie in der fehlenden Erstattung. Als reiner Selbstzahler-Markt werden die Therapien teurer angeboten als gängige verschreibbare Therapien für Diabetes, Hypertonie oder Lipidsenkung, die in der Erstattung sind.
Da bei allen drei Produkten nicht nur ein einzelner Risikofaktor reduziert bzw. verbessert wird, sollte als Kompromiss eventuell ein neuer Ansatz in der Erstattung (über die Ermittlung von „Summeneffekten auf Risikofaktoren“) angedacht und ein adäquater Preis ermittelt werden. Dann sollten die Produkte insgesamt günstiger und auch für die Sozialversicherung „leistbar“ werden.






















































































_Med_Uni_Graz_opt.jpg)
