Flankenschmerz – und was sich dahinter verbergen kann
Fallbericht, 1. Teil
Ein 45-jähriger Mann kommt wegen plötzlicher, dumpfer Flankenschmerzen links seit wenigen Stunden. Die klinische Untersuchung zeigt einen Duckschmerz im Bereich der linken Flanke und dem Mittelbauch. Der Blutdruck liegt bei 180/100 mmHg.
Laborchemisch finden sich erhöhte Leberfunktionsparameter (GOT 80 U/l, GPT 81 U/l, μ-GT 64 U/l, LDH 411 U/l, aP 70 U/l) bei bekannter Hepatitis C. Die Nierenfunktionsparameter und Serumelektrolyte liegen im Normbereich. Angesichts der Anamnese erfolgt sofort eine Harnanalyse (Leuko +, Nitrit neg., pH 7, Eiweiß neg., Glukose neg., Keton neg., Urobilinogen neg., Blut neg.). Sonographisch findet sich eine homogene, reflexreichere Leberstruktur mit glatten Konturen. Gallenblase, Gallenwege, Pankreas und Milz sind unauffällig. Die Nieren weisen ein seitengleich unauffälliges Parenchym mit unauffälligem Mittelecho und ohne Aufstau des Hohlsystems auf. Der Befund im kleinen Becken ist altersgemäß.
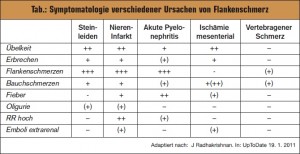
Differenzialdiagnosen: Die häufigsten Ursachen bei einseitigem Flankenschmerz sind eine Nephro-Ureterolithiasis, ein Niereninfarkt oder eine akute Pyelonephritis. Weitere Möglichkeiten und die Wertigkeit klinischer Symptome zeigt > Tab.. Laborchemisch ergeben sich wesentliche Unterschiede dahingehend, dass man sich bei Nephrolithiasis in erster Linie eine Hämaturie, bei Pyelonephritis vorwiegend eine Leukozyturie erwarten kann. Beim Niereninfarkt zeigt sich meist eine mittelgradige Leukozyturie, im Serum ist die LDH erhöht.
Fallbericht, 2. Teil
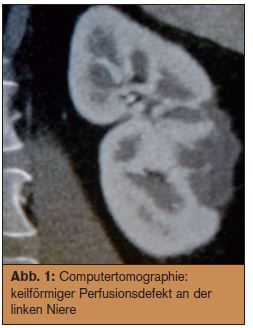
Somit ist die Sache geklärt. Der Patient hat einen Niereninfarkt links (Übelkeit, Flankenschmerz, erhöhter Blutdruck; erhöhte LDH, Leukozyturie +). Die Diagnose wird mit CT gesichert, zuerst ohne (Goldstandard zur Steindiagnostik), dann mit Kontrastmittel (keilförmiger Perfusionsdefekt; > Abb. 1). Es kann aber doch nicht sein, was nicht sein darf: Der Patient hat nämlich Hämophilie A!
Thrombembolie bei Hämophilie?
Es gibt viele Fallberichte bzw. -serien über Thrombembolien im Zusammenhang mit der Substitution von Gerinnungsfaktoren. In einer Publikation der amerikanischen FDA (JAMA 2006; 295:293-298) wurde über 431 “adverse events” mit rekombinantem humanen Faktor VIIa berichtet, von denen sich 168 Meldungen auf insgesamt 185 thromboembolische Ereignisse bezogen. Darunter befanden sich 17 Hämophilie-Patienten. Bei 99 arteriellen Thromboembolien wurde auch die renale Manifestation gesehen.
Eine Serie von 42 Hämophilie-A-Patienten aus Padua (Acta Haematologica 2006; 116:120-125) berichtete bei 62% über einen Zusammenhang von Thromboembolie mit der Substitution von Faktor-VIII-, Prothrombinkomplex- oder Rekombinanter-Faktor-VIIa-Konzentraten. Klinisch manifestierten sich in dieser Studie die meisten Patienten mit Myokardinfarkt.
Fallbericht, 3. Teil
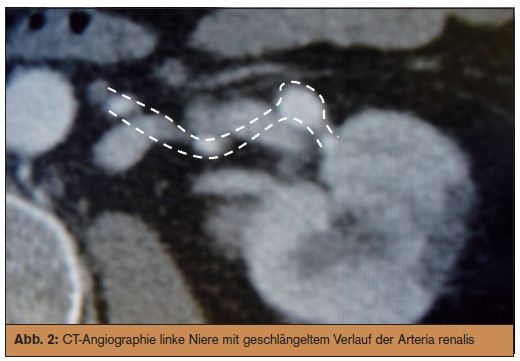
Der Patient hatte sich tatsächlich am Vortag wegen Gelenkbeschwerden 2.000 IE Faktor VIII (Octocog alfa = Helixate®) verabreicht. Ungewöhnlich, aber die Angelegenheit schien geklärt. Therapeutisch wurden mangels evidenzbasierter Empfehlungen für einige Tage Heparin und symptomatisch Analgetika bzw. Antihypertensiva verabreicht. Nur 15 Tage nach Entlassung kam der Patient erneut, diesmal mit Flankenschmerz rechts. Die Konstellation war mit Ausnahme der Lokalisation ident wie beim ersten Mal. Die CT ergab einen weiteren Niereninfarkt rechts. Der Patient hatte sich diesmal aber keine Gerinnungsfaktoren verabreicht. Der Faktor-VIII-Spiegel lag bei 2% (normal: 70 bis 150%), entsprechend der Grundkrankheit. Zahlreiche Untersuchungen hinsichtlich Genese rezidivierender Niereninfarkte folgten. Ein 24-h-Langzeit-EKG zeigte durchgehend Sinusrhythmus. Die transösophageale Echokardiographie war ohne pathologischen Befund. Entzündungsparameter waren unauffällig ebenso die Bestimmung von ANCA, Kryoglobulinen und eine Thrombophilie-Diagnostik. Ein PET-CT zeigte keine Aktivitätsanreicherung und somit keinen Hinweis auf Large-Vessel-Vaskulitis. Entscheidende Hinweise kamen dann von der nochmaligen Abklärung der Gefäßmorphologie mittels MR- und CT-Angiographie. Im MR zeigten sich rechts 2, links 3 Nierenarterien, von denen die Infarkt-bezogene untere rechte und mittlere linke Nierenarterie auffällige Gefäßveränderungen aufwiesen. Es fanden sich Kaliberschwankungen, aneurysmatische Gefäßerweiterungen (> Abb. 2) und markante Wandverdickungen mit fast vollständiger Obliteration des Gefäßlumens. Letztlich wurde eine sehr seltene Gefäßerkrankung diagnostiziert.
Segmentale arterielle Mediolyse
Die segmentale arterielle Mediolyse (SAM) wurde 1976 von Slavin und Gonzalez-Vitale (Lab Invest 1976; 35:23-29) als nichtatherosklerotische, nicht-inflammatorische Erkrankung beschrieben, die bevorzugt viszerale Arterien betrifft. Sie manifestiert sich klinisch mit Bauchschmerzen und spontanen intraabdominellen Blutungen, seltener auch mit Infarzierungen. Histologisch zeigt sich eine vakuoläre Degeneration glatter Muskelzellen der äußeren Media mit Separation von Media und Adventitia nach Platzen der Vakuolen. Es kommt zu Blutungen in die Arterienwand und ev. Rupturen. Lücken füllen sich mit Fibrin, Thromben oder Granulationsgewebe und führen zu Kaliberunregelmäßigkeiten mit Aneurysmen, andererseits zu Thrombosen.
Die Ursache der SAM ist unbekannt. Differenzialdiagnosen dazu sind Vaskulitiden (Panarteritis nodosa, Takayasu-Arteritis, Behcet-Syndrom, Purpura Schönlein-Hennoch) oder mykotische Gefäßaneurysmen (bevorzugt an Gefäßaufzweigungen). Weiters ist an die fibromuskuläre Dysplasie (Fibro plasie von Intima, Media und Advenditia; überwiegend jüngere Frauen betroffen) zu denken.
Über den Langzeitverlauf ist wenig bekannt. Die meisten Berichte umfassen eine Nachbeobachtung von 2-3 Jahren. Die Therapie wird bestimmt von der Dramatik der Präsentation. Bei intraabdominellen Blutungen kann interventionell eine Gefäßembolisation versucht werden oder es muss eine Darmresektion erfolgen. Bei Infarzierung ist das Vorgehen individuell zu entscheiden. Ein Zusammenhang mit Hämophilie A oder Hepatitis C, wie bei unserem Patienten, ist nicht beschrieben. Beweisbar ist die SAM nur histologisch (Gefäßpräparat, autoptisch). Bei unserem Patienten wurde die Diagnosestellung möglich, weil es vom Erstereignis links ein “Normalbild” der Nierenarterien rechts gab. Beim zweiten Infarktgeschehen zeigte sich als Akutveränderung eine Verdickung der Gefäßwand (Durchmesser ca. 11 mm) mit fast vollständiger Obliteration des Lumens. Weiters fanden sich links am infarktbezogenen Gefäß infolge Mediolyse ca. 6 Wochen zuvor Kaliberschwankungen und Aneurysmen (> Abb. 2). Dem Patienten geht es gut, ohne weitere Infarktereignisse. Die Nierenfunktion ist 4 Jahre später weiter normal. In einer rezenten Publikation aus Zürich (Am J Radiol 2006; 187:1463-1469) wurde ebenso über Niereninfarkte bei 2 von 5 Patienten berichtet.
Fact-Box
Die segmentale arterielle Mediolyse (SAM) stellt ein seltenes Krankheitsbild dar. Der zunehmende Einsatz der CT- und MR-Angiographie könnte dazu führen, dass die Diagnose zukünftig häufiger gestellt wird. Bei Klinik spontaner intraabdomineller Blutungen oder, seltener, viszeralen Infarkten ist der Radiologe gefordert, die typischen Gefäßveränderungen bei der Angiographie zu erkennen und den Kliniker auf die Möglichkeit einer SAM hinzuweisen.
Der Autor dankt OA Dr. S. Funk, Radiologie II, Klinikum Wels-Grieskirchen, für die CT-Bilder sowie Univ.-Prof. Dr. R. Koppensteiner, Angiologie, und Univ.-Prof. Dr. I. Pabinger-Fasching, Hämatologie, Medizinische Universitätsklinik Wien, für wertvolle Hinweise.