"Osteoporose" bei Patienten mit eingeschränkter Nierenfunktion – Diagnose und Therapie
Chronische Niereninsuffizienz (Chronic Kidney Disease – CKD) und terminale Nieren insuffizienz (End-stage Renal Disease – ESRD) sind mit einer Reihe unterschiedlicher Erkrankungen des Knochenstoffwechsels assoziiert. Mit abnehmender Nierenfunktion verändern sich die pathophysiologischen Prozesse, die den Mineral- und Knochenstoffwechsel beeinflussen. Renale Osteodystrophien sind mit Störungen des Kalzium-, Phosphat- und Parathormon- (PTH)-Stoffwechsels und mit vaskulären Kalzifikationen assoziiert und werden gemeinsam mit diesen unter dem Begriff „Chronic Kidney Disease – Mineral and Bone Disorder“ (CKD-MBD) subsumiert. Das klinische Erscheinungsbild mit Fragilitätsfrakturen oder Knochendichteveränderungen ist dem der Osteoporose ähnlich und die Abgrenzung zur CKD-MBD oft problematisch.
Und chronische Niereninsuffizienz ist bei Osteoporosepatientinnen keineswegs selten. Generell muss bei über 70-Jährigen in einem nicht unbeträchtlichen Teil mit einer deutlich verringerten glomerulären Filtrationsrate (GFR) gerechnet werden. Bei Patienten mit Osteoporose ist die Prävalenz der Niereninsuffizienz besonders hoch. Einer Analyse von Klawansky et al. zufolge liegt die Prävalenz für eine gering bis mittelgradig verringerte Kreatinin-Clearance (KrCl) _ 60 ml/min bei Frauen mit Osteoporose bei 85 % (79 %, 91 %) und die Prävalenz einer schweren Nierenfunktionseinschränkung (Kreatinin-Clearance _ 35 ml/min) bei 24 % (19 %, 29 %).1 Bei Patienten, die eine Osteoporosetherapie benötigen, spielen Überlegungen zur renalen Sicherheit der Therapeutika demnach eine wesentliche Rolle.
Diagnostik der Osteoporose bei CKD bzw. ESRD
Die klinische Diagnose der Osteoporose und auch die Erstattungskodex-(EKO)-Richtlinien für die Erstattung von Osteoporosetherapeutika beruhen auf den WHO-Kriterien eines TScores _ 2,5 bzw. dem Vorliegen einer Fraktur auf Grund eines Bagatelltraumas. Diese Kriterien können bei Patienten mit fortgeschrittener CKD bzw. ESRD jedoch nur bedingt angewendet werden, das viele Formen der CKD-MBD zwar mit Fragilitätsfrakturen einhergehen, die Knochendichtemessung jedoch durch spezifische Veränderungen der Wirbelkörpern und extraossäre Verkalkungen verfälscht sind.
Bei Patienten im Frühstadium der CKD (CKD 1–2; Stadieneinteilung > Tab. 1) können dieselben Diagnosekriterien der Osteoporose angewendet werden wie für Patienten mit normaler Nierenfunktion. Bei Patienten mit CKD in den Stadien 3–5 ist hingegen zu beachten, dass der Fraktur bzw. der verminderten Knochendichte sowohl ein adynamer Knochenstoffwechsel, eine Osteomalazie, eine Aluminium-induzierte Knochenerkrankung oder Osteitis fibrosa cystica mit einem High-Turnover zugrunde liegen können. Erschwerend kommt hinzu, dass CKDPatienten zwar ein erhöhtes Frakturrisiko aufweisen, dieses aber nicht gut mit den Ergebnissen der DEXA-Messung korreliert.
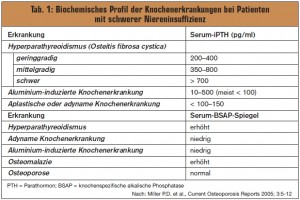
Ausschlussdiagnose: Die Diagnose der Osteoporose bei Patienten mit schwerer CKD kann daher streng genommen nur durch Ausschluss einer CKD-MBD gestellt werden. Die Unterscheidung ist in der Klinik nicht immer einfach. Hinweise liefert die Bestimmung von Parathormon (PTH) und der knochenspezifischen alkalischen Phosphatase (BSAP). > Tab. 2 gibt einen Überblick über die für die renalen Knochenerkrankungen typischen biochemischen Profile. Da es hierbei gewisse Überschneidungen zwischen den einzelnen Knochenerkrankungen beim nieren – insuffizienten Patienten gibt, ist eine definitive Diagnose aufgrund von PTH und BSAP nicht immer möglich.
Die adyname Knochenerkrankung als komplizierteste Form der renalen Osteodystrophie tritt zumeist erst bei ESRD auf und spielt daher in den therapeutischen Überlegungen bei Patienten mit gering- bis mittelgradiger Nierenfunktionseinschränkung keine Rolle.
Im Zweifelsfall biopsieren: Als Golden Standard in der Differenzialdiagnose Osteoporose und renaler Osteodystrophie gilt die Be – ckenkammbiopsie mit anschließender histomorphometrischer Auswertung.
Die laut aktuellen KDIGO-Richtlinien (Kidney Disease: Improving Global Outcomes) festgelegten Kriterien für eine Beckenkammbiopsie und Histomorphometrie listet die > Tab. 3.
Therapie der Osteoporose bei Niereninsuffizienz
Das therapeutische Vorgehen bei Osteoporose bei Patienten mit Niereninsuffizienz richtet sich nach dem Ausmaß der Nierenfunktionseinschränkung. Die aktuellen KDIGO-Guidelines aus dem Jahr 20092 empfehlen bei Patienten mit Osteoporose in den Stadien CKD 1–2 und/oder hohem Frakturrisiko ein Management entsprechend den Empfehlungen für die Allgemeinbevölkerung (1A). Das gilt auch für Patienten mit CKD Stadium 3 und PTH im Normbereich (2B). Bei Patienten mit CKD Stadium 3 mit Laborwerten außerhalb des Normbereichs, die auf niereninsuffizienzassoziierte Störungen des Mineral- und Knochenhaushalts hinweisen, und niedriger Knochendichte und/oder Fragilitätsfrakturen sollte bei der Therapiewahl der Schweregrad und die Reversibilität der Laborabnormalitäten berücksichtigt und eine Knochenbiopsie erwogen werden (2D). Bei Patienten mit CKD in den Stadien (3) 4–5D wird vor Therapie mit antiresorptiven Substanzen die Durchführung einer Knochenbiopsie vorgeschlagen (2C). Bei Kindern und jungen Erwachsenen mit CKD in den Stadien 2–5D einer chronischen Nierenerkrankung wird nach der Behebung der Mangelernährung und der Therapie der Laborabnormalitäten der Einsatz von rekombinantem Wachstumshormon empfohlen, wenn zusätzliches Wachstum erwünscht ist (1A).
Osteoporosetherapeutika bei CKD
Eine fortgeschrittene Niereninsuffizienz (Kreatinin-Clearance _ 30 ml/min) schränkt das therapeutische Repertoire deutlich ein.
Bisphosphonate werden durch glomeruläre Filtration und aktive Sekretion im proximalen Tubulus ausgeschieden. Sie sind bei einer deutlich verringerte Kreatinin-Clearance kontraindiziert (Alendronat/Zoledronsäure bei Kreatinin-Clearance < 35ml/min; Ibandronat/ Risedronat bei Kreatinin-Clearance < 30 ml/min). Auch Hypokalzämie und Vitamin-D-Defizit stellen eine Kontraindikation dar. Nach Korrektur des Vitamin-D-Spiegels und der Hypokalzämie kann die Behandlung durchgeführt werden. Bisphosphonate können die Kreatinin- Clearance beeinträchtigen, was vor bei parenteraler Applikation von Bedeutung ist. Mit Präventivmaßnahmen, wie guter Hydrierung, langsamer Infusionsgeschwindigkeit und Verabreichung eines größeren Infusionsvolumens kann dieses Risiko verringert werden.
Denosumab wird nicht über die Nieren ausgeschieden, sondern über das retikuloendotheliale System metabolisiert. Der humane monoklonale Antikörper, der spezifisch RANK-Ligand bindet und inaktiviert, ist auch für Patienten mit chronischer Niereninsuffizienz einschließlich Stadium 4 (GFR 15–29 ml/min) geeignet. Hypokalzämie ist eine Kontraindikation und sollte vor Beginn einer Behandlung mit Denosumab ausgeschlossen bzw. korrigiert werden.
Raloxifen ist bei schwerer Nierenschädigung kontraindiziert.
Strontiumranelat ist bei einer Kreatinin-Clearance < 30 ml/min kontraindiziert, bei einer Kreatinin-Clearance von 30–70 ml/min ist keine Dosisanpassung notwendig. Vor der Einleitung einer anitresorptiven Therapie muss ein adynamer Knochenstoffwechsel ausgeschlossen sein, wobei laut vorliegenden Studiendaten im Fall einer antiresorptiven Therapie primär Denosumab verwendet werden soll, da auch in der Zulassungsstudie die chronische Niereninsuffizienz kein Ausschlusskriterium war.
Parathormon: Eine intermittierende Therapie mit Parathormon (PTH 1-84, Teriparatid) ist laut Regeltext bei Kreatinin-Clearance < 30 ml/min kontraindiziert, wobei jedoch Pilotstudien mit PTH bei Patienten mit adynamem Knochen vielversprechende Ergebnisse ge – zeigt haben.3
1 Klawansky S. et al., Osteoporos Int 2003 Jul; 14 (7):570-6
3 KDIGO® Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of CKD-MBD, For Translation Publication Draft version June 22, 2009
3 Haas et al., Kidney Blood Press Res 2010 Jun 24; 33 (3):221-226