Rheuma, SLE und Schwangerschaft
Bei den meisten rheumatischen Erkrankungen sind Frauen im reproduktiven Alter häufiger betroffen als Männer, und oft wird die Diagnose gestellt, bevor die Familienplanung abgeschlossen ist. Bis vor einigen Jahren galt eine Schwangerschaft für Patientinnen mit einer systemischen Autoimmunerkrankung noch als kontraindiziert, während z. B. bei der rheumatoiden Arthritis eine Besserung der Erkrankung durch die Schwangerschaft angenommen wurde. In den letzten Jahren wandelten sich diese Dogmen, was zu einer veränderten Begleitung der Rheumapatientinnen rund um die Familienplanung und Schwangerschaft führte. Die Frage der Familienplanung sollte auf jeden Fall frühzeitig ausführlich mit Patientinnen besprochen werden, die an einer entzündlich rheumatischen Erkrankung leiden. Als sehr hilfreich erweisen sich hierfür die Empfehlungen der großen internationalen rheumatologischen Fachgesellschaften, an denen sich auch dieser Artikel orientiert.1, 2
VOR der Schwangerschaft
Fertilität: Bei den meisten systemischen Autoimmunerkrankungen liegt keine Störung der Fertilität vor. So ist z. B. bei Patientinnen mit Antiphospholipid-Antikörpern (APL) oder mit Antiphospholipid-Syndrom (APS) der Spiegel des Anti-Müller-Hormons (AMH) oder die Anzahl der Antralfollikel (AFC) mit jenen gesunder Frauen vergleichbar, weswegen eine normale Fertilität angenommen wird.3, 4 Auch beim Sjögren-Syndrom und beim systemischen Lupus erythematodes (SLE) wird im Allgemeinen von keiner Fertilitätsstörung ausgegangen, jedoch kann es bei einer Vortherapie mit Cyclophosphamid (CP) zu einer vorzeitigen ovariellen Insuffizienz bzw. zu einer Reduktion der ovariellen Reserve kommen. Dieses Risiko steigt mit dem Alter bei Therapie und mit der CP-Dosis, wenn auch kein genauer Schwellenwert angegeben werden kann. Bei dem derzeit häufig angewandten Euro-Lupus-Schema (kumulative Dosis: 3 g) wurden keine negativen Effekte auf die Fertilität beobachtet.5 Zum Erhalt der Fertilität werden oft GnRH-Analoga verordnet – trotz spärlicher Datenlage bei Autoimmunerkrankungen und potenziell heftiger menopauseähnlicher Nebenwirkungen. Bei entzündlichen Gelenkerkrankungen wird hingegen von einer verminderten Fertilität ausgegangen, insbesondere bei Patientinnen mit rheumatoider Arthritis (RA), wobei dieser Umstand mit einer Glukokortikoiddosis > 7,5 mg/Tag und mit einer regelmäßigen NSAR-Einnahme assoziiert zu sein scheint.6 Bei einer eventuellen Fertilitätsbehandlung gibt es 3 Aspekte zu bedenken: die Erfolgsrate der Behandlung, das durch die Hormontherapie erhöhte Thromboserisiko sowie ein möglicherweise induzierter Krankheitsschub. In einer Studie mit 1.149 Embryotransfers bei Patientinnen mit RA vs. 198.941 Embryotransfers in der Normalbevölkerung wurde bei RA-Patientinnen eine geringere Erfolgsrate beobachtet (Odds Ratio [OR] = 0,78; 95%-KI 0,65–0,92)7, während die Erfolgsrate bei SLE-Patientinnen mit gesunden Frauen vergleichbar zu sein scheint.8 Das Risiko einer Thrombose ist insbesondere bei einem Hyperstimulationssyndrom durch eine deutlich erhöhte Hormonkonzentration gegeben. Daher werden bei Patientinnen mit einer a priori erhöhten Thromboseneigung wie bei SLE oder APS milde Stimulationsprotokolle angewandt, und ein „Single-Embryotransfer“ wird bevorzugt. Während der Behandlung sollte auch auf eine adäquate Antikoagulation geachtet werden, die im Detail in den amerikanischen Richtlinien aufgelistet wird.2 Insgesamt ist eine Fertilitätsbehandlung – unter der Prämisse einer gut eingestellten Grunderkrankung und eines angepassten Protokolles – für Patientinnen mit rheumatologischen Erkrankungen eine sichere und valide Option.
Checkliste von Risikofaktoren VOR der Schwangerschaft
Allgemein: Auch für Patientinnen mit rheumatischen Erkrankungen gelten die allgemeinen Richtlinien bezüglich Substitution von Vitamin D, Folsäure und die Erhebung sowie Komplettierung des relevanten Impfstatus. Besonderes Augenmerk gilt der Rötelnimpfung, da es bei einer intrauterinen Infektion zu einer Rötelnembryopathie kommen kann. Da es sich um eine Lebendimpfung handelt, ist eine Unterbrechung der immunsuppressiven Therapie (Details bei Wiedermann et al.9) notwendig. Daher muss mit der Patientin rechtzeitig über das Thema Schwangerschaft gesprochen werden, sodass eine etwaige Therapieunterbrechung ausreichend lange vor der Konzeption erfolgen kann.
Speziell: Prinzipiell sollte eine Schwangerschaft nur in einem ruhigen Krankheitsstadium (bei SLE zumindest für 6 Monate, bei RA oder Spondyloarthritis [SpA] auch etwas kürzer möglich) unter stabiler, schwangerschaftskompatibler Medikation begonnen werden, da eine aktive Erkrankung bei allen rheumatischen Erkrankungen ein erhöhtes Komplikationsrisiko birgt. Weiters gibt es Antikörper, die durch ihre Wirkung auf die Plazenta (Antiphospholipid-Antikörper) oder nach ihrem transplazentaren Transport (SS-A-Antikörper) den Fötus schädigen können. Diese sollten bei Patientinnen mit Kollagenosen auf jeden Fall erhoben werden; bei Patientinnen mit entzündlichen Erkrankungen liegt die Entscheidung darüber nach den amerikanischen Richtlinien im Ermessen des Behandlers.2
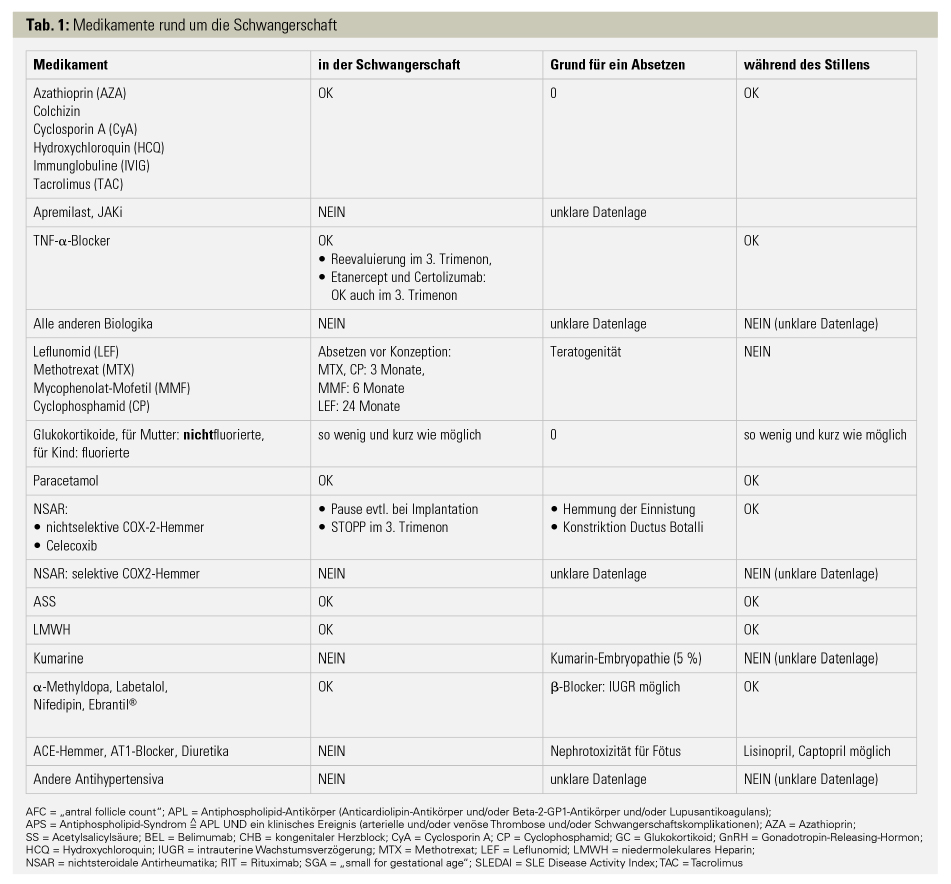
Medikamentencheck vor bzw. während Schwangerschaft (Tab. 1): Aus der Vielzahl von immunsuppressiven Medikamenten gibt es ein paar, die auch ohne Bedenken in der Schwangerschaft verabreicht werden können. Unter den konventionellen Basistherapeutika sind dies Azathioprin, Cyclosporin A, Sulfasalazin und Tacrolimus. Auch die Gabe von Immunglobulinen kann während der Schwangerschaft erfolgen. Glukokortikoide sollten wegen des erhöhten Risikos für Gestationsdiabetes und Hypertonie so sparsam und kurz wie möglich eingesetzt werden. Eine maternale Therapie mit fluorierten Glukokortikoiden ist aufgrund des hohen diaplazentaren Transportes nicht indiziert. Bezüglich der Biologika und der JAK-Inhibitoren gibt es nur für die TNF-α-Blocker ausreichend Daten. Aufgrund ihrer Struktur werden Certolizumab und Etanercept nicht diaplazentar übertragen, weswegen sie auch im 3. Trimenon ohne Einschränkung gegeben werden können, während bei den anderen TNF-α-Blockern die Gabe im 3. Trimenon evaluiert werden sollte. Nach der Schwangerschaft sollten Lebendimpfungen (z. B. Rotaviren) bei Kindern mit TNF-α-Blocker-Exposition in utero im 2. Trimenon auf den 6. Lebensmonat und mit Exposition im 3. Trimenon auf den 12. Lebensmonat verschoben werden. Totimpfstoffe können gefahrlos gegeben werden.
NSAR können neben der verzögerten Einnistung des Embryos auch im 3. Trimenon wegen ihrer konstriktorischen Wirkung auf den Ductus Botalli problematisch sein. Daher sollten nichtselektive NSAR oder Celecoxib (für die anderen COX-2-Inhibitoren gibt es zu wenige Daten) prinzipiell nur im 1. und 2. Trimenon gegeben werden.10 Acetylsalicylsäure (ASS) kann hingegen ohne Einschränkung eingenommen werden und sollte bei Patientinnen mit positiven APL+ oder APS auf jeden Fall vorgeschrieben werden; außerdem wird die Gabe bei SLE-Patientinnen zur Verhinderung einer Präeklampsie empfohlen.
Kumarine sollten wegen der Gefahr einer Embryopathie und fetaler Blutungen rechtzeitig vor der Schwangerschaft durch niedermolekulares Heparin (LMWH) ersetzt werden.Bei den antihypertensiven Medikamenten sind α-Methyldopa, selektive β1-Blocker (v. a. Metoprolol) und Nifedipin die Mittel der Wahl.
WÄHREND der Schwangerschaft (Tab. 2)
Krankheitsspezifische Komplikationen
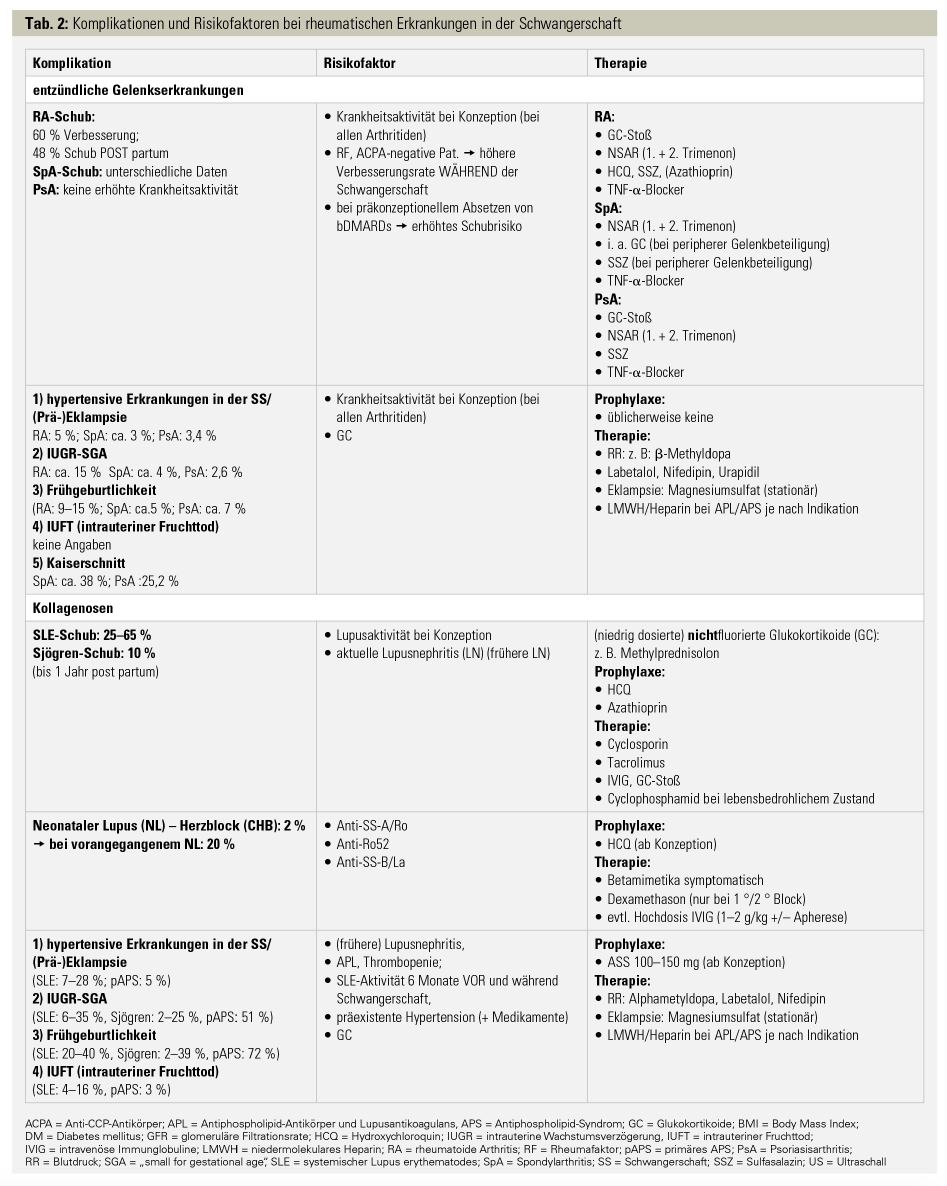
Schub der Erkrankung: In einer rezenten Metaanalyse von schwangeren RA-Patientinnen wurde eine Verbesserung der Grunderkrankung in 60 % der Fälle und eine postpartale Schubrate von 48 % beschrieben.11 Das höchste Risiko für eine hohe Krankheitsaktivität während der Schwangerschaft tragen seropositive Patientinnen, die präkonzeptionell eine hohe RA-Aktivität aufwiesen. Bei Patientinnen mit Spondylarthritiden bleiben Rückenschmerzen und Steifigkeit oft therapiebedürftig, vor allem rund um die 20. Schwangerschaftswoche. Der Verlauf eines SLE in der Schwangerschaft ist hingegen von einem erhöhten Schubrisiko gekennzeichnet, das je nach Studie zwischen 25–65 % liegt. Die Ausprägungen der Schübe vor und während einer Schwangerschaft sind meist milde (Haut, Gelenke, serologische und hämatologische Manifestationen) ähnlich den Schüben VOR der Schwangerschaft, jedoch kann auch eine Lupusnephritis auftreten. Die größten Risikofaktoren für einen Schub sind eine (stattgehabte) Nephritis, eine Thrombopenie und eine erhöhte Aktivität der Erkrankung bei Konzeption und in den Monaten davor. Daher ist die Planung einer Schwangerschaft bei SLE-Patientinnen besonders wichtig. Die Beibehaltung der Therapie mit Hydroxychloroquin während der Schwangerschaft hat gegenüber Schüben eine protektive Wirkung. Die Behandlung eines Schubes besteht aus nichtfluorierten Kortikosteroiden (z. B. Methylprednisolon; so kurz und niedrig dosiert wie möglich), intravenösen Immunglobulinen sowie Calcineurin-Inhibitoren.
Neonataler Lupus (NL): Der neonatale Lupus entsteht durch den diaplazentaren Transport von mütterlichen Anti-SS-A- oder -SS-B-Antikörpern, die sich in den kindlichen Organen ablagern und diese schädigen können. Meist sind die Symptome wie das typische Hautbild, erhöhte Leberwerte und Blutveränderungen reversibel; das gefürchtetste Symptom ist der kongenitale Herzblock (CHB), der meist zwischen der 16. und der 24. Schwangerschaftswoche auftritt. Letztgenannter kann bei 2 % der SS-A- und/oder SS-B-positiven Mütter auftreten (bei vorangegangenem NL: 20 %!), daher sollten engmaschige Echografien des Fötus zumindest von der 16. bis zur 26. Woche durchgeführt werden. Die Einnahme von Hydroxychloroquin (Gabe ab Beginn der Schwangerschaft) senkt das Risiko um bis zu 50 % und sollte bei allen Patientinnen mit SS-A-/SS-B-Antikörpern gegeben werden.
Nichtkrankheitsspezifische Komplikationen
Während bei Patientinnen mit RA ein 1,5- bis 2-fach erhöhtes Risiko für die Entwicklung einer Präeklampsie, für ein niedrigeres Geburtsgewicht und für eine Frühgeburtlichkeit beschrieben wurde, ist das Risiko bei Patientinnen mit SpA nicht erhöht.12 Bei SLE und auch beim APS ist eine erhöhte Mortalität der Mutter und des Kindes sowie ein erhöhtes Risiko für Wachstumsretardierung, Frühgeburtlichkeit und hypertensive Erkrankungen in der Schwangerschaft (z. B. HELLP oder Präeklampsie) gesichert. Prinzipiell kann sich jedoch die Unterscheidung der eben genannten Erkrankungen von einer erhöhten Lupusaktivität manchmal als schwierig erweisen. Als Indikatoren der SLE-Aktivität sind der Anti-dsDNA-Antikörperspiegel und ein pathologisches Sediment ohne Einschränkung brauchbar. Als krankheitsspezifische Risikofaktoren für hypertensive Erkrankungen in der Schwangerschaft sind APL und Nierenfunktionsstörung etabliert. Bei SLE und Patientinnen mit APL wird eine Prophylaxe mit niedrig dosiertem Aspirin empfohlen, bei Vorliegen eines APS sollte eine Therapie mit LMWH gemäß internationalen Empfehlungen erfolgen.2
Betreuung nach der Schwangerschaft
Oft kommt es nach der Schwangerschaft zu einem Schub (insbesondere bei schon stattgehabten Schüben während der Schwangerschaft), weswegen Patientinnen kurz nach Geburt und in den ersten 3 darauffolgenden Monaten rheumatologisch begutachtet werden sollten. Im Allgemeinen kann man Immunsuppressiva, die während der Schwangerschaft zum Einsatz kommen, auch in der Stillzeit einnehmen (Tab. 1). Aufgrund der thrombogenen Situation im Wochenbett ist es besonders wichtig, bei positiven APL die Antikoagulation mit Aspirin und (zumindest) prophylaktischem LMWH während der ersten 3 Monate post partum weiterzuführen.
Resümee: Insgesamt kann heutzutage bei den meisten Patientinnen mit entzündlichen und systemischen rheumatischen Erkrankungen eine erfolgreiche Schwangerschaft erreicht werden. Allerdings ist eine gute Planung der Schwangerschaft und insbesondere bei Kollagenosen eine Begleitung durch ein erfahrenes Ärzteteam aus Gynäkologen, Rheumatologen und Neonatologen wichtig.