Triple-Therapie nach Stentimplantation
Bei etwa 5 bis 10 % der Patienten, die eine orale Antikoagulation (OAK) zur Thromboembolieprophylaxe aufgrund eines nichtvalvulären Vorhofflimmerns einnehmen, besteht nach einer perkutanen Koronarintervention (PCI) im Rahmen eines chronischen Koronarsyndroms (CCS) zusätzlich die Indikation zu einer dualen antithrombozytären Therapie (DAPT).1 Vorhofflimmern ist zudem ein unabhängiger Risikofaktor für die Entstehung eines Myokardinfarktes.2 Das Dilemma besteht in einem hohen Blutungsrisiko bei kombinierter dreifacher antithrombotischer Therapie (Triple-Therapie, TAT). Die alleinige Einnahme einer DAPT nach PCI bietet keinen ausreichenden Schutz zur Schlaganfallprävention, während die OAK als Sekundärprophylaxe nach Stentimplantation bzw. zur Vermeidung der gefürchteten Stentthrombose nicht geeignet ist. Eine evidenzbasierte Empfehlung zur Einnahmedauer der risikoreichen TAT ist laufender Gegenstand der klinischen Forschung und sollte sich immer auch nach dem individuellen Blutungs- bzw. Thromboembolierisikos des Patienten richten. Die aktuellen Therapieempfehlungen sind in den Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) verankert.3, 4
Vergleich verschiedener antithrombotischer Therapien
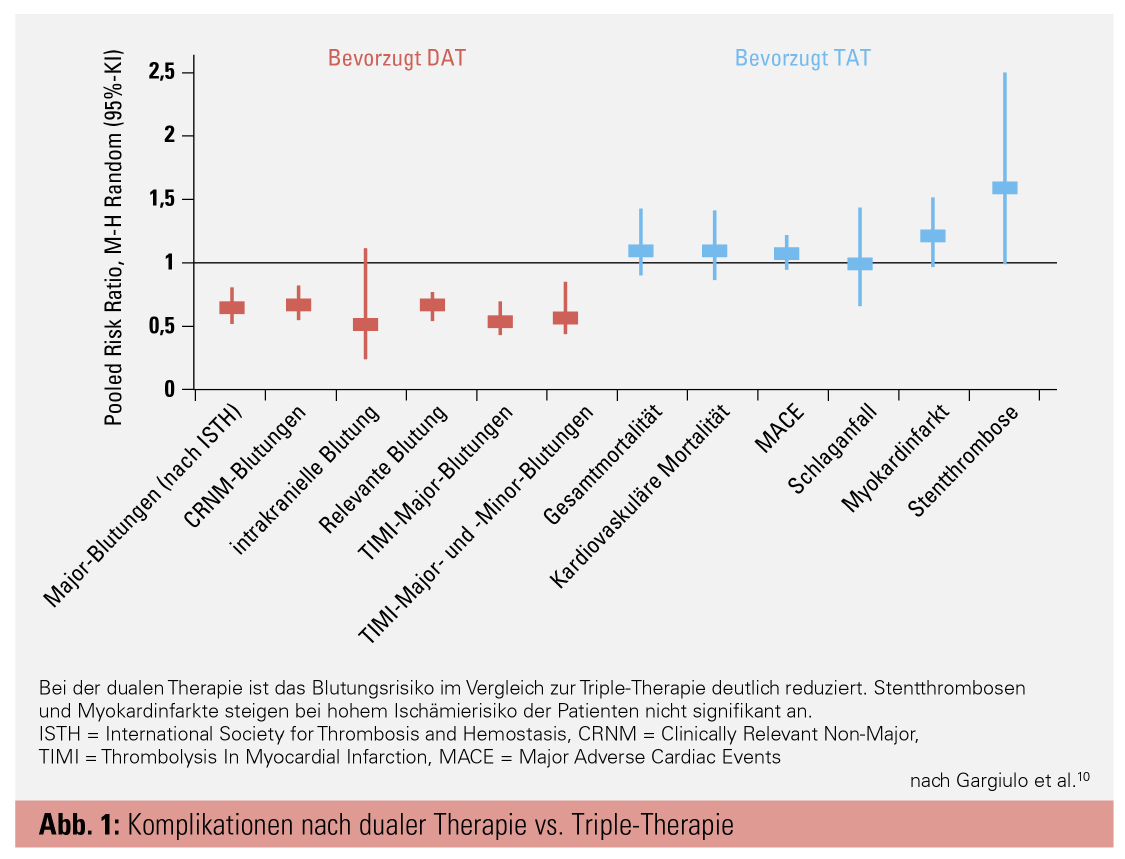
Verschiedene Strategien einer kombinierten antithrombotischen Therapie für die beschriebene Patientengruppe wurden in den letzten Jahren in vier großen Studien untersucht: RE-DUAL PCI5, PIONEER AF-PCI6, AUGUSTUS7 und ENTRUST-AF PCI8. Die möglichen Kombinationen von Vitamin-K-Antagonisten (VKA) oder neuen oralen Antikoagulanzien (NOAK) mit einem P2Y12-Inhibitor (meist Clopidogrel) bzw. einer DAPT wurden hinsichtlich ihres Blutungs- und Thromboembolierisikos verglichen. Primäre Endpunkte waren z. B. das Auftreten intrakranieller oder schwerer Blutungen sowie Rehospitalisierungen, Myokardinfarkte bzw. Stentthrombosen und Schlaganfälle sowie schwere kardiale Ereignisse und die allgemeine Mortalität. Metaanalysen zeigten, dass die Kombination aus einem NOAK und einem P2Y12-Inhibitor in allen vier Studien das beste Nutzen-Risiko-Verhältnis aufwies.9–13 Dabei war das Blutungsrisiko im Vergleich zur TAT, aber auch im Vergleich zu einer Kombination mit einem VKA deutlich reduziert, vor allem, was intrakranielle und schwere Blutungen betrifft. Die Häufigkeit von schweren kardialen Ereignissen (MACE), Todesfällen oder Schlaganfällen war bei allen Therapieregimen in etwa gleich hoch. Nur das Auftreten von Stentthrombosen und Myokardinfarkten zeigte sich bei dualer Therapie (DAT) im Gegensatz zur TAT tendenziell erhöht (Abb. 1).10
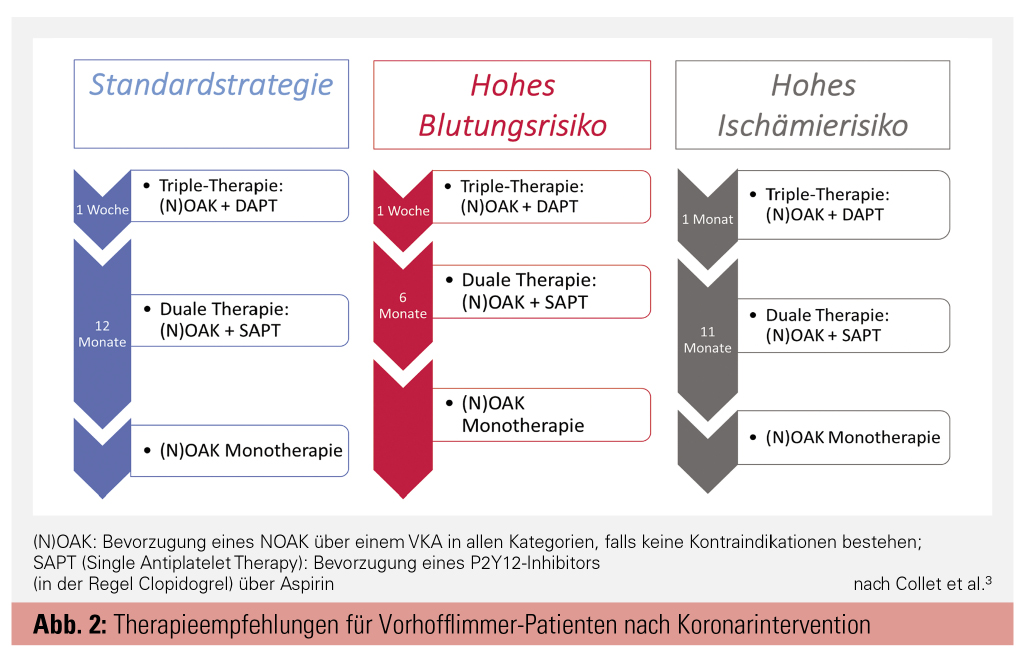
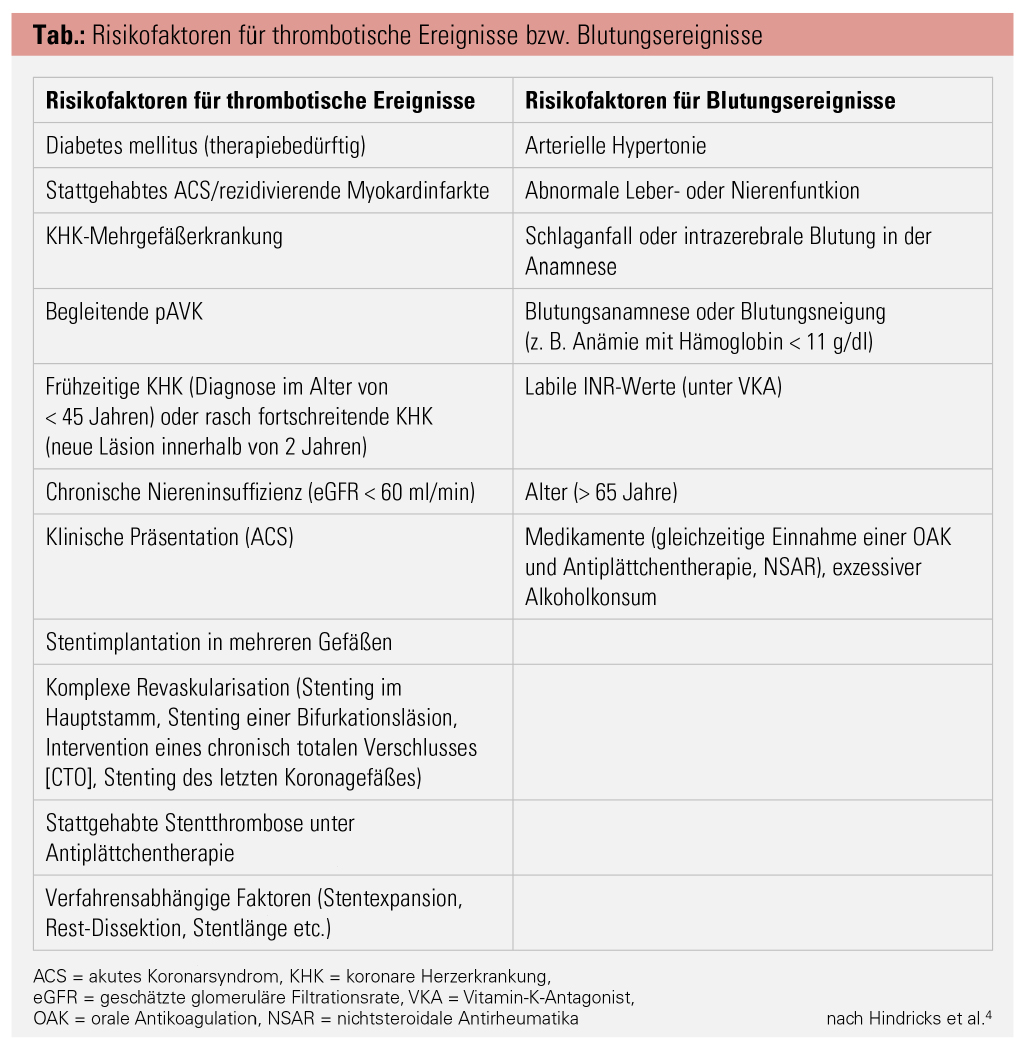
In den aktuellen Vorhofflimmern-Leitlinien empfiehlt die ESC dementsprechend als Standardstrategie für die Mehrheit der Patienten eine TAT für eine Woche, gefolgt von einer DAT bestehend aus einem NOAK und einem P2Y12-Inhibitor (vornehmlich Clopidogrel) für zwölf Monate nach einem akuten Koronarsyndrom (ACS) bzw. für sechs Monate bei erhöhter Blutungsneigung des Patienten oder nach einer Intervention im Rahmen eines CCS.3, 4 Kommt es in dieser Zeit nicht zu einem erneuten Ereignis, kann danach eine Monotherapie mit einem NOAK in voller Dosierung eingenommen werden. Je nach Risikoprofil des Patienten soll dieses Schema durch die behandelnden Ärzte adaptiert werden (Abb. 2).3 Bei hohem Ischämierisiko, d. h. hohem Risiko für eine Stentthrombose, einen Re-Infarkt oder Schlaganfall, abhängig von den bestehenden kardiovaskulären Risikofaktoren des Patienten und den Eigenschaften bzw. der Anzahl der implantierten Stents, kann die TAT auf einen Monat ausgeweitet werden. Durch die Verwendung von Drug-eluting Stents (DES) der neueren Generation kann das Risiko für eine Stentthrombose zusätzlich reduziert werden.14 Anhaltspunkte für die Entscheidungsfindung sollten zum einen die bekannten Punktesysteme wie der CHA2DS2-VASc- oder HAS-BLED-Score sein, zum anderen stellt die ESC-Leitlinie einen ausführlichen Katalog mit relevanten Faktoren für ein erhöhtes Blutungs- bzw. Ischämierisiko bereit (Tab.).4
Maßnahmen zur Reduktion von Komplikationen
Blutungskomplikationen im Rahmen der Koronarintervention sind mit einer längeren Hospitalisierung sowie schlechterem Outcome verbunden, vor allem bei der Behandlung von Patienten mit einem ACS.15, 16 Generell können diese Komplikationen durch folgende Maßnahmen verhindert bzw. reduziert werden:
Für die Intervention sollte, wenn möglich, ein transradialer Zugang bevorzugt werden. Die Arteria radialis ist kleiner und somit besser komprimierbar als die große Femoralarterie, die schwere retroperitoneale Blutungen hervorbringen kann.17 Bei Einnahme jeglicher antithrombotischer Kombinationstherapie wird zusätzlich ein Protonenpumpeninhibitor (PPI) empfohlen, woran besonders bei älteren Patienten und bei bekannter gastrointestinaler Refluxerkrankung oder regelmäßigem Alkoholkonsum gedacht werden sollte. Zu beachten ist, dass bestimmte PPI die Wirkung des Isoenzyms CYP2C19 inhibieren, das normalerweise an der Umwandlung der „Pro-Drug“ Clopidogrel in seine aktive Form beteiligt ist. Aufgrund dieser Interaktion kann es bei gleichzeitiger Einnahme von Clopidogrel und einem PPI zu einer Abschwächung der antithrombotischen Wirkung kommen, die auch zu einer Zunahme kardiovaskulärer Ereignisse führen könnte. Obwohl dieser Zusammenhang letztendlich nicht sicher bewiesen ist, sollte bei der Wahl des PPI Pantoprazol bevorzugt und sollten Omeprazol bzw. Esomeprazol gemieden werden.18, 19
Gegenmittel bei Blutung unter TAT
Sollte es unter der TAT zu einer lebensbedrohlichen Blutung kommen, stehen für die unterschiedlichen Substanzen verschiedene Gegenmittel bereit. Idarucizumab ist als Antidot für Dabigatran bereits seit 2016 auf dem Markt. Für die beiden Faktor-Xa-Inhibitoren Apixaban und Rivaroxaban gibt es nun seit 2019 eine Zulassung für das rekombinante Protein Andexanet alfa, das die beiden Wirkstoffe im Blut bindet und so die Gerinnungskaskade wieder aktiviert. Für den Faktor-Xa-Hemmer Edoxaban sind entsprechende Untersuchungen im Gange.20 Sollte ein spezifisches Antidot im Notfall nicht verfügbar sein, empfiehlt die ESC die Gabe von (aktivierten) Prothrombinkomplex-Konzentraten in einer Dosierung von 50 U/kg.21 Auch für P2Y12-Inhibitoren wird es in Zukunft Konzepte der Antagonisierung geben. Auf der Jahrestagung des „American College of Cardiology“ (ACC) wurde 2019 ein Antikörperfragment vorgestellt, das die Ticagrelor-Wirkung innerhalb von fünf Minuten aufheben kann.22 Eine entsprechende Phase-III-Studie ist derzeit international am Laufen.23
- Kralev S et al., PLoS One 2011; 6(9):e24964
- Chao T-F et al., Heart Rhythm 2014; 11(11):1941–7
- Collet J-P et al., Eur Heart J 2021; 42(14):1289–367
- Hindricks G et al., Eur Heart J 2021; 42(5):373–498
- Cannon CP et al., N Engl J Med 2017; 377(16):1513–24
- Gibson CM et al., N Engl J Med 2016; 375(25):2423–34
- Lopes RD et al., N Engl J Med 2019; 380(16):1509–24
- Vranckx P et al., Lancet 2019; 394(10206):1335–43
- Huber K et al., Journal für Kardiologie 2020; 27(1):3–16
- Gargiulo G et al., Eur Heart J 2019; 40(46):3757–67
- Golwala HB et al., Eur Heart J 2018; 39(19):1726–1735a
- Lopes RD et al., JAMA Cardiol 2019; 4(8):747–55
- Potpara TS et al., Europace 2020; 22(1):33–46
- Kufner S et al., Circulation 2019; 139(3):325–33
- Fuchs S et al., Cardiovasc Revasc Med 2009; 10(2):88–93
- Rao SV et al., Am J Cardiol 2005; 96(9):1200–6
- Brasselet C et al., Heart 2007; 93(12):1556–61
- Frelinger AL et al., J Am Coll Cardiol 2012; 59(14):1304–11
- Abraham NS et al., J Am Coll Cardiol 2010; 56(24):2051–66
- Benz AP et al., Stroke 2021; 52(Suppl 1): Abstract P3
- Steffel J et al., Eur Heart J 2018; 39(16):1330–93
- Bhatt DL et al., N Engl J Med 2019; 380(19):1825–33
- Bhatt DL, ClinicalTrials.gov Identifier: NCT04286438