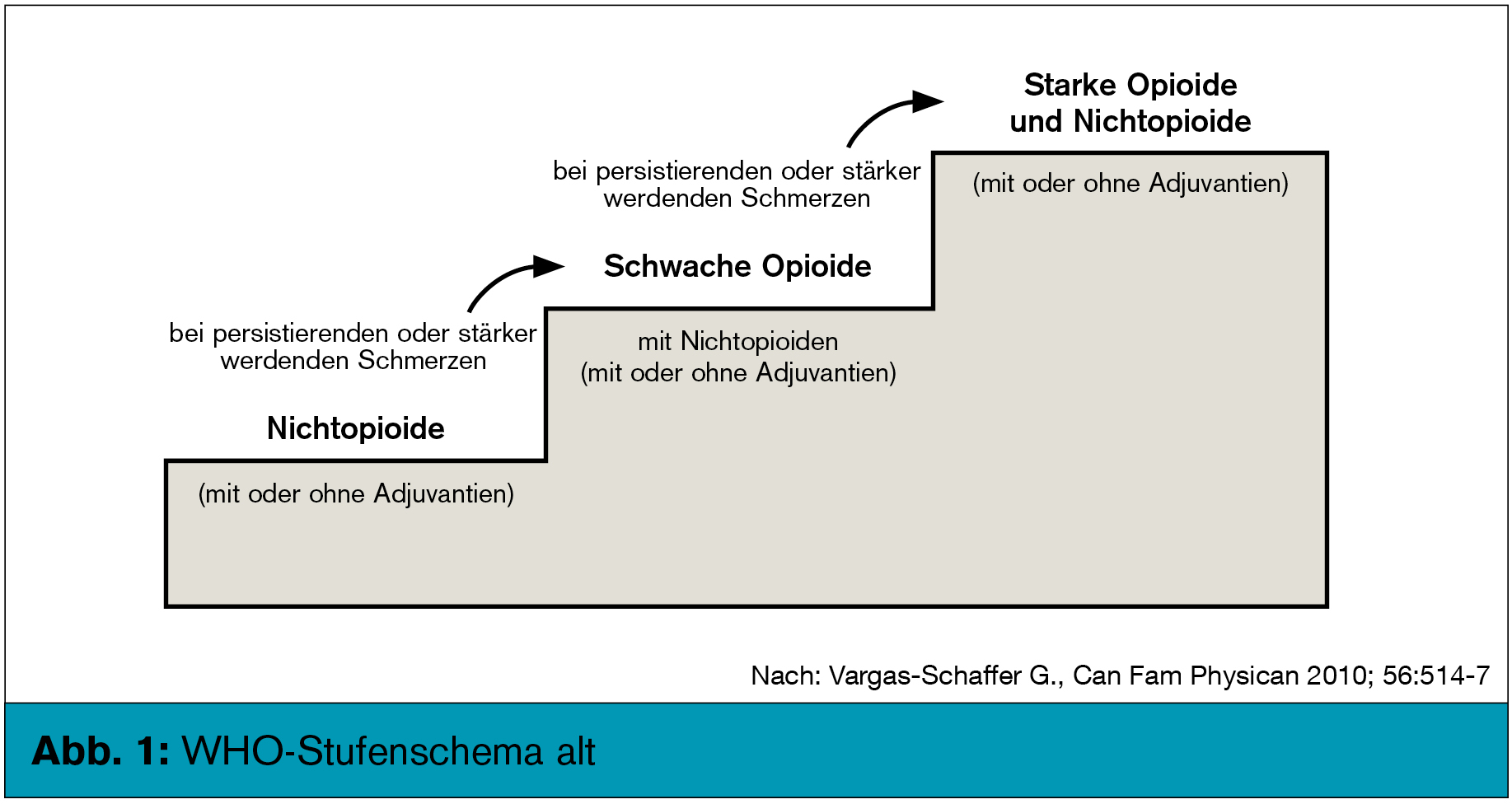
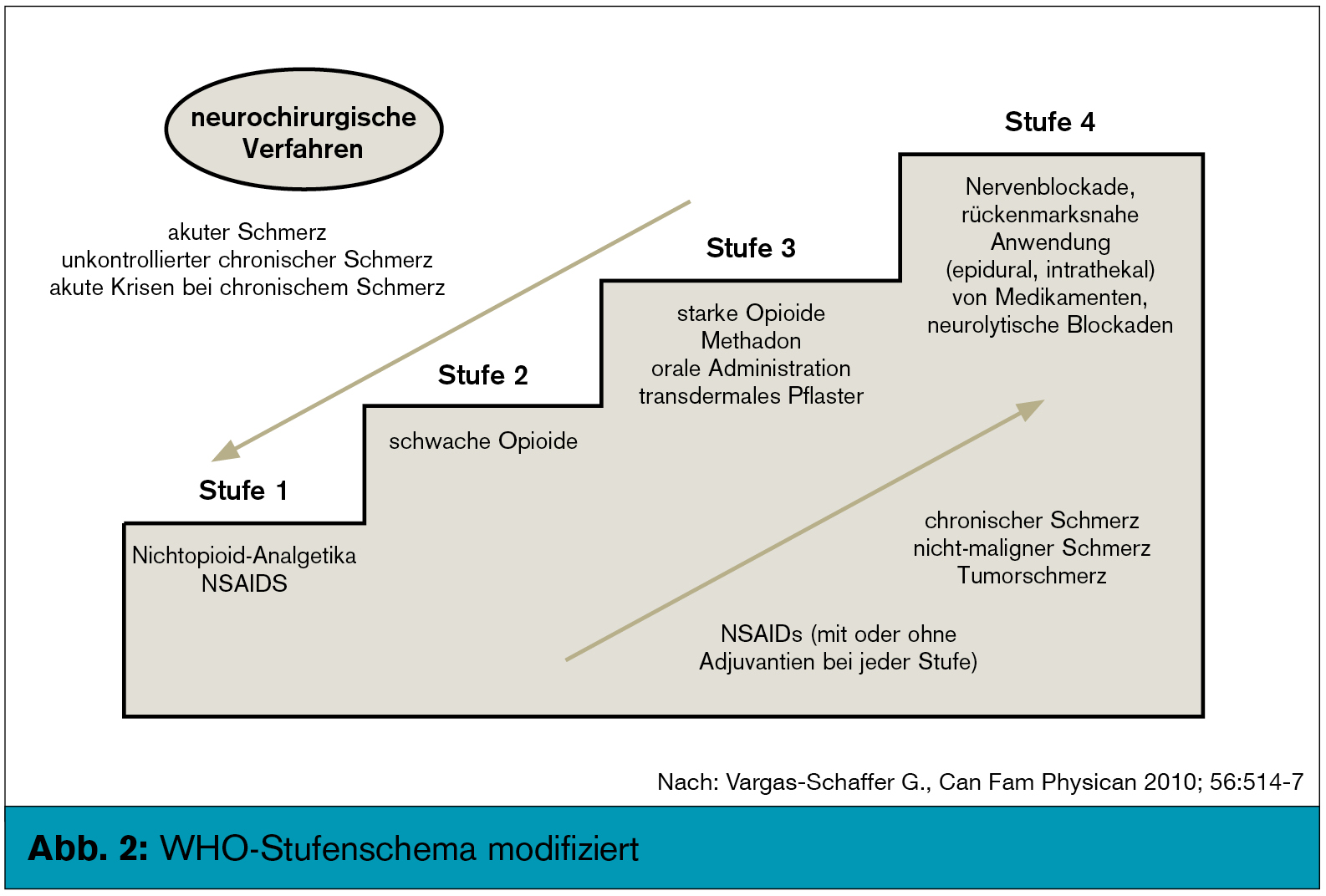
WHO-Stufenschema – (noch) State of the Art
Valeberg B. T. et al.1 konnten in einer im Jahr 2008 im „European Journal of Pain“ publizierten Studie zeigen, dass von den befragten Tumorpatienten 50 % an Schmerzen litten. 53 % der Patienten hatten Schmerzen in mehr als einer Lokalisation (im Mittel 4) und verschiedene Schmerzarten (Nozizeptorschmerz, neuropathischer Schmerz, „mixed pain“). Patienten, die unter Tumorschmerzen litten, hatten eine höhere Verschreibung von Opioiden als Patienten mit Nicht-Tumorschmerz.
EPIC-Survey: 2007 wurde der European Pain in Cancer (EPIC) Survey, eine Befragung der European Association of Palliative Care, publiziert, in der europaweit (inkl. Israel) Daten erfasst wurden. Im Schnitt litten 56 % der Patienten unter Schmerzen. Von diesen hatten 21 % der Patienten mittelstarke bis starke Schmerzen und litten täglich darunter. Der mittlere Schmerzscore lag bei 6,38 auf der 10-teiligen Schmerzskala. Es gab europaweit Unterschiede. Schweden und Norwegen waren die Länder mit dem niedrigsten Schmerzniveau. Israel ist das Land mit dem höchsten. Auch die Verschreibung von Opioiden war unterschiedlich. Frankreich, Rumänien und England waren die Länder, in denen schwache Opioide öfters verschrieben werden. Italien, Schweiz und Schweden waren die Länder, in denen die starken Opioide mehr zur Anwendung kamen.
Erfolgt die Einstellung des Basisschmerzes insuffizient, sind die Patienten auch von Durchbruchschmerzen betroffen. 5 % der Befragten hatten immer Durchbruchschmerzen, 14 % mehrmals täglich und 10 % 1-mal täglich. Insgesamt hatten 63 % der Patienten Durchbruchschmerzen. 52 % der Betroffenen mit Durchbruchschmerzen sagten, dass ihre Medikation nicht adäquat sei, um den Durchbruchschmerz zu kontrollieren.
2005 publizierte die Arbeitsgruppe um H.-G. Kress in der Zeitschrift „Der Schmerz“2 eine Arbeit über den Einsatz der WHO-Leitlinien für die Tumorschmerztherapie vor Zuweisung in eine Schmerzklinik und konnten zeigen, dass die Qualität der Schmerztherapie durch strikte Einhaltung der Leitlinien deutlich verbessert werden kann. Die inadäquate Schmerzlinderung konnte in dieser Studie mittels einer erfolgreichen Therapie, d. h., Wechsel der Therapiestufe, der Anwendung von Adjuvantien und der insgesamt konsequenten Dosissteigerung der Opioide verbessert werden. 28 % der Patienten hatten eine Steigerung um eine Stufe beim WHO-Stufenschema. Die Bedarfsmedikation wurde in der Untersuchung von 8 % auf 84 % gesteigert, als Problem erwiesen sich die neuropathischen Schmerzen.
Empfehlungen der WHO zur Tumorschmerztherapie
Die European Association for Palliative Care (EAPC) publizierte die ersten Guidelines über die Verwendung von Morphin und alternativen Opioiden bei Tumorschmerztherapie 1996 und publizierte das Update 20013.
2012 erfolgte eine neuerliche Publikation über„The use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC“. Es wurde ebenfalls die Einteilung Stufe-2-Opioide und Stufe-3-Opioide verwendetet, um zwischen äquivalent niedriger analgetischer Potenz (Codein und Tramadol) und einem Medikament mit hoher analgetischer Potenz wie Morphin und weiteren Medikamenten zu differenzieren.
In den EAPC-Empfehlungen 2001 wird empfohlen: das Opioid erster Wahl ist Morphin, der optimale Applikationsweg ist oral, Dosistitration (nicht-retardiert) und weiters nicht-retardiertes Morphin für Durchbruchschmerzen. Die Dosisänderung sollte nicht öfter als alle 48 Stunden erfolgen. Patienten mit nicht-retardiertem Morphin sollten die Abenddosis verdoppeln. Es sollte retardiertes Morphin mit 12/24 Stunden-Wirksamkeit verwendet werden, die alternative Applikation wäre subkutan. Die relative Potenz von oralem Morphin zu subkutanem Morphin beträgt 1:2 bzw. 1:3.
Der bevorzugte Applikationsweg neben der oralen Therapie stellt die subkutane Therapie dar. Die i. v. Verabreichung ist ebenfalls eine Möglichkeit ebenso wie orales, transmukosales, nasales Fentanyl für Durchbruchschmerz. Bei intolerablen Nebenwirkungen sollte man Alternativen suchen, wie Hydromorphon, Oxycodon, Methadon oder transdermales Fentanyl bei stabilem Opioidverbrauch.
Patient behandelt nach Schmerzstärke: Der leichte Schmerz auf der numerischen Rating Scale (NRS) 1–4 kann mit Nichtopioid-Analgetika wie Acetaminophen (Paracetamol) oder anderen nicht-steroidalen Antirheumatika, der mittelstarke Schmerz mit Analgetika der WHO-Stufe 2 behandelt werden. Der Schmerz zwischen NRS 5 und 7 kann mit einer Kombination von Acetaminophen, Antirheumatika und schwachen Opioide, Codein, Dihydrocodein, Tramadol und Propoxyphen oder starken Opioiden mit niedriger Dosierung wie Morphin oder Oxycodon behandelt werden. Bei starken Schmerzen ist die WHO-Stufe 3 indiziert. Morphin ist bei starken Schmerzen (NRS 8–10) die am meisten verwendete Substanz. Die orale Applikation ist die bevorzugte Route. Wird parenterales Morphin verabreicht, benötigt man ein Drittel der oralen Medikation. Hydromorphon oder Oxycodon sind effektiv als Alternativen zu oralem Morphin. Transdermales Fentanyl oder transdermales Buprenorphin sind für Patienten, die einen stabilen Opioidbedarf haben, reserviert.
Ist die WHO-Stufe 2 nötig?
D. Thapa et al. publizierten im „Journal of Anaesthesiology Clinical Pharmacology“4 folgende Zusammenfassung: Das WHO-Stufenschema wurde 1986 für die Therapie von Karzinomschmerzen eingeführt und zeichnet sich durch Einfachheit und Klarheit aus. Es kann aber wegen der Effektivität und wegen des Einschlusses der schwachen Opiate und der nicht klar herausgearbeiteten Interventionstherapien kritisiert werden.
Foley publizierte in „Palliative Medicine“ die Arbeit „How well is cancer Pain treated?“5. 25 % der Patienten waren unterbehandelt, d. h. die Unterbehandlung bei Karzinomschmerz ist noch ein großes Problem. Solange diese Unterbehandlung bei Tumorschmerz besteht, brauchen wir das WHO-Stufenschema, obwohl man die Frage stellen kann: „Braucht man die zweite Stufe?“ Das Dreistufenschema ist ein Standardbehandlungsinstrument bei Karzinompatienten. Tramadol ist eine effektive Substanz und wird häufig eingesetzt. Der Therapieerfolg auf dem WHO-Stufenschema liegt bei 70 und 80 %. Die zweite Stufe ist deswegen auch sinnvoll, da Tramadol nicht suchtmittelrezeptpflichtig ist und daher eine breitere Anwendung bringt als die dritte Stufe. Es ist auch anzumerken, dass Tramadol auf der zweiten Stufe eine effektive Medikation darstellt, da 600 mg Tramadol umgerechnet 120 mg Morphin oral entspricht. Wichtig ist die Durchführung der Kombinationen, d. h. die verschiedenen Stufen der Opioide mit Nichtopioid-Analgetika bzw. mit Adjuvantien bei neuropathischen Schmerz kombiniert, und neben der retardierten Anwendung der Opioide dem Patienten auch die Bedarfsmedikation für Durchbruchschmerzen ausreichend zur Verfügung zu stellen. Sind Nebenwirkungen vorhanden, dann muss man diese therapieren bzw. kann man an eine Opioidrotation denken.
Die Frage „WHO-Stufenschema – (noch) State of the Art“ lässt sich so beantworten: Solange Tumorpatienten noch unterbehandelt sind und Schmerzen haben, was den Ruhe- als auch den Durchbruchschmerz betrifft, ist das WHO-Stufenschema als didaktisches Instrument nicht wegzudenken. Man sollte es aber gemäß einer Arbeit von G. Vargas-Schaffer et al.6 modifizieren (Abb. 1 und 2). Wie Abb. 2 zeigt, sollten die Stufe 2 und 3 (also die schwachen und starken Opioide) mit den nicht-steroidalen Antirheumatika und bei neuropathischen Schmerzen mit den Adjuvantien (Antikonvulsiva, Antidepressiva) kombiniert werden. Man benötigt auch die vierte Stufe, d. h. man muss auch an invasive Methoden (Nervenblockaden, rückenmarksnahe Anwendung [epidural, intrathekal] von Medikamenten, neurolytische Blockaden) denken, wenn diese den Tumorpatienten eine suffiziente Schmerzlinderung bringen. Wichtig: Erzielen diese invasiven bzw. neurolytischen Methoden einen Erfolg, müssen die systemischen Analgetika wieder reduziert werden.