Neue Wege zur Remission
Die Polymyalgia rheumatica (PMR) zählt zu den häufigsten entzündlichen rheumatischen Erkrankungen im Alter; sie tritt etwa ab dem 50. Lebensjahr auf, wobei Frauen ca. 3-mal so häufig wie Männer betroffen sind. Die PMR wird heute gemeinsam mit der Riesenzellarteriitis (RZA) als Spektrumserkrankung gesehen; etwa 20% der Patient:innen mit PMR haben auch eine RZA, und ca. jede:r Zweite mit RZA weist auch Symptome der PMR auf. Zusätzlich finden sich bei 20 % der PMR-Patient:innen ohne RZA-typische Beschwerden trotzdem Zeichen einer Großgefäßentzündung in bildgebenden Verfahren.
Klinisches Bild und Diagnose
Charakteristisch für die PMR sind neu aufgetretene Schmerzen im Schulter- und Beckengürtelbereich: Beidseitige Schmerzen vom Nacken ausstrahlend über die Schultern und den dorsalen Oberarm bis zum Ellenbogen sowie vom Gesäß über die dorsalen Oberschenkel bis in die Kniekehlen reichend, die das Heben der Arme oder das Aufstehen aus dem Sitzen erschweren. Die Schmerzen gehen mit einer ausgeprägten Morgensteifigkeit, die sich teilweise über den ganzen Tag nicht zurückbildet, einher. Unspezifische Allgemeinsymptome wie Fieber, Abgeschlagenheit, Nachtschweiß, Appetitlosigkeit und Gewichtsverlust können hinzukommen. Aufgrund der unspezifischen klinischen Präsentation ist die Diagnosestellung oftmals eine Herausforderung.
Im Labor zeigen sich in der Regel erhöhte Entzündungsparameter (BSG, CRP), in der Bildgebung können Bursitiden und Tenosynovitiden im Bereich des Schulter- und Hüftgürtels vorkommen. Zu den wichtigsten Differenzialdiagnosen zählen die „late onset“ rheumatoide Arthritis und die Kalziumpyrophosphat-Arthropathie, für die vor allem das Vorkommen von Arthritiden hinweisend ist. Weitere Differenzialdiagnosen sind Arthrosen und Fibromyalgie, medikamenteninduzierte Muskelschmerzen (z. B. zu schnelles Absetzen von Antidepressiva), Muskelschmerzen bei Schilddrüsenerkrankungen, Infekte und Neoplasien. Zur adäquaten Diagnosestellung und um unnötige Therapien mit Glukokortikoiden zu vermeiden, sollte jeder Verdacht auf eine PMR bei Fachärzt:innen für Rheumatologie abgeklärt werden.
Medikamentöse Therapie der PMR
Glukokortikoide. Glukokortikoide spielen nach wie vor eine zentrale Rolle in der Therapie der PMR (Tab.). Nach Diagnosestellung sollte unverzüglich eine systemische Glukokortikoidtherapie begonnen werden. Die Initialdosis beträgt zwischen 15 und 25 mg orales Prednison-Äquivalent täglich. Bei guter klinischer und laborchemischer Besserung wird die Dosis schrittweise reduziert (Tapering), zunächst bis etwa 10 mg/Tag innerhalb von 4–8 Wochen, danach langsamer in 1-mg-Schritten, um ein Rezidiv zu vermeiden. Ziel ist eine Remission oder zumindest niedrige Krankheitsaktivität bei möglichst niedriger Glukokortikoidbelastung. Tritt ein Rezidiv auf, wird die Dosis vorübergehend auf das zuvor wirksame Niveau erhöht und erneut ausgeschlichen.
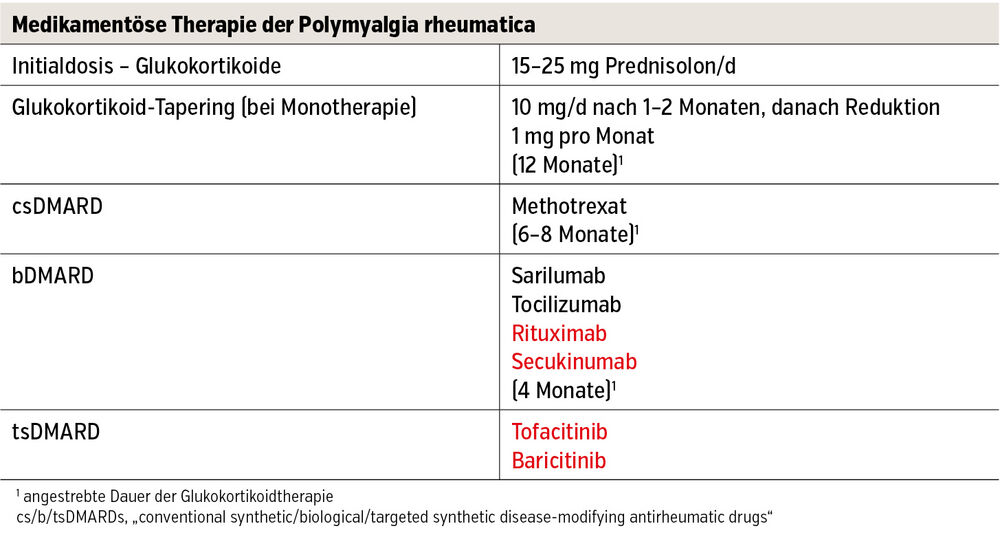
Tab.: Aktueller Standard of Care in der Behandlung der PMR (schwarz) plus potenzielle zukünftige Therapieoptionen (rot)
In den letzten Jahren rückten Strategien wie kürzere Tapering-Schemata oder Kombinationstherapien mit neuen Substanzklassen in den Fokus, welche die Dosis und Therapiedauer der Glukokortikoide reduzieren, um damit assoziierte Nebenwirkungen zu vermeiden. Als Monotherapie sollten Glukokortikoide höchstens für ein Jahr verabreicht werden; in Kombination mit Biologika (max. 16 Wochen) oder Methotrexat (6–8 Monate) ist eine kürzere geplante Verabreichungsdauer angezeigt.
IL-6-Inhibitoren. Bei Patient:innen mit Rezidiven beziehungsweise einem hohen Risiko für glukokortikoidassoziierte Nebenwirkungen (z. B. Diabetes mellitus II, Osteoporose, koronare Herzerkrankung) sollte frühzeitig eine glukokortikoidsparende Therapie erwogen werden. IL-6-Inhibitoren stellen die bisher beststudierte Therapie für diese Indikation dar: In einer Studie mit 36 neudiagnostizierten PMR-Patient:innen erreichten 63 % unter wöchentlicher Gabe von Tocilizumab eine anhaltende glukokortikoidfreie Remission nach 16 Wochen, gegenüber 12 % unter Placebo. Auch bei PMR-Patient:innen mit Zeichen einer Reaktivierung während des Taperings von Glukokortikoiden führte die Kombination von Tocilizumab und Glukokortikoiden zu signifikant besseren Krankheitsaktivitätsscores nach 24 Wochen (67 % vs. 31 %). In einer Phase-III-Studie zeigte Sarilumab bei rezidivierender PMR nach einem Jahr höhere Remissionsraten (28 % vs. 10 %) und eine geringere kumulative Glukokortikoiddosis (median 777mg vs. 2.044 mg).
Methotrexat. In der aktualisierten S2e-Leitlinie wurde Methotrexat neu eingeordnet: Galt es vorher noch als glukokortikoidsparendes Medikament der ersten Wahl, wird es mittlerweile nur noch als Alternative zur IL-6-Blockade empfohlen, aufgrund mangelnder Evidenz. Eine Studie, welche die Rolle von Methotrexat als Erhaltungstherapie nach Induktionstherapie mit Glukokortikoiden und Il-6-Inhibitoren untersucht, ist derzeit am Laufen.
Januskinase-Inhibitoren. Eine chinesische Phase-II-Studie mit 76 PMR-Patient:innen konnte zeigen, dass unter Tofacitinib-Monotherapie die Zahl der Remissionen ähnlich war wie mit Glukokortikoiden. Ähnlich positive Ergebnisse wurden auch in einer rezenten französischen randomisiert kontrollierten Studie für den Januskinase-Inhibitor Baricitinib berichtet.
Rituximab. Eine randomisierte Studie mit insgesamt 47 Patient:innen zeigte, dass eine einmalige Infusion von 1.000 mg Rituximab (Antikörper gegen B-Zellen) bei neu diagnostizierter oder rezidivierender PMR zu deutlich höheren Remissionsraten und geringerer Glukokortikoid-Kumulativdosis nach 52 Wochen im Vergleich zu Placebo führt. Aufgrund der kurzen Studiendauer und des geringen Stichprobenumfanges sind aber weitere Studien notwendig, um diese Ergebnisse zu bestätigen, insbesondere da die B-Zelle im derzeitigen pathophysiologischen Modell der PMR eine untergeordnete Rolle spielt.
Begleitende Maßnahmen
Begleitend sind nichtmedikamentöse Maßnahmen wie körperliche Aktivität und gezielte Übungen zur Erhaltung von Muskelkraft und Mobilität, Sturzprävention sowie Basismaßnahmen zum Knochenschutz (Vitamin D, Kalzium-Supplementierung) sowie die Evaluierung einer antiresorptiven Therapie bei glukokortikoidinduzierter Osteoporose zu nennen. Regelmäßige klinische und laborchemische Kontrollen sind essenziell, um Krankheitsaktivität und Nebenwirkungen der Therapie frühzeitig zu erkennen und das weitere Vorgehen individuell anzupassen.
























































































