Genitoanalwarzen – Genitalwarzen und ihre Differentialdiagnose
Klinik und Epidemiologie
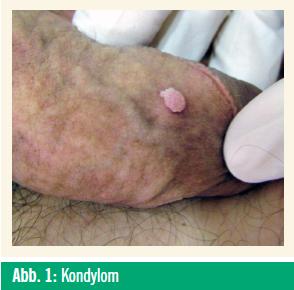
Condylomata acuminata sind benigne, exophytisch wachsende, mehr oder weniger pigmentierte Plattenepithelneoplasien, die einzeln oder multipel auftreten, sich beetförmig ausdehnen und zu blumenkohlartigen Tumoren anwachsen können. Prädilektionsstelle ist der Genitoanalbereich. Bei etwa 20 % der Frauen mit vulvären Genitalwarzen ist auch der Analkanal betroffen. Ausschließlich (peri-) anale Kondylome sieht man gelegentlich bei MSM (men having sex with men), proximal der Linea dentata sind Kondylome extrem selten. Auch an der Mundschleimhaut sowie selten an anderen extragenitalen Lokalisationen können kondylomähnliche, HPV-assoziierte Ver ände rungen auftreten.
Kondylome können Monate bis Jahre bestehen, sich weiter ausbreiten oder auch spontan abheilen. Sehr selten können aus lange bestehenden Genitalwarzen Karzinome entstehen (Buschke-Löwenstein- Tumor).
Laut einer großen skandinavischen Studie leiden 10 % aller Frauen bis zu ihrem 45. Lebensjahr mindestens einmal an genitoanalen Warzen. Männer und Frauen sind etwa gleich häufig betroffen, der Altersgipfel liegt bei 20–24 Jahren. Die Transmissionsrate zwischen Sexualpartnern ist sehr hoch und liegt etwa bei 65 %, der Gebrauch von Kondomen reduziert das Infektionsrisiko um etwa 60– 70 %. Die Inkubationszeit genitoanaler Warzen beträgt mindestens 4 Wochen bis zu vielen Monaten.
Die latente HPV-Infektion mit alleinigem Nachweis der viralen DNA ohne klinische Symptomatik findet sich bei 20- bis 25-jährigen Frauen mit einer Prävalenz von 15–20 % am häufigsten und sinkt mit zunehmendem Lebensalter.
Der Anteil von HPV-Antikörper-positiven Personen wird auf 60 % der Bevölkerung geschätzt. Allerdings erreicht die Sensitivität der Serodiagnostik selbst bei HPVDNA-positiven Personen nur etwa 50– 60 %. Da im Rahmen der HPV-Infektion keine virämische Phase vorliegt, ist die Antikörperantwort nur sehr schwach ausgeprägt. Die Immunogenität der HPV-Impfung ist bedeutend stärker als die der natürlichen Infektion.
Humane Papillomaviren (HPV)
Die virale Genese von Warzen wurde bereits Anfang des 20. Jahrhunderts erkannt. 1976 wurde von einer Gruppe um Harald zur Hausen erstmals HPV aus einer Hautwarze kloniert, 1980 HPV-6 aus einer Genitalwarze.
HP-Viren sind doppelsträngige DNA-Viren aus der Familie der Papovaviridae. Schleimhaut-HPV-Typen werden gemäß ihrem Potenzial, Neoplasien zu verursachen, in 2 Untergruppen unterteilt: die Low-Risk-Gruppe (vor allem HPV-Typ 6 und 11, die in 90 % aller Genitalwarzen nachgewiesen werden können, aber auch 40, 42, 43, 44/55) und die High-Risk-Gruppe (vor allem HPV-Typ 16 und 18 sowie 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 70, 73, 82), die mit anogenitalen sowie oralen Karzinomen assoziiert ist.
Die Übertragung der HP-Viren erfolgt vor allem durch Geschlechtsverkehr, sodass die Infektion als Sexually Transmitted Disease (STD) zu werten ist. Dementsprechend ist bei der Diagnose von Genitalwarzen auch nach anderen STDs zu screenen. Im Rahmen von HIV-Infektionen treten gehäuft anogenitale Warzen auf.
Aber auch Schmierinfektionen sowie vertikale Transmission im Rahmen des Geburtsaktes kommen vor. Kondylome in der Genitalregion eines Kindes sind daher Indiz, aber kein Beweis für sexuellen Missbrauch. In einer groß angelegten Studie an Kindern mit Genitoanalwarzen zeigten INGRAM et al., dass 43 % dieser Kinder sexuell missbraucht worden sind.
Diagnose
Die Diagnose „Condylomata acuminata“ wird meist klinisch gestellt. Subklinische HPV-Infektionen können mittels Essigsäure-Test (Betupfen der Läsion mit 3–5%iger Essigsäure) sichtbar gemacht werden.
Bei unklarer klinischer Diagnose sowie besonders großen oder suspekten Läsionen und bei immunsupprimierten Patienten sollte eine weiterführende Diagnostik angestrebt werden. Neben der Histologie stehen hier vor allem HPVNachweisverfahren zur Verfügung.
Mittels Hybrid-Capture-System wird HPVDNA detektiert. Mit den kommerziell erhältlichen Tests können 18 HPV-Typen nachgewiesen werden. Durch die Verwendung von 2 verschiedenen Sondensystemen erfolgt eine Differenzierung in die beiden Gruppen der HPV-High-Risk- bzw. HPV-Low-Risk-Typen. Bei Läsionen mit hoher Viruslast besitzt der Test eine Sensitivität von bis zu 97 %.
Der typenspezifische HPV-Nachweis erfolgt mittels Amplifizierungsverfahren. Die Sensitivität dieser Methoden ist deutlich höher.
Differentialdiagnose
Der Kenntnis der Differentialdiagnosen kommt große Bedeutung zu, einerseits um eine invasive Überbehandlung völlig harmloser Effloreszenzen zu vermeiden und andererseits um Fehlbehandlungen mit weit reichenden Folgen auszuschließen.
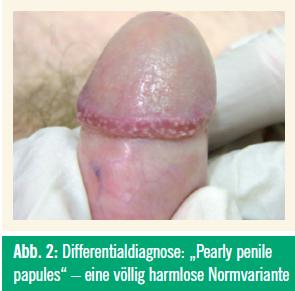
Häufig zu beobachten sind die „pearly penile papules“ oder Hirsuties papillaris coronae glandis, deren Entsprechung im weiblichen Genitalbereich als Papillomatosis labialis vulvae auftritt. Bei etwa 10–20 % der unbeschnittenen Männer auftretend, handelt es sich hier um eine völlig harmlose Normvariante.
Auch ektopische Talgdrüsen, Fibrome oder seborrhoische Warzen können Kondylome imitieren.
Mollusca contagiosa kommen beim Erwachsenen meist im Genitalbereich vor und sind als STD zu werten. Extragenitale Mollusken sollten an einen Immundefekt (z. B. HIV) denken lassen.
Heutzutage selten können Condylomata lata als Symptom der sekundären Syphilis beobachtet werden, die Verwechslungsgefahr mit Genitalwarzen ist dementsprechend besonders groß.
Besonders wichtig ist die Abgrenzung der Genitalwarzen gegen Neoplasien der Genitalregion wie vulväre oder penile int raepitheliale Neoplasien (VIN, PIN), die im Zweifelsfall nur histologisch erfolgen kann.
Als Sonderform muss die Bowenoide Papulose gewertet werden. Meist auf eine Infektion mit den HPV-High-Risk-Typen 16 und 18 zurückzuführen, ist sie histologisch nicht von einer intraepithelialen Neoplasie Grad III zu unterscheiden, bildet sich jedoch im überwiegenden Teil der Fälle von selbst zurück.
Therapie
Die Spontanregression von Genitalwarzen wird in der Literatur mit einer Häufigkeit von bis zu 30 % angegeben. Vor allem bei Kindern ist Zuwarten daher eine gewisse therapeutische Option. In den meisten Fällen wird jedoch zur Vermeidung von Progression sowie zur Reduktion der teilweise für den Patienten sehr belastenden Symptomatik eine Behandlung durchgeführt.
Besonders zu beachten ist dabei die Tatsache, dass die Entfernung von sichtbaren Warzen die Symptome mildert, jedoch nicht die Verhinderung von persistierendem viralen Genom in periläsionalem Epithel garantiert. Das Risiko eines Rezidivs nach erfolgreicher Behandlung beträgt dementsprechend für die bisher zur Verfügung stehenden Therapieformen mindestens 20–30 %, teilweise auch deutlich mehr.
Neben destruktiven Verfahren wie Kryotherapie, Elektrochirurgie, Exzision und CO2-Lasertherapie stehen konservative Methoden wie die Applikation von 80– 90%iger Trichloressigsäure zur Verfügung. Podophyllotoxin wird vom Patienten selbst appliziert.
Imiquimod stimuliert die Immunantwort, insbesondere die Freisetzung von Zytokinen, und führt damit über eine Entzündung zur Apoptose. Die Wirksamkeitsrate ist bei Frauen höher als bei Männern und kann durch Kombinationsbehandlung mit destruktiven Methoden gesteigert werden (etwa 65 %). Der Vorteil der Imiquimod-Therapie liegt in der vergleichsweise niedrigen Rezidivrate von etwa 10–20 %.
Neu auf dem österreichischen Markt ist Polyphenon E, ein Gemisch aus Katechinen des grünen Tees, das als 10%ige Salbe erhältlich ist. Studien zeigten bei einer 3x täglichen Applikation über 16 Wochen eine Abheilung der Genitalwarzen in 53,6 % versus 35,3 % in der Placebogruppe. Vergleichende Studien mit anderen Therapieformen liegen noch nicht vor.
Prophylaxe
Der im Jahr 2006 zugelassene quadrivalente Impfstoff gegen die 4 häufigsten HPV-Typen (6, 11, 16 und 18) stellt eine effiziente und sichere Infektionsprophylaxe dar. Die zu erwartende Wirksamkeit der Impfung wird besonders eindrucksvoll in einer im Jänner 2011 in „The Lancet“ erschienenen Arbeit verdeutlicht: In Australien wird der quadrivalente Impfstoff seit 2007 gratis allen 12–26 Jahre alten Frauen zur Verfügung gestellt. Untersucht wurde die Anzahl neuer Klienten, die das Melbourne Sexual Health Center von Jänner 2004 bis Dezember 2009 wegen genitaler Warzen aufgesucht hatten. Bei einer Durchimpfungsrate von 70 % ging der Anteil an Frauen unter 28 Jahren mit dieser Diagnose bereits im Jahr 2008 um 25,1 % pro Quartal zurück.
In Österreich muss hingegen in den nächsten Jahren mit einem Anstieg der Fälle von Genitalwarzen sowie auch von Zervixkarzinomen gerechnet werden. Denn bis auf Niederösterreich und das Burgenland liegt die Durchimpfungsrate im Schnitt zwischen 2 und 3,7 %.
Literatur:
1 B. Donovan, N. Franklin, R. Guy, A. E. Grulich, D. G. Regan, H. Ali, H. Wand, Ch. K. Fairley: Quadrivalent human papillomavirus vaccination and trends in genital warts in Australia: Analysis of national sentinel surveillance data. Lancet Infect Dis 2011; 11: 39-44
2 G. Gross: Konservative Behandlungsmethoden anogenitaler HPV-Infektionen. Hautarzt 2011; 62: 34-39
3 WHO/ICO Information Centre on HPV and Cervical Cancer (HPV Information Center). Summary Report 2009, www.who.int/hpvcentre/en/
4 Leitlinien zur Therapie der klassischen Geschlechtskrankheiten und Sexually Transmitted Diseases, herausgegeben von der Arbeitsgruppe für STD und dermatologische Mikrobiologie der ÖGDV, November 2009, www.oegdv.at
5 R. Höpfl: Humane Papillomaviren und ihre Rolle bei der Karzinogenese. Hautarzt 2001; 52: 834-846
Weitere Literatur bei der Verfasserin