Das „Rheuma-Labor“: Welche Laboruntersuchungen wann veranlassen?
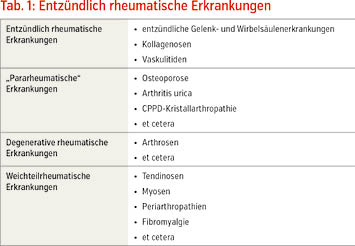
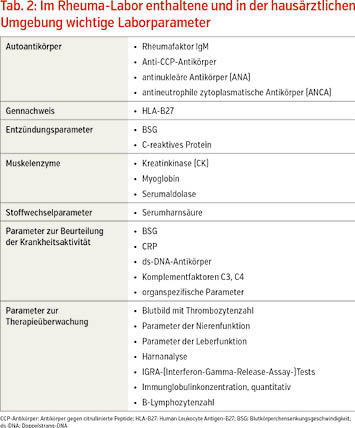
In der Rheumatologie können wir mit den entzündlich rheumatischen Erkrankungen, den degenerativ- und weichteilrheumatischen Erkrankungen und den „pararheumatischen“ Erkrankungen, zu denen auch die Kristallarthropathien gehören, vier Erkrankungsgruppen unterscheiden (Tab. 1). Insbesondere bei entzündlich rheumatischen Erkrankungen und „pararheumatischen“ Erkrankungen sind Laborbefunde unverzichtbarer Bestandteil der Diagnostik und Therapieüberwachung, da spezifische Symptome für die einzelnen Erkrankungen fehlen oder nicht nachweisbar sind. Zu den in der Rheumatologie eingesetzten Laborparametern gehören neben den Entzündungsparametern Blutsenkungsgeschwindigkeit (BSG) und C-reaktives Protein (CRP) auch klinisch chemische Parameter der Organfunktionen, des Stoffwechsels und der Muskulatur sowie der Nachweis von krankheitsspezifischen Autoantikörpern und anderen Proteinen (spezifisches Immunlabor, Rheuma-Labor) und molekularbiologische Bestimmungen (Tab. 2).
Rheuma-Labor (spezifisches Immunlabor)
Der Begriff des Rheuma-Labors entstand nach der Entdeckung des Rheumafaktors (RF) und der antinukleären Antikörper (ANA). Seither haben sich die Methoden zur Detektion von immunologischen Parametern verbessert, und es wurden weitere Autoantikörper für die Diagnostik entzündlich rheumatischer Erkrankungen entwickelt. Der diagnostische Wert von Autoantikörpern wird aber maßgeblich von der klinischen Symptomatik, die zur Antikörpertestung führt (Prätestwahrscheinlichkeit), beeinflusst. Bei gezieltem Einsatz spielen immunologische Tests neben der Bildgebung jedoch eine wichtige Rolle in der Diagnostik von entzündlich rheumatischen Erkrankungen. Nachfolgend werden die für die hausärztliche Praxis relevanten Laborparameter besprochen.
Rheumafaktoren
Rheumafaktoren sind Autoantikörper gegen den Fc-(Fragment Crystallisable-)Teil von Immunglobulinen, die in niedriger Konzentration bei jeder Reaktion des Immunsystems auf eine Infektion entstehen. Am häufigsten werden IgM-RF gebildet, seltener treten IgA- oder IgG-RF auf. Niedrige Konzentrationen von IgM-RF findet man mit zunehmendem Alter bei etwa 10–15 % der Gesunden und bei allen Kollagenosen. Konzentrationen, die das 3–4-Fache der Norm übersteigen, sind wie der Nachweis von IgA-RF charakteristisch für eine rheumatoide Arthritis (RA). Hohe Konzentrationen von IgM-RF findet man auch bei Patienten mit primärem Sjögren-Syndrom und bei kryoglobulinämischer Vaskulitis.
In der hausärztlichen Praxis ist die Bestimmung des IgM-RF indiziert und diagnostisch hilfreich, wenn sich Patienten mit einer Arthritis besonders an kleinen Gelenken vorstellen und klinische Hinweise auf ein infektiöses Geschehen fehlen.
Antikörper gegen citrullinierte Peptide (ACPA)
Die Citrullinierung ist ein physiologischer Prozess, der vermutlich zur beschleunigten Degradation von Proteinen dient. ACPA sind Antikörper gegen Proteine wie Filaggrin, Kollagen oder Vimentin, bei denen die Aminosäure Arginin enzymatisch in Citrullin umgewandelt wurde. ACPA werden durch die Verwendung von zyklischen citrullinierten Peptiden (CCP) getestet und weisen mit einer Spezifität von bis zu 90 % auf eine RA hin.
Wenn Patienten mit einer Arthritis unklarer Genese hausärztliche Hilfe in Anspruch nehmen und insbesondere, wenn Rheumafaktoren nicht nachweisbar sind, ist die Bestimmung von ACPA (CCP-Antikörpern) zur Diagnosesicherung und Beurteilung der Prognose indiziert.
Antinukleäre Antikörper (ANA)
ANA sind Antikörper gegen Bestandteile des Zellkerns und werden immunfluoreszenzoptisch auf einer humanen Leberzelllinie (HEp2-Zellen) nachgewiesen (Abb.). ANA sind bei Gesunden mit zunehmendem Lebensalter, bei Infektionen und bei Vorliegen von Tumoren nachweisbar, deuten aber nur mit einer 20%igen Wahrscheinlichkeit auf eine Kollagenose hin.
Liegen Symptome einer Kollagenose vor und fehlen Zeichen einer Infektion oder malignen Erkrankung, kann der hochtitrige Nachweis von ANA die Verdachtsdiagnose einer systemischen Autoimmun- erkrankung erhöhen. Obwohl als Eingangskriterium für die Klassifikation eines systemischen Lupus erythematodes (SLE) kürzlich ein ANA-Titer von 1 : 80 definiert wurde, steigt dessen Wertigkeit nur dann signifikant an, wenn für eine Kollagenose typische Symptome (Photosensibilität, Polyarthritis, Zytopenie, Raynaud-Phänomen, Glomerulonephritis, symmetrische Muskelschwäche, Sicca-Symptomatik et cetera) bestehen. Weiterführend ist der Nachweis von krankheitsspezifischen Autoantikörpern (ds-DNA-, SSB-, Jo-1-Antikörpern et cetera) erforderlich.
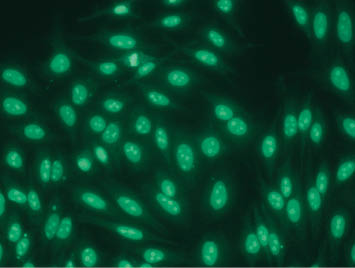
Abb.: Immunfluoreszenzoptische Darstellung von antinukleären Antikörpern. Im vorliegenden Fall handelt es sich um ANA mit nukleolärem Muster, wie sie bei einer systemischen Sklerose vorkommen können.
Antineutrophile zytoplasmatische Antikörper (ANCA)
ANCA sind Autoantikörper gegen lysosomale Proteine wie Proteinase-3 (PR3) und Myeloperoxidase (MPO). Immunfluoreszenztechnisch lassen sich drei Muster von ANCA detektieren: zytoplasmatisch (c-ANCA), perinukleär (p-ANCA) und atypisch (x-ANCA), wobei c-ANCA im ELISA meist mit PR3-ANCA und p-ANCA mit MPO-ANCA korrespondieren.
Wenn Patienten Allgemeinsymptome, sterile chronische Entzündungen, besonders des HNO-Traktes, der Lungen, des peripheren und zentralen Nervensystems und der Nieren, aber auch anderer Körperorgane aufweisen und sich in einer hausärztlichen Praxis vorstellen, stehen Immunfluoreszenz und ELISA als nichtinvasive Suchtests für eine ANCA-assoziierte Kleingefäß-Vaskulitis zur Verfügung, bevor eine bioptische Diagnosesicherung erfolgt.
HLA-B27
HLA-B27 ist ein Oberflächenmolekül der MHC-Klasse I, dessen Hauptaufgabe die Antigenpräsentation an CD8+-zytotoxischen T-Lymphozyten ist. Mehr als 80 % der Patienten mit axialer Spondyloarthritis (axSpA) tragen das HLA-B27-Gen, weshalb der Nachweis dieses Gens diagnostische Bedeutung hat. Wenn bei Patienten mit entzündlichem Rückenschmerz HLA-B27 nachweisbar ist, steigt die Wahrscheinlichkeit für das Vorliegen einer axSpA auf mehr als 50 %. Patienten, bei denen ein isolierter „chronischer Rückenschmerz“ ohne weitere SpA-Symptome vorliegt, müssen in hausärztlicher Umgebung nicht auf das Vorliegen von HLA-B27 getestet werden, da die Diagnosewahrscheinlichkeit einer axSpA nur auf 14 % steigt.
Das unspezifische Labor
Das unspezifische Labor in Form von Entzündungsparametern, Laborparametern der Organfunktionen (Blutbild, Herz-, Leber- und Nierenfunktion), einschließlich der Muskelenzyme und der Serumharnsäurekonzentration, dient der Diagnostik rheumatischer Erkrankungen, der Aktivitätsbeurteilung und der unerlässlichen Therapiekontrolle. Aufgrund der ungenügenden Versorgung der Bevölkerung mit im niedergelassenen Bereich tätigen Rheumatologen durch das österreichische Gesundheitssystem müssen diese Laboruntersuchungen von Hausärzten durchgeführt werden.
Entzündungsparameter
In der Rheumatologie stehen als möglicher Hinweis auf ein entzündliches Geschehen und zur Beurteilung der Krankheitsaktivität von entzündlich rheumatischen Erkrankungen weiterhin nur die unspezifischen Entzündungsparameter BSG und CRP zur Verfügung. Bei der Erstvorstellung der Patienten sollten beide Parameter gemeinsam bestimmt werden, da in Abhängigkeit von der rheumatischen Grundkrankheit nur ein Entzündungsparameter (bei SLE die BSG) pathologisch verändert sein kann. Entzündungsparameter korrelieren oft nicht mit der entzündlichen Aktivität einer rheumatischen Erkrankung. Während bei den hoch inflammatorischen Kristallarthropathien und aktiven Vaskulitiden pathologische Entzündungsparameter immer vorliegen, sind diese bei aktiven Spondyloarthritiden in bis zu 50 % und bei aktivierter Arthrose in der überwiegenden Mehrzahl der Fälle fehlend. Umgekehrt bedeuten pathologisch erhöhte Entzündungsparameter nicht, dass eine entzündlich rheumatische Erkrankung vorliegen muss.
Die Bestimmung von Akut-Phase-Proteinen wie Ferritin, Serumamyloid A und Interleukin-6 erfolgt von rheumatologischer Seite nur bei seltenen rheumatischen Erkrankungen wie dem Morbus Still des Erwachsenen, dem familiären Mittelmeerfieber oder eventuell bei der Riesenzellarteriitis.
Serumharnsäurekonzentration
Die Prävalenz der Arthritis urica ist in den letzten 20 Jahren auf 25 Patienten pro 1.000 Einwohner gestiegen. Bei Patienten mit attackenförmig verlaufenden Arthritiden ist die Bestimmung der Harnsäurekonzentration im anfallsfreien Intervall wichtig, da die Höhe der Konzentration mit der Wahrscheinlichkeit eines Gichtanfalls korreliert. Das Therapieziel bei der Arthritis urica besteht in der kontinuierlichen Senkung der Serumharnsäurekonzentration auf < 6 mg/dl.
Muskelenzyme
Stellen sich Patienten in der Praxis mit Muskelschwäche vor, muss differenzialdiagnostisch an eine neurogene Ursache oder an eine idiopathische inflammatorische Myopathie (Myositis) gedacht werden. Zur weiteren Abklärung kann bereits im hausärztlichen Bereich die Serumkonzentration der Kreatinkinase (CK), des Myoglobins und der Serumaldolase gemessen werden. Zur Beurteilung der laborchemischen Krankheitsaktivität einer inflammatorischen Myopathie reicht anschließend die Messung eines Muskelenzyms – meist der CK – aus.