Diagnose und Management der nicht-alkoholischen Fettlebererkrankung
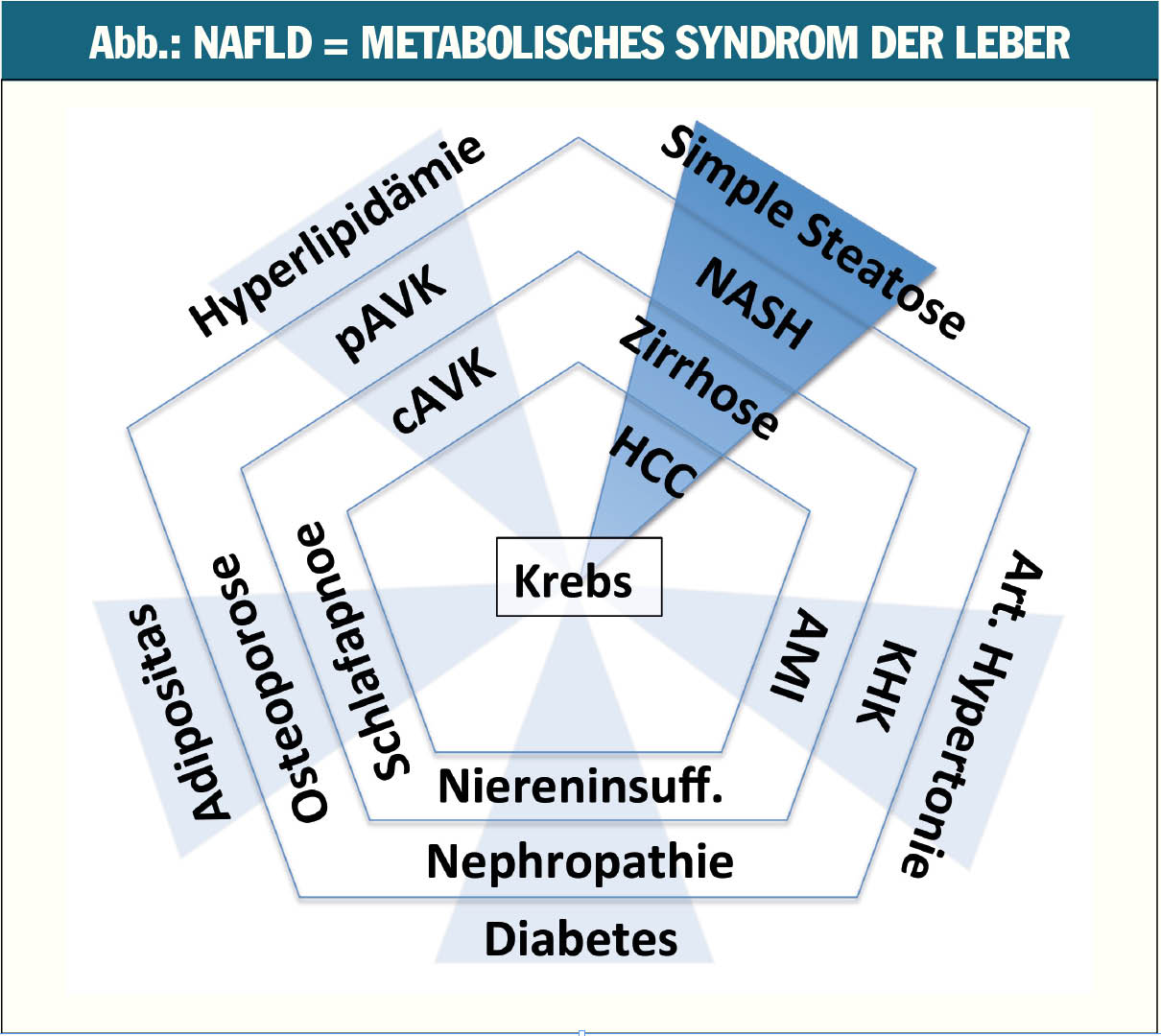
Die starken Veränderungen der Lebensstil- und Diätgewohnheiten speziell der westlichen Bevölkerung führen zu einem rasanten Prävalenzanstieg des metabolischen Syndroms (v.a. Adipositas oder Diabetes). Die nichtalkoholische Fettlebererkrankung (engl.: non-alcoholic fatty liver disease, NAFLD) als hepatische Manifestation des metabolischen Syndroms (Abb.) ist hierbei genauso betroffen, dies trifft auch auf die nichtalkoholische Steatohepatitis (NASH) als progressivere Variante der NAFLD mit entsprechend erhöhtem Risiko für die Entwicklung einer Leberzirrhose und eines hepatozellulären Karzinoms (HCC) zu. Während sich die Komplikationsraten und Folgeerkrankungen wie akuter Myokardinfarkt, Insult oder Amputationen beim Diabetes aufgrund des stark verbesserten Managements und neuer Therapieoptionen in den letzten 20 Jahren substanziell verringert haben, stehen wir bei den Therapieoptionen der NASH weiterhin am Beginn.
Die metabolische Fettlebererkrankung
Adipositas und Diabetes: Steigende Adipositasraten führen zu einer steigenden Prävalenz der NAFLD. Die nichtalkoholische Fettleber spielt hierbei eine maßgebliche Rolle in der Pathogenese des metabolischen Syndroms und im speziellen der Insulinresistenz (IR), welche wiederum die Entstehung und Progression der NASH fördert. NASH-Patienten beklagen häufiger Müdigkeit und Energieverlust, was folglich zu Inaktivität und Adipositas führt. Dieser Teufelskreis erhöht das Risiko für metabolische Komplikationen wie Myokardinfarkt, pAVK, Niereninsuffizienz, Leberzirrhose und Malignome.
Kardiovaskuläres Risiko: Die Rolle der NAFLD als unabhängiger Risikofaktor für kardiovaskuläre Erkrankungen zeigt sich in einer schon frühzeitig erhöhten Intima-Media-Dicke, einem erhöhten Risiko für arteriosklerotische Plaque sowie einem erhöhten koronaren Kalzium-Score. Diese Assoziation ist durch die zentrale Rolle der Leber im Lipidstoffwechsel und der Blutgerinnung zu erklären, so steigt in Abhängigkeit vom Schwergrad der NASH die hepatische Expression von PAI-1 (Plasminogen-Aktivator-Inhibitor-1) als Zeichen des erhöhten kardiovaskulären Risikos. Der Myokardinfarkt zählt hierbei zu den häufigsten Todesursachen bei NAFLD-Patienten. Mit fortschreitender Lebererkrankung steigt auch das Risiko für kardiovaskuläre Ereignisse. Aus diesem Grund empfehlen die aktuellen Leitlinien ein umfassendes Screening auf kardiovaskuläre Erkrankungen bei Fettleber-Patienten, welches je nach Anzahl der Risikofaktoren alle ein bis zwei Jahre wiederholt werden sollte.
Malignomrisiko: Malignome zählen zu den häufigen Todesursachen bei Fettleberpatienten. Das HCC steht hepatologisch im Vordergrund, wobei auch andere Malignome, wie das Kolonkarzinom, mit NALFD assoziiert sind. Neue Daten zeigen außerdem auch bei nichtzirrhotischen NASH-Patienten ein erhöhtes HCC-Risiko, womit das bisherige Screening (v.a. Zirrhose) erschwert wird.
NAFLD erhöht das Risiko für adenomatöse, multiple Polypen. Diese treten gehäuft im rechtseitigen Kolon auf, wobei hier vermehrt fortgeschrittene Adenome beschrieben werden. Aufgrund des Entartungsrisikos und der beschriebenen erhöhten Kolonkarzinomrate bei NASH-Patienten sollte speziell bei Männern ein früheres Screening mittels Koloskopie stattfinden, um spätere Komplikationen zu vermeiden.
PNPLA3: In bisherigen Studien zeigte sich vor allem ein spezieller Polymorphismus im PNPLA3-Gen (Patatin-like phospholipase domain-containing protein 3 oder Adiponutrin) als wichtigster genetischer Faktor in der Krankheitsentstehung und -progression der NAFLD. Patienten des Genotyps I143M weisen hierbei ein signifikant erhöhtes Risiko auf, eine fortschreitende Lebererkrankung im Sinne einer Fibrose oder Zirrhose sowie ein HCC zu entwickeln. Dementsprechend ist eine PNPLA3-Genotyp-Screening-Strategie für HCC bei NASH-Patienten mit höhergradiger Fibrose vermutlich sinnvoll. Diese Patienten entwickeln zusätzlich möglicherweise schon frühzeitiger eine Arteriosklerose.
Diagnose der NAFLD
Symptome: Da Patienten mit NAFLD häufig asymptomatisch sind, wird die Diagnose bzw. der Verdacht meist im Rahmen von Gesundenuntersuchungen bzw. Durchuntersuchungen gestellt. Im Vordergrund stehen allgemeine Symptome wie Müdigkeit, Lethargie sowie ein dumpfes Druck- bzw. Schmerzgefühl im rechten Oberbauch.
Die weitere Abklärung erfolgt meist auf Grund erhöhter Transaminasen, GGT und/oder einer erhöhten Echogenität im abdominellen Ultraschall (US).
Laborwerte: Bei über 60% der Patienten mit Zufallsbefund „erhöhte Transaminasen und/oder GGT“ findet sich die Diagnose Fettlebererkrankung, wobei auch normale Transaminasen eine NASH nicht ausschließen, womit diese klassischen Leberwerte die Prävalenz der NASH unterschätzen. Auch der Grad der Transaminasenerhöhungen lässt keine eindeutigen Rückschlüsse auf die Schwere der Lebererkrankung zu, im Speziellen, wenn andere Manifestationen des metabolischen Syndroms wie Insulinresistenz und Diabetes mellitus (DM) vorliegen. Leider konnten bisher auch alternative Marker wie das caspasespaltende Zytokeratin-18 (CK-18) keine letztendlich überzeugenden Ergebnisse liefern, womit für die klinische Praxis derzeit keine echten Alternativen zur Verfügung stehen. Ein häufig erhöhtes Ferritin und auch nicht selten leicht erniedrigtes Coeruloplasmin weisen auf wichtige Differenzialdiagnosen (Hämochromatose, M. Wilson) hin, sind bei NASH-Patienten aber eher unspezifisch und nur bedingt als Verlaufsparameter geeignet. Ferritin hat jedoch eine mögliche Bedeutung als Biomarker für ein erhöhtes kardiovaskuläres Risiko.
Leberbiopsie: Die Leberbiopsie bleibt bis zum heutigen Zeitpunkt der „Goldstandard“ in der endgültigen Diagnose der NASH, wird aber in der klinischen Praxis nur bei differenzialdiagnostischen Problemen zum Ausschluss anderer Lebererkrankungen durchgeführt, da die Differenzierung zwischen „reiner Fettleber“ und NASH auf Grund der limitierten therapeutischen Optionen nur wenig praktische Konsequenzen hat. Einzelne Beurteilungskriterien wie Steatosegrad oder fortgeschrittene Fibrose können allerdings auch durch nichtinvasive Methoden (CAP Fibroscan, MRT, transiente Elastografie) erhoben werden, womit die Hoffnung steigt, diesen relativ schlechten Goldstandard (Komplikationsrisiko, Variabilität, Praktikabilität der Durchführung bei einer „Volkserkrankung“) in Zukunft weniger häufig einsetzen zu müssen.
Falls indiziert, ermöglicht ein neues Klassifikationssystem (SAF-Score nach Bedossa) eine einfachere und bessere Unterscheidung zwischen simpler Steatose und NASH.
Nichtinvasive Methoden: Serologische nichtinvasive Tests konnten sich bisher weder zur Beurteilung der Krankheitsaktivität (z.B.: NASH-Test) noch des Fibrosegrades (z.B.: ELFTM-Test, NAFLD Fibrosis Score) durchsetzen. Zur Beurteilung einer höhergradigen Fibrose wird jedoch der NAFLD Fibrosis Score empfohlen. Dieser beruht auf sechs Variablen, die auch im klinischen Alltag einfach zu erheben sind (Alter, BMI, Hyperglykämie, Thrombozyten, Albumin und AST/ALT).
Die transiente Elastografie (Fibroscan®), ein Verfahren zur Messung der Ausbreitungsgeschwindigkeit eines Ultraschall-impulses, hilft bei der Einschätzung des Fibrosegrades, wobei auch hier vor allem zwischen leicht- und höhergradiger Fibrose bzw. Steatose (mittels Fibroscan CAPTM) unterschieden werden kann. Neue Anwendungskriterien sowie eine neue Sonde (XL-Probe) könnten bisherige Schwächen (Anwendbarkeit v.a. bei Adipositas) reduzieren und somit zu einer höheren Erfolgsrate führen. Neue Methoden im Rahmen der Magnetresonanz (MR) und MR-Spektroskopie könnten hierbei zusätzlich wichtige Aufgaben im Feld der nichtinvasiven Diagnostik übernehmen und zusätzlich neue Erkenntnisse auf dem Gebiet der Pathogenese liefern.
Therapie der NAFLD
Lebensstilmodifikation: Die Lebensstilmodifikation gilt weiterhin als die wichtigste Säule im Management der NAFLD. Im Zentrum steht die Gewichtsreduktion, welche durch verschiedene diätologische Maßnahmen sowie durch erhöhte physische Aktivität erreicht werden soll und gute Resultate zeigt. Dies gilt, unabhängig davon, welche Diät eingesetzt wird. Die positiven Effekte zeigen sich häufig schon ab einem Gewichtsverlust von 5–10% des Körpergewichts (> 5% Verbesserung der Steatose; ≥ 9% Verbesserung von Insulinsensitivität, Inflammation, NA-Score). Sowohl Ausdauertraining als auch Kraftsport können unabhängig von Gewichtsreduktion zu einer Verbesserung der NAFLD führen.
Bariatrische Chirurgie: Insbesondere bei Patienten mit morbider Adipositas (BMI > 40 oder> 35 mit Komorbidität) und NASH stellt die bariatrische Chirurgie eine effektive Therapieoption zur Gewichtsreduktion dar, welche auch mögliche positive Effekte auf die Fettleber hat. Die bisherigen Studien konnten in den meisten Fällen eine Verbesserung der Steatose und Inflammation zeigen, wohingegen die Daten zu Fibrose divergieren und auch teilweise eine Verschlechterung zu beobachten war. Aufgrund der Irreversibilität, des perioperativen Risikos und einer möglichen Fibroseprogression ist daher eine strenge nicht leberfokussierte Indikationsstellung wichtig.
Insulin-Sensitizer: Metformin konnte bisher keine histologische Verbesserung erzielen. Es ist bei diabetischen Patienten aber weiterhin Mittel der Wahl und könnte zusätzlich das HCC-Risiko senken.
Die Rolle von Pioglitazon bei NASH ist trotz positiver Effekte aufgrund möglicher Nebenwirkungen (Beinödeme, Herzinsuffizienz) weiterhin umstritten, weshalb eine Therapie wahrscheinlich weiterhin nur bei bereits vorliegender diabetischer Indikation sinnvoll erscheint. Abzuwarten ist die Bedeutung von GLP-1-Analoga und DPP-4-Inhibitoren, welche derzeit getestet werden.
Statine: Statine sind bei der Behandlung der Dyslipidämie bei NAFLD-Patienten indiziert und werden in den aktuellen Leitlinien ausdrücklich empfohlen, um kardiovaskuläres Risiko und Mortalität zu senken. Eine rezente Metaanalyse konnte zusätzlich zeigen, dass Statine mit einem reduzierten HCC-Risiko assoziiert sind.
Vitamin E und Omega-3-Fettsäuren: Da die Vitamin-E-Therapie zwar zu einer Verbesserung der Histologie führte, aber gerade hohe Dosen mit einer fraglich erhöhten Gesamtmortalität und einem erhöhten Prostatakrebsrisiko assoziiert sein könnten, ist der Einsatz weiterhin umstritten. Vitamin E bleibt derzeit die einzige medikamentöse Option bei NASH-Patienten ohne Diabetes und wird in den aktuellen Leitlinien in dieser Indikation erwogen.
Auf Grund des sehr heterogenen Studiendesigns und einer zuletzt negativen placebokontrollierten Studie kann derzeit keine Empfehlung für Omega-3-Fettsäuren ausgesprochen werden.
Phlebotomie: Bei NASH-Patienten mit erhöhtem Serum Ferritin könnte die Phlebotomie eine sinnvolle Therapieoption darstellen, wobei größere prospektive Studien abgewartet werden sollten.
Neue Gallensäuren-(GS-)Derivate und Kernrezeptor-Liganden: Gallensäuren sind wichtige Schlüsselspieler in verschiedenen metabolischen Prozessen. Über den Farnesoid-X-Rezeptor (FXR) regulieren sie den Energiehaushalt, den Glukose- und Lipidmetabolismus. Aktuelle Daten zu neuen GS-Rezeptor-Agonisten (z.B. Farnesoid-X-Rezeptor-Liganden) sind vielversprechend und derzeit in klinischer Erprobung.
Probiotika: Erste Studien zu Probiotika konnten eine Reduktion von Steatose und Transaminasen zeigen, wobei auch hier auf weitere prospektive Daten gewartet werden muss.
AT-II-Blocker: Da das Renin-Angiotensin-System eine wichtige Rolle im Rahmen der chronischen Entzündung und Fibrogenese einnimmt, könnten Angiotensin-Rezeptorblocker (ARB) eine gute Therapieoption bei arterieller Hypertonie und NASH darstellen.
Fazit
Die NAFLD als metabolische Lebererkrankung spielt eine Schlüsselrolle in der Pathogenese des metabolischen Syndroms. Die diagnostische Abklärung und Therapie sollte daher sowohl hepatologisch als auch allgemein-internistisch durchgeführt werden. Integrale Bestandteile sind hierbei die Beurteilung der Lebererkrankung, die routinemäßige Abklärung von kardiovaskulären und diabetischen Risikofaktoren sowie eine personalisierte Krebsvorsorge.
In diesem Zusammenhang ist die Lebensstilmodifikation mittels Diät und Bewegung der Grundsockel jeglicher Therapie. Medikamentöse Therapieoptionen sind derzeit limitiert. Aufgrund der zusätzlich positiv hepatologischen Effekte sollte somit die Behandlung aller metabolischen Erkrankungen im Fokus stehen (z.B. Statine, Insulin-Sensitizer, AT-II-Blocker).