Eine neue Diabetesklassifikation für präziseres Management
Diabetes mellitus bezeichnet heterogene Erkrankungen mit Unterschieden in Genese, Krankheitsverlauf und Entwicklung von Komplikationen, deren gemeinsames diagnostisches Kriterium die Hyperglykämie, gemessen anhand von Nüchtern-, 2-h-OGTT-Glukose und/oder HbA1c, ist. Die Entwicklung der Klassifikationen des Diabetes hat diese Heterogenität in den letzten Jahrzehnten nur unzureichend berücksichtigt. Auch die gegenwärtige Klassifikation in Typ-1- und Typ-2-Diabetes beruht hauptsächlich auf Unterschieden in Insulinsekretion und Insulinsensitivität sowie dem Vorhandensein von Inselzell-Autoantikörpern.1 Rezente Studien führten neuen Einteilungen des Diabetes und Prädiabetes, die es ermöglichen, Subgruppen (Endotypen, Cluster) des Diabetes anhand von wenigen weiteren Parametern zu identifizieren. Dies könnte zu einer stratifizierten Diagnose und Risikobeurteilung sowie einer gezielten Prävention und Therapie beitragen.2–5 Eine differenzierte Einteilung des Diabetes soll zukünftig die Grundlage für ein maßgeschneidertes Management der Betroffenen im Sinne einer „Präzisionsdiabetologie“ bilden.6
Einfache klinische Merkmale als Grundlage
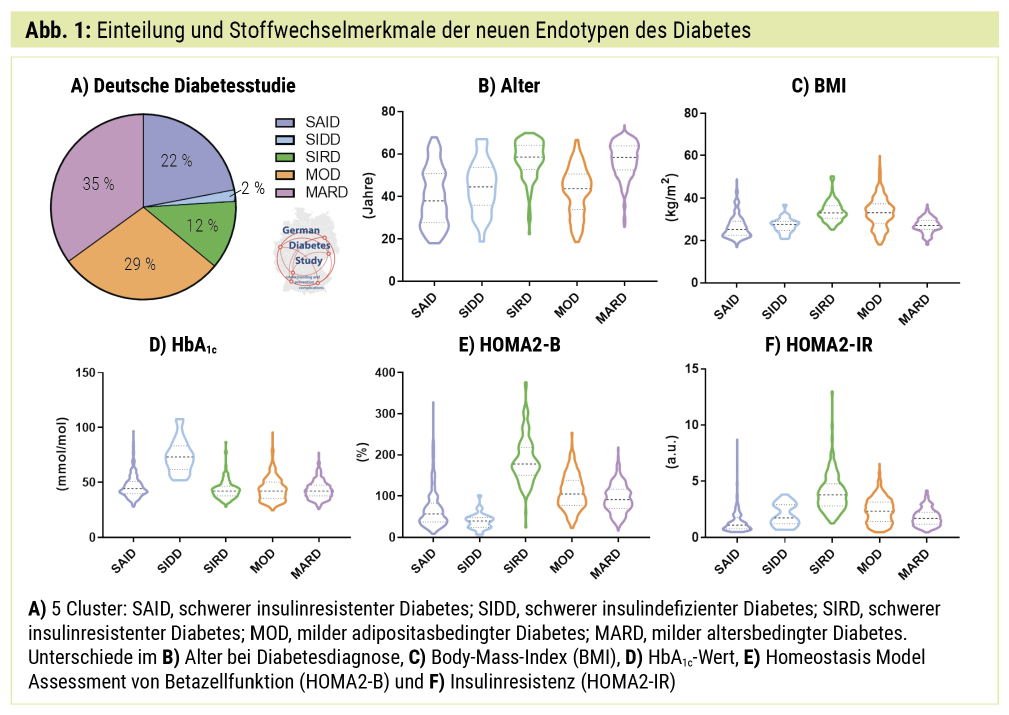
Die aktuell am besten untersuchte Neueinteilung des Diabetes in Endotypen beruht auf einer Clusteranalyse der Arbeitsgruppe um Leif Groop2, die von unserer Arbeitsgruppe validiert und bezüglich des Risikos von diabetesassoziierten Komorbiditäten und Komplikationen erweitert wurde.4 Die Clusteranalyse identifizierte sechs Parameter: das Vorhandensein von GAD-Autoantikörpern, das Alter bei Diabetesdiagnose, den Body-Mass-Index (BMI), den HbA1c-Wert sowie Surrogate der Betazellfunktion und Insulinresistenz (Homeostasis Model Assessment: HOMA2-B und HOMA2-IR). Bei der Anwendung des Cluster-Algorithmus wurden in den skandinavischen Kohorten 3 schwerere und 2 mildere Diabetes-Endotypen ermittelt.2 Wir validierten den Clustering-Algorithmus unter Anwendung von Goldstandard-Methoden wie dem intravenösen Glukosetoleranz-Test (IVGTT) zur Bestimmung der Betazellfunktion und dem hyperinsulinämischen normoglykämischen Clamp-Test zur Bestimmung der Insulinsensitivität bei den Teilnehmern der Deutschen Diabetes-Studie (German Diabetes Study, GDS). Diese prospektive Kohortenstudie hat derzeit mehr als 2000 Menschen mit neudiagnostiziertem Typ-1- oder Typ-2-Diabetes mellitus sowie ein Kontrollkollektiv detailliert phänotypisiert und beobachtet die von Diabetes Betroffenen über einen Zeitraum von 20 Jahren.7 Des Weiteren ergänzten wir die zuvor genannten Parameter um weitere Inselzell-Autoantikörper zur Optimierung der Diagnose des Autoimmundiabetes.4
Endotypen
Endotyp (Cluster) 1, der „schwere Autoimmundiabetes“ (SAID), entspricht im Wesentlichen dem Typ-1-Diabetes und zeichnet sich durch reduzierte Betazellfunktion (niedriger HOMA2-B, niedrige C-Peptid-Sekretion im IVGTT), positive diabetesassoziierte Antikörper, niedrigeren BMI sowie frühere Krankheitsmanifestation aus. Der „schwere insulindefiziente Diabetes“ (SIDD) ist in seinen Merkmalen dem SAID ähnlich, weist jedoch keine diabetesassoziierten Antikörper auf.
Der „schwere insulinresistente Diabetes“ (SIRD) ist durch eine ausgeprägte Insulinresistenz (hoher HOMA2-IR bzw. niedriger M-Wert im Clamp-Test) und einen hohen BMI gekennzeichnet. Bei Endotyp 4, dem „milden adipositasbedingten Diabetes“ (MOD), besteht überwiegend Übergewicht, aber geringere Insulinresistenz, während bei Endotyp 5, dem „milden altersbedingten Diabetes“ (MARD), eine spätere Krankheitsmanifestation bei etwas höherem BMI und HbA1c-Wert besteht (Abb. 1).
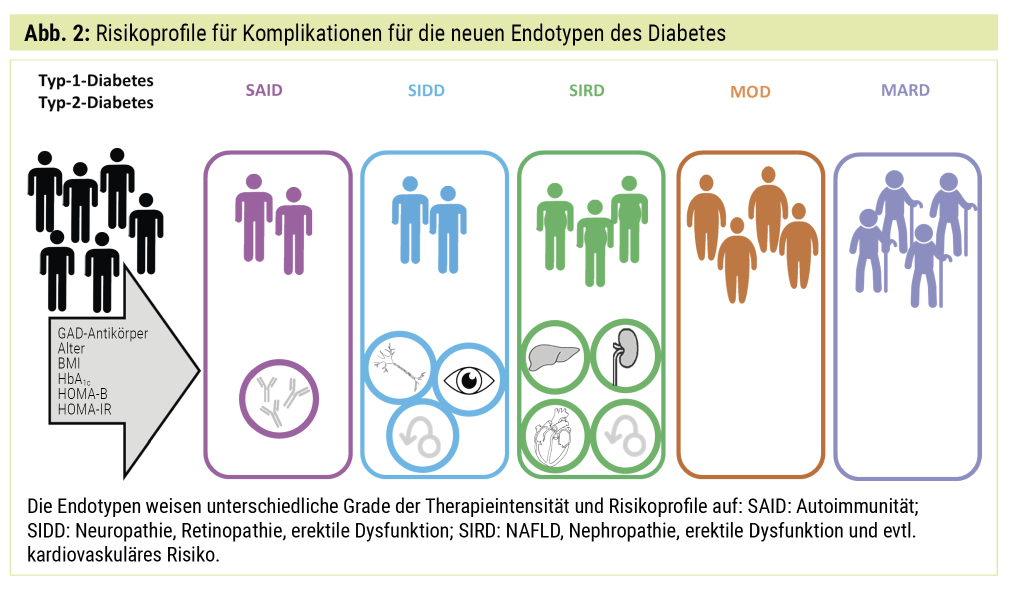
Unterschiedliche Risikoprofilefür Diabetes-Folgen
Die auf Basis der Clusteranalyse entdeckten Endotypen unterscheiden sich schon in den frühesten Phasen der Diabeteserkrankung in ihren Risikoprofilen für diabetesbedingte Komplikationen (Abb. 2).
Nichtalkoholische Fettlebererkrankung (NAFLD): NAFLD wird durch einen Triglyzeridgehalt der Leber von mehr als 5,5 % (Magnetresonanz-Methoden) oder mehr als 5,5 % fettbeladender Hepatozyten in der Leber (Histologie) definiert und umfasst ein Spektrum, das von nichtalkoholischer Fettleber (NAFL, Steatose) über nichtalkoholische Steatohepatitis (NASH) mit oder ohne Fibrose bis hin zur Leberzirrhose und zum hepatozellulären Karzinom auf Basis einer NAFLD reicht.8 NAFLD gehört zu den häufigsten Lebererkrankungen der westlichen Welt, wobei bemerkenswerterweise über 70 % der Patienten mit Typ-2-Diabetes betroffen sind.9
In der Deutschen Diabetes-Studie entdeckten wir, dass der Leberfettgehalt bei den Menschen, die dem SIRD-Cluster angehören, am höchsten ist.4 Dieser Endotyp zeigte sowohl bei Diagnose des Diabetes als auch 5 Jahre später das höchste Risiko für Leberfibrose, gemessen anhand etablierter Scores (APRI und NAFLD-FS).4
Auch genetische Faktoren beeinflussen das Risiko einer NAFLD bei Menschen mit Diabetes. So ergaben weitere Analysen aus der Deutschen Diabetes-Studie, dass Menschen mit dem SIRD-Endotyp häufiger das G-Allel im PNPLA3-Gen aufweisen, das mit erhöhtem Risiko für Progression der NAFLD assoziiert ist.10 Sie wiesen des Weiteren höhere zirkulierende freie Fettsäuren und Insulinresistenz des Fettgewebe auf, was darauf hinweist, dass das PNPLA3-Gen nicht nur in der Leber, sondern auch im Fettgewebe metabolische Veränderungen bewirken kann, die Entstehung und Progression der NAFLD beschleunigen.10 Da von Diabetes und NAFLD Betroffene auch ein erhöhtes kardiovaskuläres Risiko aufweisen, ist die Identifikation von Hochrisiko-Endotypen auch bezüglich Herz-Kreislauf-Erkrankungen und einer frühzeitig intensivierten Therapie der relevanten Risikofaktoren von Bedeutung.
Kardiovaskuläres Risiko: Das erhöhte kardiovaskuläre Risiko bei Diabetes beruht aber nicht nur auf Insulinresistenz und NAFLD allein, sondern involviert unter anderem auch die chronische subklinische Inflammation9, 11 und die Dyslipidämie12. Cluster-Analysen in schwedischen2 und japanischen13 Studienpopulationen ergaben ein nominal erhöhtes Risiko für koronare Herzkrankheit, insbesondere bei Menschen mit SIRD. Dieser Endotyp weist ebenso höhere Serum-Triglyzeride und freie Fettsäuren4, aber auch Biomarker der subklinischen Inflammation auf.14, 15 Hingegen haben Personen mit SAID im Vergleich zu den anderen Diabetes-Endotypen das niedrigste kardiovaskuläre Risiko und weisen die geringste Insulinresistenz bzw. damit assoziierte Biomarker auf.16
Retinopathie, Neuropathie und erektile Dysfunktion: Retinopathie, distal symmetrische Polyneuropathie und kardiale autonome Neuropathie wurden am häufigsten bei SIDD beobachtet.2, 4 Wichtige pathogenetische Faktoren der diabetischen Neuropathie sind Insulinmangel und Hyperglykämie, welche die Genexpression und Synthese essenzieller Proteine hemmen und die Apoptose fördern.17 Menschen, die dem SIDD-Endotyp angehören, sollten daher von der Früherkennung von (prä-)diabetischer Neuropathie und Vorbeugung ihrer Folgen wie dem diabetischen Fußsyndrom und der autonomen Dysfunktion, die mit erheblicher Morbidität und Mortalität verbunden sind, profitieren.17 Eine spezielle komplexe Funktionsstörung stellt dabei die erektile Dysfunktion dar, welche die höchste Prävalenz bei Männern mit neudiagnostiziertem SIDD, aber auch bei jenen mit SIRD hat.18 Dies zeigt, dass neben Insulinmangel und Hyperglykämie auch andere Faktoren wie die Insulinresistenz eventuell unabhängig zur erektilen Dysfunktion bei Diabetes beitragen.
Hinweise auf unterschiedliche Pathomechanismen der Diabetesentstehung
Neben den wichtigsten Risikofaktoren für Insulinresistenz wie kalorienreiche Ernährung und körperliche Inaktivität sind aber auch genetische Faktoren, oxidativer Stress und Entzündung nicht nur mit dem nichtautoimmunen Diabetes assoziiert11, sondern auch mit der Entstehung der NAFLD bei Personen mit Diabetes.19 Neuere Studien zeigen, dass neben Metaboliten (freie Fettsäuren, Aminosäuren) und Signalproteinen (Myokine, Adipokine, Hepatokine) auch Exosomen (Proteine, mRNA und microRNA) zu einem veränderten Crosstalk zwischen Skelettmuskulatur, Leber und Fettgewebe beitragen und die Entwicklung einer Insulinresistenz begünstigen können.20
Angesichts der besonderen Rolle immuninflammatorischer Prozesse bei der Entwicklung von Diabetes und diabetesbedingten Komplikationen untersuchten wir zirkulierende Immunzellen und Biomarker der subklinischen Entzündung in den Endotypen der Deutschen Diabetes-Studie.14, 15 Angehörige des SIRD-Endotyps wiesen nicht nur erhöhte Leukozyten-Zahlen, sondern auch höhere Frequenzen an CD4+-T-Zellen und CCR4+-regulatorischen T-Zellen auf.15 Dieser Endotyp zeigte auch die höchsten Werte für proinflammatorische Biomarker, während für SIDD die niedrigsten Werte gemessen wurden. Entzündungsbedingte Prozesse im Fettgewebe und die dadurch induzierte Freisetzung von Lipiden und proinflammatorischen Biomarkern sind wohl entscheidend für die Pathogenese von Typ-2-Diabetes, Dyslipidämie und NALFD.11 Der SIRD-Endotyp zeigte besonders hohe Werte für drei Biomarker (CASP-8, IL-6, EN-RAGE), die mit Apoptose, Fettgewebsentzündung bzw. Zytokinproduktion, Chemotaxis und oxidativem Stress assoziiert sind.14
Herausforderungen und Perspektiven
Vor dem Transfer in die klinische Routine müssen aber noch mehrere methodische und praktische Fragen beantwortet werden: Wie stabil sind Endotypen im Krankheitsverlauf? Sind die Ergebnisse weltweit generalisierbar, und wie praktikabel ist die Umsetzung in der Routineversorgung?
Lebensstilinterventionen, bariatrische Chirurgie sowie Antihyperglykämika können die Eigenschaften der Endotypen wie Insulinresistenz und Betazelldysfunktion unterschiedlich beeinflussen20, sodass sich die Frage stellt, ob endotypenspezifische therapeutische Konzepte den Stoffwechsel oder letztlich auch den Verlauf gezielt verbessern könnten. Dies muss nun in randomisierten kontrollierten Studien geprüft werden.
Unabhängig von diesen offenen Fragen hat das Konzept einer neuen Diabetesklassifikation bereits einen tieferen Einblick in das heterogene Krankheitsbild von Diabetes ermöglicht und Fortschritte auf diesem Gebiet angeregt, um die Präzisionsdiabetologie in Zukunft Realität werden zu lassen.
Zusammenfassung
Die Klassifizierung von Typ-1- und Typ-2-Diabetes in 5 Endotypen basierend auf Autoimmunität, Alter, BMI, HbA1c, Betazellfunktion und Insulinsensitivität ermöglicht es, Gruppen von Betroffenen mit unterschiedlicher Häufigkeit von diabetesassoziierten Komorbiditäten und Komplikationen zu identifizieren. Dabei zeigt der schwere insulinresistente Diabetes (SIRD) bereits frühzeitig ein deutlich erhöhtes Risiko für NAFLD und deren Progression, die zum Teil genetisch (PNPLA3) mediiert sein könnte, aber auch pathogenetische Hinweise auf einen schweren Verlauf. Frühzeitig intensivierte und gezielte Diabetestherapie und Prävention von Spätfolgen könnte für diesen Endotyp von besonderer Bedeutung sein.
























































































