Jede Herzerkrankung erfordert Glukose-Check
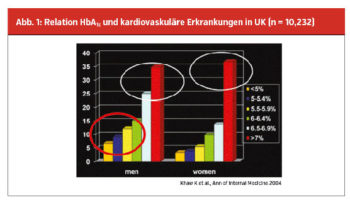
Eine Studie zeigt, dass bei akuter Einweisung zum Herzkatheter 58 % der Patienten eine Störung im Glukosestoffwechsel aufweisen (22 % manifester Diabetes, 32 % Prädiabetes, 4 % gestörte Nüchternglukose). Das heißt, nur 42 % aller Patienten mit akutem Infarkt haben eine normale Glukosestoffwechsellage. Noch stärker zeigt sich dieser Zusammenhang bei Patienten mit Schlaganfall, bei denen sogar 70 % eine Glukosestoffwechselstörung aufweisen. Jede HbA1c-Steigerung hat einen negativen Einfluss auf die kardiovaskuläre Situation und dies nicht erst ab einem Wert von 6,5 %. Die Häufung von kardiovaskulären Ereignissen kann bereits ab einem HbA1c von 5,5 % nachgewiesen werden. Patienten mit einem HbA1c-Wert von 6,5 bis 6,9 % haben jedoch eine nahezu doppelt so hohe Ereignisrate wie Patienten mit einem HbA1c-Wert von 5,5 bis 5,9 %. (Abb. 1)
Die makrovaskulären Schäden dieser Herz-Kreislauf-Erkrankungen entstehen durch eine Kombination aus Hyperglykämie und der daraus resultierenden Aktivierung von vier pathophysiologischen Mechanismen: dem Sorbitol-, dem Polyol-, dem Hexosamin-, dem Proteinkinase C- und dem AGE-Signalweg.
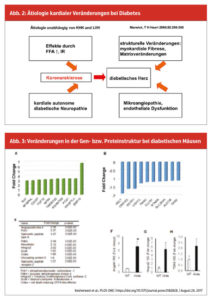
In den großen Gefäßen kommt es durch die Hyperglykämie zudem zu einer Veränderung der LDL-Moleküle sowie zur Bildung von reaktiven Sauerstoffradikalen, die durch die Makrophagenaktivierung zur Entstehung atherosklerotischer Plaques und zur Koronarsklerose führen. Dies sind allerdings nicht die einzigen pathophysiologischen Vorgänge im Zusammenhang mit Diabetes und Herz-Kreislauf-Erkrankungen. Die Veränderungen, die neben der Koronarsklerose schlussendlich zum diabetischen Herz führen, sind verursacht durch Erhöhung der freien Fettsäuren, durch Insulinresistenz sowie strukturelle Veränderungen wie myokardiale Fibrose und Matrixveränderungen. Ebenso von Bedeutung sind Endotheldysfunktionen im Sinne einer Mikroangiopathie mit konsekutiver Inflammation und endotheliale Dysfunktion. (Abb. 2)
Einen wesentlichen pathophysiologischen Mechanismus stellt sicherlich auch die kardiale autonome diabetische Neuropathie (KADN) dar, die mit Herzfrequenzstarre, orthostatischer Dysregulation und auch Symptomarmut bei Akutereignissen imponiert. Die meistens mit Typ-2-Diabetes kombiniert einhergehende Hypertonie führt zu weiteren pathophysiologisch negativen Mechanismen wie vermehrter Neigung zu Plaqueruptur bei erhöhter Thrombogenität. Dies verschärft das Gefäßrisiko abermals. Hypercholesterin- und Triglyzeridämie sowie natürlich Rauchen, Alter, Geschlecht, positive Familienanamnese und Sozialstatus zählen ebenso zu den entscheidenden Risikofaktoren.
Atherosklerotisches Verteilungsmuster
Patienten mit Diabetes zeigen ein ganz diffuses atherosklerotisches Verteilungsmuster mit bevorzugtem Befall der proximalen Koronargefäße und des Hauptstammes sowie spezifischen Veränderungen im Bereich der kleinen Gefäße mit einer deutlichen Verdickung der Basalmembran im Bereich der Kapillaren. Auch zeigt sich ein deutlicher Unterschied im Verteilungsmuster der Koronarinsuffizienz zwischen Frauen und Männern.
Kardiale autonome diabetische Neuropathie
Wie bereits beschrieben, führt die kardiale autonome diabetische Neuropathie (KADN) zu Störungen in der Ischämiewahrnehmung und damit zu einer höheren Anzahl stummer Ischämien. Ebenso kommt es in weiterer Folge bei erhöhter Herzfrequenz zu einer Herzfrequenzstarre in Verbindung mit der kardialen autonomen Neuropathie. Dies kann zu pathologischen EKG-Veränderungen in Ruhe und auch nach Belastung und bei Myokardhypertrophie ohne direkten Nachweis einer Pathologie in der Koronarangiografie führen. Bereits bei Erstdiagnose weisen circa 9 % aller Patienten Zeichen einer KADN auf. Dieser Befund nimmt im Verlauf der Erkrankung zu, sodass er im Gesamtkollektiv aller Patienten mit Typ-2-Diabetes bei circa 35 % liegt. Man kann die KADN aber auch bei etwa 25 % der Patienten mit Typ-1-Diabetes nachweisen. Die Fünfjahresmortalität liegt bei 25 % im Vergleich zu 4 % bei Patienten mit Diabetes ohne KADN.
Symptome der KADN:
- reduzierte Herzfrequenzvariabilität
- Ruhetachykardie (Vagusläsion), fixierte Herzfrequenz
- Belastungsintoleranz (eingeschränkter Anstieg von Herzfrequenz und Blutdruck)
- orthostatische Hypotonie (Sympathikusläsion)
- stumme Myokardischämie
- nächtliche Blutdruckerhöhung
- diastolische Dysfunktion
Klinisch diagnostisch für die KADN ist das Fehlen oder die Abnahme der Herzfrequenzvariabilität (24-h-EKG), eine orthostatische Blutdruckfehlregulation im Sinne einer Hypotonie (Schellong-Test) sowie eventuell ein Non-Dipping in der 24-Stunden-Blutdruckmessung.
Herzinsuffizienz und Diabetes
Es ist bekannt, dass Herzinsuffizienz und Diabetes Hand in Hand gehen. Wie oben bereits beschrieben, sind auch hier die gleichen Effekte wirksam.
Es ist notwendig, die diabetische Kardiomyopathie neu zu definieren. In den Lehrbüchern erscheint diese Erkrankung eher als Rarität. Wahr ist vielmehr, dass Diabetes durch die Hyperglykämie von Beginn an Schäden im Bereich der kardialen Struktur und der Myozyten verursacht. Das heißt, der diabetische Schaden am Herz ist ein Resultat eines langwierigen (über Jahre und Jahrzehnte) ablaufenden Prozesses, der das Myokard betrifft. Diese Prozesse laufen lange vor der Diagnose beziehungsweise vor dem Manifestwerden des Diabetes mellitus ab. Rezente Untersuchungen konnten zeigen, dass durch Hyperglykämie Veränderungen in der Gen- beziehungsweise insbesondere in der Proteinstruktur in Kardiomyozyten stattfinden. In einer aktuellen Untersuchung werden mehr als 300 Substrate und Substanzen im hyperglykämischen Milieu gegenüber dem Normalzustand verändert. (Abb. 3)
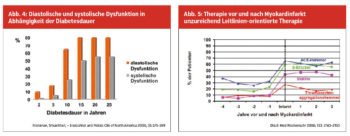
Diabetes führt hauptsächlich oder zumindest zuerst zur diastolischen Dysfunktion. Erst in weiterer Folge entwickelt sich auch eine systolische Dysfunktion. Wie Studien zeigen konnten, ist die diastolische Dysfunktion prognostisch ähnlich schlecht wie eine bestehende systolische Dysfunktion. (Abb. 4)
Das Risiko für Patienten mit Diabetes, an einer Herzinsuffizienz zu erkranken, steigt mit dem Alter (HR 1,4), einer KHK (HR 2,36), dem BMI (1,12), dem HbA1c (HR 1,32) und der Diabetesdauer (HR 1,05) signifikant an. Umgekehrt besteht bei etwa einem Viertel der Patienten mit manifester Herzinsuffizienz auch ein manifester Diabetes, bei weiteren 25 % wird Diabetes neu diagnostiziert. Ein weiteres Viertel der Herzinsuffizienz-Patienten zeigt eine gestörte Glukosetoleranz, und die restlichen 23 % eine Störung im Bereich der Insulinwirkung, also eine Insulinresistenz. Somit sind fast alle Patienten mit manifester Herzinsuffizienz an einer Glukosestoffwechselstörung erkrankt. Bei 2.500 Diabetespatienten in stationären Diabetesambulanzen zeigte sich, dass 37 % eine Erhöhung des NT-proBNP über 125 pg/ml haben. Von diesen Patienten hatte aber nur circa die Hälfte zuvor ein kardiovaskuläres Ereignis. Die meisten dieser Patienten litten an einer HFpEF, einer diastolischen Dysfunktion ohne linksventrikuläre Einschränkung. Diese Patienten zeigten ein deutlich erhöhtes Risiko für kardiovaskuläre Erkrankungen im fünfjährigen Follow-up im Vergleich zur Diabetespopulation mit normalen BNP-Werten. Aus diesen Daten ergibt sich, dass die Messung von NT-proBNP in der Population mit Diabetes von Nöten ist, um Patienten mit erhöhtem Risiko von jenen mit weniger hohem Risiko abzugrenzen (NT-proBNP). In den aktuellen Zahlen aus den NHANES-Studien konnte eine deutliche Reduktion von 1990 bis 2015 bei Patienten mit Diabetes und Myokardinfarkt wie auch Schlaganfall festgestellt werden. Das Risiko, einen Myokardinfarkt zu erleiden, wurde um fast 70 % reduziert, jenes, einen Schlaganfall zu erleiden um 30 %. Ungeachtet dessen ist die Wahrscheinlichkeit eines kardiovaskulären Ereignisses bei Patienten mit Diabetes mellitus trotzdem noch zehnmal so hoch wie bei Patienten ohne Diabetes.
Konsequenzen für die Therapie
Grundsätzlich gibt es bei der Therapie der KHK beziehungsweise auch nach stattgehabtem Ereignis keinen Unterschied zwischen Patienten mit und ohne Diabetes. Diabetespatienten sind allerdings von Beginn an als Population mit hohem Risiko anzusehen und sind daher als solche bei der Sekundärprävention zu berücksichtigen. Bei Koronarsklerose ist die Diskussion perkutane koronare Intervention mit Stent versus operative Bypassanlage derzeit noch offen. Patienten mit Mehrgefäßerkrankung profitieren scheinbar mehr von einer Bypassoperation. Auch die Therapie der diabetischen Herzinsuffizienz unterscheidet sich nicht von jener der nichtdiabetischen Herzinsuffizienz. Zu bedenken ist hier, dass in unseren Untersuchungen bei allen Patienten mit Herzinsuffizienz eine Glukosestoffwechselstörung vorlag. Hinsichtlich der antidiabetischen Therapie und der Therapie bei Herzinsuffizienz (symptomatisch oder asymptomatisch) haben Studien der letzten Jahre gezeigt, dass nach einem stattgehabten Ereignis die Therapie mit einem GLP-1-Agonisten beziehungsweise SGLT2-Hemmer von Vorteil sein könnte. Auch zeigte sich die Therapie mit Pioglitazon bei Patienten mit Zustand nach Insult überlegen. Zu bedenken ist, dass bei diesen Studien oftmalig ausgesuchte Kollektive untersucht wurden und daher die Umlegung auf alle Patienten noch nicht mit einer gleichartigen harten Evidenz hinterlegt ist. Der wesentlichste Therapieaspekt ist eine ärztliche Verordnung von Medikamenten und Lebensstilmaßnahmen einerseits und andererseits, die Patienten zu Therapietreue zu animieren. In einer deutschen Untersuchung nahmen ein Jahr nach Myokardinfarkt nur 50 % der Patienten Beta-Blocker, Statine beziehungsweise RASS-Hemmer ein, Thrombozytenaggregationshemmer überhaupt nur um die 15 %. (Abb. 5)
- Diabetes und kardiovaskuläre Erkrankungen sind eng vergesellschaftet.
- Diabetespatienten haben oft eine atypische Symptomatik bei Auftreten von kardialen Ischämien. Diese verlaufen oft schmerzlos, äußern sich eventuell mit Atemnot und Leistungsabfall.
- NT-BNP ist der stärkste unabhängige Kurzzeitprognosemarker für kardiovaskuläre Ereignisse und Gesamtmortalität bei Patienten mit Diabetes, unabhängig von einer bekannten kardialen Erkrankung.
- Bei jedweder Herzerkrankung soll nach einer Glukosestoffwechselstörung gefahndet werden.
- Wünschenswert ist eine HbA1c-Bestimmung bei allen Patienten.
- Sollte der HbA1c-Wert zwischen 5,7 und 6,4 % liegen, ist ein OGTT anzuschließen.
- Keines der für die Herzinsuffizienz- oder KHK-Therapie vorgesehenen Medikamente ist bei Diabetes kontraindiziert.
- Nach einem stattgehabten Ereignis ist die Therapie mit einem GLP-1-Agonisten, SGLT2-Hemmer beziehungsweise Pioglitazon (Insult) von Vorteil.
Literatur beim Verfasser.