Moderne Therapieoptionen bei diabetischer Nierenerkrankung
Die diabetische Nierenerkrankung (DKD) hat aufgrund ihrer Häufigkeit und schlechten Prognose eine besondere Bedeutung. Die Prävalenz einer chronischen Nierenerkrankung (CKD) in der diabetischen Population wird in Österreich auf etwa 25% geschätzt.1 Laut dem Österreichischen Dialyse- und Transplantationsregister verursacht die diabetische Nierenerkrankung ein Viertel aller Fälle von dialysepflichtigem chronischem Nierenversagen, ein weiteres Viertel ist der hypertensiv-vaskulären Nierenerkrankung geschuldet. Weiters sind das Ausmaß der Albuminurie und der eGFR-Einschränkung unabhängige Prädiktoren für das kardiovaskuläre Risiko und die Mortalität.2 Trotz der aktuellen Entwicklungen bleiben die Optimierung der Diabetestherapie sowie der antihypertensiven Therapie neben Lebensstilmodifikationen die altbewährte Basis in der Verhinderung eines Neuauftretens bzw. Fortschreitens einer diabetesassoziierten Nierenschädigung.3, 4 Darüber hinaus konnte ein nachhaltiger Effekt einer mehrjährigen stringenten Blutzuckereinstellung auf mikrovaskuläre Endpunkte bei Typ-2-Diabetes (T2D) über 10 Jahre und bei Typ-1-Diabetes (T1D) über 30 Jahre gezeigt werden.5,6
Über Dekaden war die Etablierung einer RAAS-Blockade die einzige therapeutische Option zur Reduktion der Proteinurie sowie zur Verzögerung der CKD-Progression unabhängig vom Blutdruck, weshalb sie im klinischen Alltag ein breites Einsatzspektrum findet.
Therapeutische Ansätze
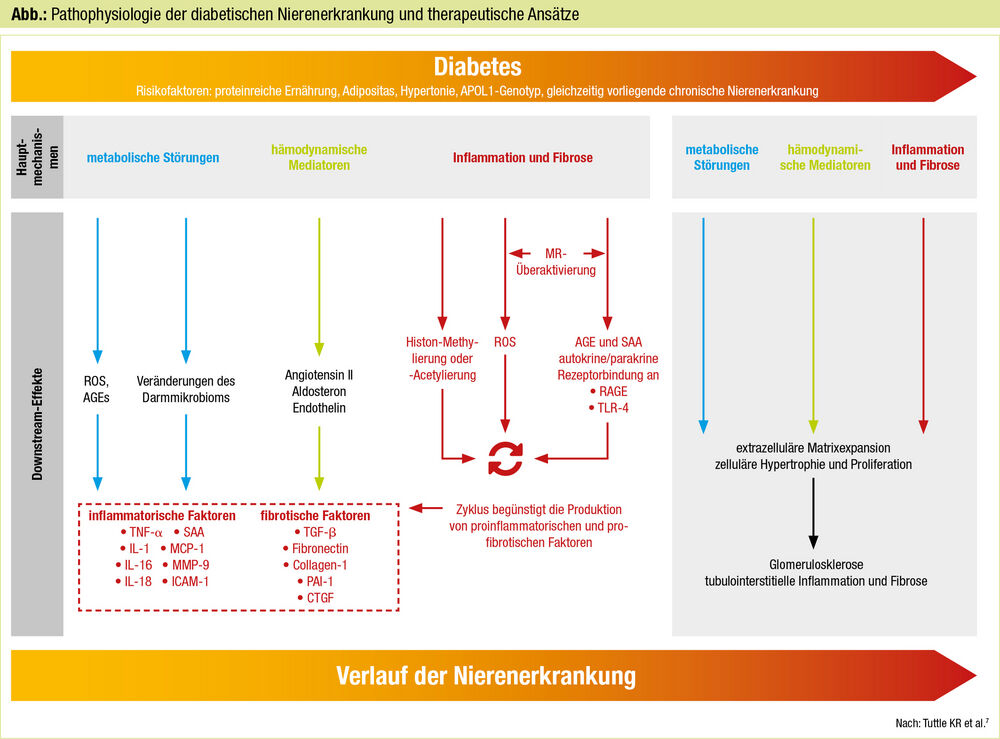
In den KDIGO-Blutdruckleitlinien von 2021 wird bei Diabetes mit Hypertonie und einer Albumin-Kreatinin-Ratio im Spontanharn über 30 mg/g der Einsatz von ACE-Inhibitoren oder AT1-Rezeptorblockern empfohlen (Evidenzgrad 1B). In zahlreichen Studien mit RAAS-Blockern zeigte sich allerdings ein weiterhin hohes residuales Risiko für eine CKD-Progression, sodass nach zusätzlichen therapeutischen Ansätzen gesucht wurde, die der sehr komplexen Pathophysiologie der diabetischen Nierenerkrankung gerecht werden (Abb.).7
Ältere diesbezügliche Ansätze der Modifikation der glomerulären Ladungsselektivität mit Sulodexid bzw. der antiinflammatorische Ansatz mit Bardoxolon-Methyl haben sich mangels Effekt auf die GFR bzw. wegen kardialer Sicherheitsbedenken nicht durchgesetzt.8, 9
SGLT2-Hemmer: Inhibitoren des Natrium-Glukose-Kotransporters 2 (SGLT2i, Gliflozine) sind seit 2012 von der EMA für die Diabetestherapie zugelassen. Bereits in den Zulassungsstudien fanden sich Hinweise auf positive Effekte in kardialer und nephroprotektiver Hinsicht. 2019 konnte in einer Metaanalyse der 3 großen kardiovaskulären Outcome-Studien (EMPA-REG OUTCOME, CANVAS, DECLARE-TIMI-58) eine 45%ige Reduktion des sekundären kombinierten Endpunktes Nierenfunktionsverlust, dialysepflichtiges Nierenversagen und renaler Tod gezeigt werden.10
Nach der ersten Studie mit positivem primären renalen Endpunkt bei Menschen mit Typ-2-Diabetes (CREDENCE-Studie; Canagliflozin vs. Placebo) war vor allem die DAPA-CKD-Studie wegweisend. Über 4.300 Patient:innen mit CKD unterschiedlicher Ätiologie (67% Diabetes) mit einer eGFR von 25 bis 75 ml/min/1,73 m² und einer Albumin-Kreatinin-Ratio von 200 bis 5.000 mg/g wurden eingeschlossen. Der primär kombinierte Endpunkt setzte sich aus einer eGFR-Abnahme von über 50%, dialysepflichtigem Nierenversagen (ESRD) sowie renalem und kardiovaskulärem Tod zusammen. Die relative Risikoreduktion (RRR) lag bei 39%, die absolute Risikoreduktion (ARR) bei 5,3%, was bei einer Studiendauer von 2,4 Jahren einer NNT („number needed to treat“) von 19 Patient:innen entspricht.11 Das Studienergebnis war unabhängig vom Diabetesstatus, der eGFR und der Proteinurie.
Noch im Laufen ist die EMPA-KIDNEY-Studie (Empagliflozin vs. Placebo), die insbesondere auch normoalbuminurische Patient:innen mit höhergradig eingeschränkter Nierenfunktion untersucht. Mehrere Real-Life-Kohortenstudien konnten mittlerweile die positiven Auswirkungen von SGLT2i auf die Progression einer CKD bestätigen.
Auch zwei Herzinsuffizienzstudien bei reduzierter linksventrikulärer Pumpfunktion bestätigten die kardiovaskuläre und renale Protektion unabhängig vom Vorliegen eines Diabetes (DAPA-HF, EMPEROR-Reduced).12, 13
Die kardiovaskulären und renalen Effekte der SGLT2i sind unabhängig von der glykämischen Wirkung zu sehen und persistieren auch bei niedriger eGFR. Diskutierte Mechanismen reichen von intraglomerulärer Drucksenkung, diuretischem Effekt mit kardialer Vorlastsenkung, Verschiebung des zellulären Metabolismus zur präferenziellen Ketonkörperverwertung und Verbesserung der zellulären Sauerstoffversorgung bis hin zu einer günstigen Beeinflussung der Endothelfunktion, zellulärer Reprogrammierung sowie antioxidativer, antiinflammatorischer und antifibrotischer Wirkung an Niere und Herz.14
Die beschriebenen Studienergebnisse schlagen sich auch in den rezenten KDIGO-Leitlinien mit einem Evidenzgrad 1A für CKD-Patient:innen mit Diabetes nieder. Ein Therapiebeginn kann entsprechend der Zulassung bei Dapagliflozin bis zu einer eGFR von 25 ml/min erfolgen, eine Weiterführung wird auch darunter empfohlen. Die antihypertensive und diuretische Begleittherapie soll gegebenenfalls reduziert oder modifiziert werden, um die Etablierung bzw. Weiterführung der nephroprotektiven Behandlung ausschöpfen zu können.
GLP-1-Rezeptoragonisten: In einer Metaanalyse 2019 zum kardiovaskulären Wirkprofil von GLP-1-Agonisten (GLP-1-RA) wurde auf die Studiendaten von sieben randomisierten klinischen Studien mit insgesamt 56.000 inkludierten Patient:innen zurückgegriffen. Die relative Risikoreduktion für schwerwiegende kardiovaskuläre Ereignisse betrug 12%. Das Risiko für einen kombinierten renalen Endpunkt wurde relativ um 17% verringert (NNT 62 über 3,2 Jahre), vor allem bedingt durch eine Abnahme der Albuminurie.15
In der AMPLITUDE-O-Studie (Efpeglenatid vs. Placebo) wurde die Inzidenzrate für den primären kardiovaskulären Endpunkt relativ um 27% im Vergleich zu Placebo reduziert. Die relative Risikoreduktion für den kombinierten renalen Endpunkt war signifikant um 32% niedriger als unter Placebo (ARR 5,4%, NNT 19 über 1,8 Jahre).16 Zu bedenken ist bei exendinbasierten GLP-1-RA (Efpeglenatid, Exenatid, Lixisenatid) allerdings eine doppelt so hohe Rate anaphylaktoider Reaktionen im Vergleich zu humananalogen GLP-1-RA (Liraglutid, Dulaglutid, Semaglutid, Albiglutid).17
Die FLOW-Studie (Semaglutid vs. Placebo), die noch bis 2024 läuft, wird die erste Studie eines GLP-1-RA mit einem primären kombinierten renalen Endpunkt sein.
Ganz rezent wurden auf der Tagung der ADA (American Diabetes Association) 2022 die Ergebnisse der SURPASS-4-Studie präsentiert. Dabei konnte auch für das Twinkretin Tirzepatid (kombinierter GIP-/GLP-1-RA) eine 40%ige renale Risikoreduktion gezeigt werden.
In den KDIGO-Leitlinien 2020 wird für Patient:innen mit T2D und CKD, die ihre individuellen glykämischen Ziele trotz Metformin und SGLT2i nicht erreicht haben, oder für jene Patient:innen, die diese Medikamente nicht einnehmen können, ein GLP-1-RA empfohlen (Evidenzgrad 1B).
Finerenon: In Metaanalysen wurde eine additive antiproteinurische Effektivität steroidaler Mineralokortikoidrezeptorantagonisten (MRA) zusätzlich zu ACE-Hemmern oder Angiotensinrezeptorblockern postuliert. Aufgrund des Risikos einer Hyperkaliämie wird das Potenzial dieser Substanzklasse bei Patient:innen mit CKD jedoch nicht voll ausgenützt. Nichtsteroidale MRA wie Finerenon haben v.a. den Vorteil der geringeren hormonellen Nebenwirkungen (Gynäkomastie 10–15% unter Spironolacton vs. 0,1% unter Finerenon).
In der FIDELIO-DKD-Studie (eGFR 25–75 ml/min und signifikante Albuminurie; mittlere eGFR 44 ml/min/1,73 m²) wurde durch den nichtsteroidalen MRA Finerenon eine signifikante Risikoreduktion des renalen Endpunktes um 18% erreicht (ARR 3,3; NNT 30 über 2,6 Jahre).18Der kombinierte sekundäre kardiovaskuläre Endpunkt wurde um 14% reduziert, die Hyperkaliämiehäufigkeit war unter Finerenon doppelt so hoch (18,3 vs. 9%), führte aber nur in 2,3% zu einem dauerhaften Therapieabbruch (vs. 0,9% Placebo).
Umgekehrt war in der FIGARO-DKD-Studie mit ähnlichem Studiendesign und besserer Ausgangsnierenfunktion (eGFR 68 ml/min/1,73 m²) unter Finerenon beim primären kardiovaskulären Endpunkt eine relative Risikoreduktion von 13% feststellbar, die primär durch eine reduzierte Hospitalisierung aufgrund von Herzinsuffizienz getragen wurde. Der kombinierte renale (sekundäre) Endpunkt war grenzwertig nicht signifikant um 13% vermindert. Eine Hyperkaliämie trat in der mit Finerenon behandelten Gruppe vergleichsweise häufiger auf (10,8% vs. 5,3%).19 Finerenon ist unter dem Handelsnamen Kerendia® in der Europäischen Union bereits zugelassen.
Durch das unterschiedliche Studiendesign ist ein direkter Vergleich des nephroprotektiven Effektes zwischen Finerenon und SGLT2i nicht möglich. Eine Post-hoc-Analyse der FIDELIO-CKD-Studie anhand von Patient:innen, die den Einschlusskriterien der CREDENCE-Studie entsprechen, legt eine vergleichbare Effektgröße nahe.20
Entscheidender für die Praxis ist aufgrund des geringeren Nebenwirkungsprofils der SGLT2i allerdings die Frage, ob eine Kombinationstherapie einen Benefit bringt. Hinsichtlich des Hyperkaliämierisikos kann diese Frage bejaht werden, da es unter gleichzeitiger SGLT2i-Therapie halbiert wurde (8,1 vs. 18,7%), Kaliumwerte über 6 mmol/l fanden sich nicht (ohne SGLT2i 4,7%!).21 Inwieweit die Kombination von Finerenon und SGLT2i eine additive nephroprotektive Wirkung zeigt, werden künftige Studien zeigen.22
In den nächsten KDIGO-Leitlinien für das Diabetesmanagement bei Patient:innen mit CKD, die 2022 erscheinen sollen, wird Finerenon ein gewisser Stellenwert zugeordnet werden, v. a. hinsichtlich einer additiven antiproteinurischen Therapie.
Endothelin-Rezeptor-Antagonisten: Experimentelle Daten zur Substanzklasse der Endothelin-Rezeptor-Antagonisten haben in der Vergangenheit eine nephroprotektive Wirkung nahegelegt.
Nachdem die ASCEND-Studie mit Avosentan wegen Flüssigkeitsretention und Herzinsuffizienz frühzeitig beendet wurde, konnte in der SONAR-Studie unter Atrasentan der kombinierte renale Endpunkt um 35% reduziert werden (ARR 0,9%, NNT 111 über 2,2 Jahre).23, 24 Eingeschlossen wurden in Letztere allerdings nur Patient:innen, die zumindest eine 30%ige Albuminuriereduktion unter RAAS-Blockern ohne klinisch relevante Flüssigkeitsretention zeigten. Nur 50% der Patient:innen konnten letztendlich randomisiert werden, sodass die geringe therapeutische Breite der Endothelin-Rezeptor-Antagonisten wohl auch in Zukunft den limitierenden Faktor für einen breiten Einsatz darstellt. Atrasentan ist derzeit in der Indikation der diabetischen Nierenerkrankung nicht zugelassen.
Zusammenfassung
Auf dem Gebiet der diabetischen Nierenerkrankung (DKD) konnte in den letzten Jahren die therapeutische Bandbreite deutlich erweitert werden. Durch die beschriebenen Entwicklungen ist es möglich, neben einer Progressionsverzögerung einer DKD auch kardiovaskuläre Ereignisse zu vermeiden und die Mortalität zu verringern. Vor allem SGLT2i sind mittlerweile auch über den Diabetes hinaus aus der Nephrologie und Kardiologie nicht mehr wegzudenken. Ihr besonderer Stellenwert wird auch in den KDIGO-Leitlinien hervorgehoben. Die große Frage für die Zukunft wird lauten, welche Patient:innen von welcher Therapie in Bezug auf die Nephroprotektion am meisten profitieren, sodass wir uns einer personalisierten Therapie bei der Behandlung der diabetischen Nierenerkrankung annähern können.
























































































