Neue Therapieoptionen für chronisch entzündliche Darmerkrankungen
Um die Jahrtausendwende markierte die Einführung von Infliximab, einem monoklonalen Antikörper gegen TNF, einen wichtigen Meilenstein in der Therapie der steroidrefraktären CED.
In den nächsten Jahren kam es zur Zulassung von anderen TNF-Inhibitoren (Adalimumab, Golimumab [nur bei Colitis ulcerosa, CU, zugelassen], Certolizumab pegol [nur in der Schweiz und nur für Morbus Crohn, MC, zugelassen]) und weiteren effektiven Medikamenten mit unterschiedlichen Wirkmechanismen wie einem Integrin-Antikörper (Vedolizumab), einem IL-12/-23-Antikörper (Ustekinumab) und einem JAK-Inhibitor (Tofacitinib für die CU). In den letzten Monaten sind nun weitere Möglichkeiten zur Therapie der CED hinzugekommen, die in diesem Artikel beleuchtet werden.
Anti-IL-23-Antikörper
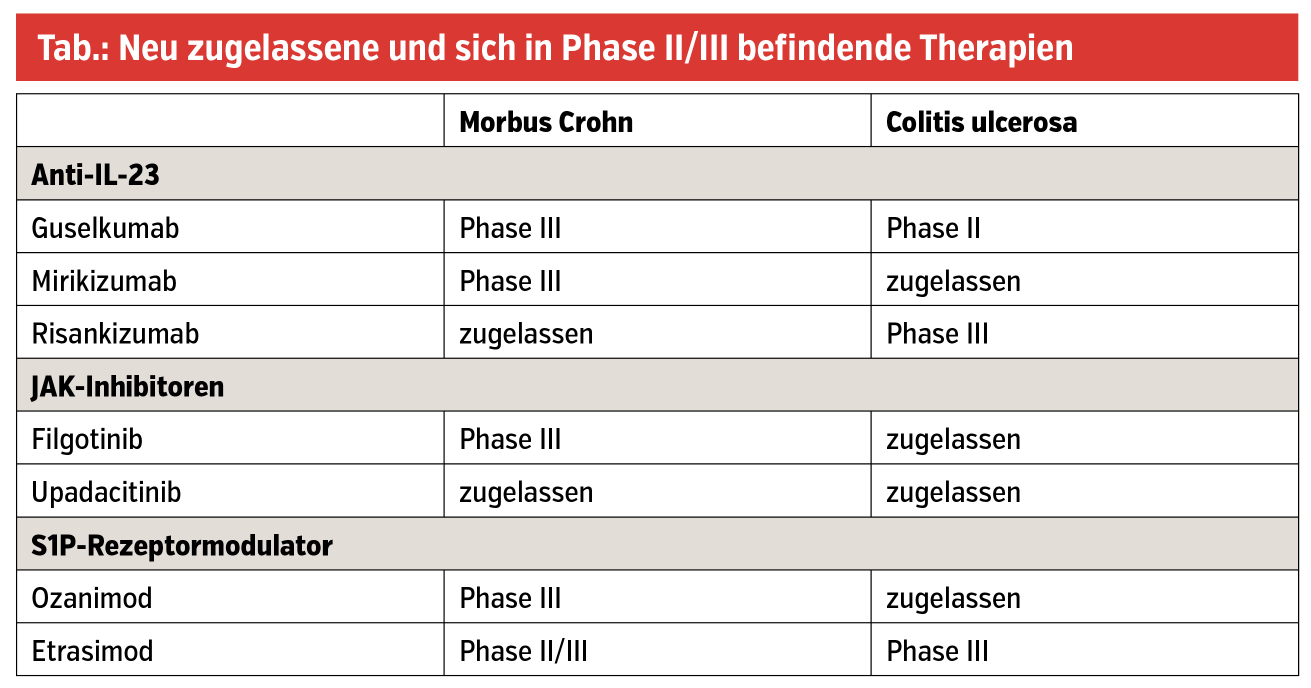
Vor wenigen Jahren wurde Ustekinumab, das die p40-Untereinheit von IL-12/IL-23 hemmt, in Europa für die Therapie des MC und später für die CU zugelassen. Da in den folgenden Jahren das IL-23 als das relevantere Interleukin für die Entstehung der Entzündung identifiziert wurde, wurde an einer selektiveren Hemmung des IL-23 über die p19-Untereinheit geforscht. Risankizumab ist nun solch ein selektiver IL-23-Hemmer, der in der EU für die Therapie eines MC seit November 2022 zugelassen ist. Studien bestätigen eine signifikant höhere Effektivität gegenüber Placebo und ein hohes Sicherheitsprofil bei Patient:innen ohne und – noch wichtiger – auch mit einer vorherigen erfolglosen Biologikatherapie. In einer kürzlich publizierten Netzwerkmetaanalyse wird Risankizumab sogar als das präferierte Biologikum bei biologikanaiven und -vortherapierten MC-Patient:innen zur Induktionstherapie angesehen. Ähnlich zu Risankizumab sind weitere selektive IL-23-Hemmer wie Guselkumab und Mirikizumab (bereits zugelassen für CU) in der Pipeline für die CED (Tab.).
JAK-Inhibitoren
Die Januskinase-Hemmer (JAK-Inhibitoren) gehören zu den Small Molecules, die im Gegensatz zu den Biologika eine kürzere Halbwertszeit haben, peroral eingenommen werden können und theoretisch kein Risiko für eine Immunogenität (Antikörperbildung) haben. Nachdem Tofacitinib, ein Pan-JAK-Inhibitor, im Jahr 2018 in der EU für die Therapie der CU zugelassen wurde, wurden nun weitere, selektivere JAK-Inhibitoren für die CED zugelassen oder stehen kurz davor. Der erste in Österreich verfügbare und erstattete JAK-1-Hemmer für die Therapie der CU ist Filgotinib, der in der SELECTION-Studie bei biologikanaiven und -refraktären Patient:innen eine signifikant höhere Effektivität gegenüber Placebo zeigte. Zusätzlich sind kürzlich gezeigte Daten aus der Phase-II-Studie von Filgotinib bei Patient:innen mit einem Morbus Crohn bezüglich eines perianalen Fistelverschlusses vielversprechend.
Ein weiterer bereits in der EU zugelassener selektiver JAK-1-Hemmer für CU und seit April 2023 auch für MC ist Upadacitinib, das in zwei Netzwerkmetaanalysen als das präferierte Medikament zu Induktionstherapie bei CU angesehen wird.
Obwohl bezüglich des Risikos eines Herpes Zoster (HZ) ein Klasseneffekt angenommen wird, zeigen Daten bei den selektiven JAK-1-Inhibitoren ein geringeres Risiko als mit einer Therapie mit Tofacitinib. Das aber weiterhin im Gegensatz zur Normalbevölkerung klar erhöhte Risiko eines HZ rechtfertigt bei allen Patient:innen unter einem JAK-Inhibitor, unabhängig vom Alter, eine Impfung mit Shingrix®.
Da JAK-Inhibitoren bei Ratten und Hasen eine teratogene Wirkung haben, muss eine Schwangerschaft (bei noch fehlenden Daten beim Menschen) unter allen Umständen vermieden werden.
JAK-Inhibitoren eröffnen mit ihrer schnellen Wirksamkeit und kurzen Halbwertszeit neue Möglichkeiten in der Therapie der CED. Ob diese nun anstelle von Steroiden zum kurzzeitigen Einsatz kommen oder sogar bei einem akuten schweren Schub einer CU eingesetzt werden können, müssen uns zukünftige Studien belegen. Auch hinsichtlich des Sicherheitsprofils dieser neuen Medikamente bleiben heutzutage mehrere Fragen offen. Langzeitdaten werden uns diese hoffentlich in den nächsten Jahren beantworten können.
S1P-Rezeptormodulatoren
Ozanimod ist ein weiteres neu zugelassenes Small Molecule zur Therapie der CU und gehört zur Klasse der oralen Sphingosin-1-Phosphat-(S1P-)Rezeptormodulatoren. Diese Medikamentenklasse hindert die Migration von Lymphozyten zu Entzündungsorten und wird zur Therapie der multiplen Sklerose seit 2011 eingesetzt. Ozanimod bindet an den S1P1- und S1P5-Rezeptor und ist somit selektiver als der erstzugelassene S1P-Rezeptormodulator Fingolimod (nur zugelassen für die multiple Sklerose). Eine Phase-III-Studie beim MC ist noch nicht abgeschlossen. Etrasimod ist ein weiterer selektiver S1P-Rezeptormodulator, bei dem eine Phase-II-Studie beim MC und eine Phase-III-Studie bei der CU noch am Laufen sind.
Die S1P-Rezeptormodulatoren sind AV-überleitungsverzögernde Medikamente und können somit höhergradige AV-Blöcke und Bradykardien verursachen. Bei Patient:innen mit zusätzlichem Betablocker ist deshalb Vorsicht geboten. Kontraindiziert ist die Therapie bei Patient:innen mit kürzlichem Herzinfarkt, Herzinsuffizienz NYHA III/IV oder schon bekannten höhergradigen AV-Blockierungen. Eine EKG muss vor und bis zu 4 Stunden nach der Therapie durchgeführt werden. Eine weitere, seltene Nebenwirkung ist ein Makulaödem, weshalb ophthalmologische Kontrollen bei Patient:innen mit Risikofaktoren (z. B. mit einem Diabetes mellitus) notwendig sind. Eine Lymphopenie ist dem Wirkmechanismus geschuldet und kann bis zu einer absoluten Zahl von 500/μl toleriert werden. Ozanimod ist in Österreich zugelassen, ist aber in der No Box.